【论著选登】| MSI-H/dMMR对BRAF V600E突变型的手术可切除结直肠癌患者的临床病理学特征及预后的影响
2025-01-09 中国癌症杂志 中国癌症杂志 发表于陕西省
本研究揭示了MSI-H肿瘤在BRAF突变状态下的预后优势,但这种优势可能仅限于可手术切除的CRC,未来的研究需要进一步探讨MSI-H/dMMR与BRAF共突变在不同分期CRC中的预后预测价值。
结直肠癌(colorectal cancer,CRC)是一种涉及多基因、多步骤累积的复杂疾病,具有高度的异质性。微卫星不稳定性(microsatellite instability,MSI)和BRAF基因突变是CRC分子特征中的两个关键指标。有研究[1-3]表明,MSI与错配修复系统(mismatch repair,MMR)的检测结果具有较好的一致性。BRAF基因突变,尤其是V600E位点的突变,会导致细胞增殖与凋亡平衡的破坏,促进肿瘤的发生、发展[4]。据估计,8%~10%的转移性CRC患者携带BRAF V600E突变[5]。多个临床指南,包括中国临床肿瘤学会(Chinese Society of Clinical Oncology,CSCO)发布的CRC诊疗指南[6],均将MSI和BRAF突变检测列为转移性CRC患者的基本检测项目,并给予Ⅰ类推荐。MSI和BRAF基因突变在患者的治疗决策和预后评估中扮演着至关重要的角色。高度MSI(MSI-high,MSI-H)/错配修复缺陷(mismatch repair deficiency,dMMR)的CRC患者群体对某些化疗药物的反应通常较差,然而,这些患者可能对免疫检查点抑制剂表现出较好的反应性[7]。在Ⅱ期结肠癌中,MSI-H/dMMR状态被认为是一个预后良好的生物标志物,指示肿瘤的恶性程度较低,患者生存期较长[8]。然而在Ⅲ~Ⅳ期结肠癌中,MSI-H状态对患者预后的影响存在争议,仍有待进一步研究[9-10]。另一方面,携带BRAF V600E突变的CRC患者通常面临较差的预后,且对标准化疗方案的响应率较低[11]。BRAF突变状态无论是在早期还是晚期转移性CRC中,都被认为是一个重要的生存预测因素。尽管目前已经有针对MSI-H状态且携带BRAF突变的肿瘤的免疫检查点抑制剂,以及在一线治疗中采用的细胞毒性化疗联合抗血管内皮生长因子(vascular endothelial growth factor,VEGF)药物治疗策略,和在二线治疗中应用的表皮生长因子受体(epidermal growth factor receptor,EGFR)联合BRAF抑制剂的治疗方案,但BRAF突变患者的整体预后依然较差[5,12]。因此,这两种检测对于制订个体化治疗方案具有不可或缺的作用。
2015年,基于CRC的转录组学特征,CRC被国际共识分为4种分子亚型:共识分子分型1(consensus molecular subtype 1,CMS1)(MSI免疫型)、CMS2(经典型)、CMS3(代谢型)和CMS4(间质型)[13]。CMS1的典型特征包括高度的MSI、免疫细胞浸润的肿瘤微环境、高度CpG岛甲基化、低体细胞拷贝数量变异及BRAF基因突变。CMS2的典型特征为染色体不稳定,体细胞拷贝数异常较高,同时具有APC基因突变和Wnt信号通路激活。CMS3具有显著的代谢异常特征,包括糖代谢、脂质代谢和核苷酸代谢异常,其肿瘤免疫原性较低,同时具有高频的KRAS基因突变。CMS4常出现上皮-间充质转化(epithelial-mesenchymal transition,EMT)相关基因上调及血管生成异常,并伴有转化生长因子-β(transforming growth factor-β,TGF-β)信号通路激活,其复发率较高且存活率较低。然而,CMS分类并未全面考虑CRC微环境中的其他基质细胞(如免疫细胞、成纤维细胞和血管内皮细胞等)对肿瘤分类的影响。2022年,Joanito等[14]利用单细胞测序技术对CRC进行了更为细致的分类,提出了“IMF”分子亚型,该亚型结合了上皮状态、微卫星状态和纤维化程度的特征,以期作为临床分层和基于亚型的靶向干预措施的基础。尽管转录组学和单细胞组学分析为CRC分类提供了新视角,但其依赖于新鲜肿瘤组织样本、高通量测序技术和复杂的数据分析,限制了其在临床上的广泛应用。
目前,CRC的分子检测中,最常用的包括MSI/MMR、RAS基因和BRAF基因[15]。在部分病例中,检出BRAF V600E突变和MSI-H/dMMR的共存现象,对临床治疗和预后评估提出了新挑战,因为这种共存可能影响患者的治疗响应和预后。本研究旨在回顾性分析在上海交通大学医学院附属瑞金医院接受CRC根治术的MSI-H/dMMR-BRAF V600E组与微卫星稳定(microsatellite stability,MSS)-BRAF V600E组患者的临床特征和预后差异,以期为CRC患者的个体化治疗提供更多依据。
1 资料和方法
1.1 研究对象
回顾性收集2018年1月—2022年12月上海交通大学医学院附属瑞金医院普外科收治的1 270例CRC患者的临床病理学资料及随访资料,有12例患者因分子检测结果缺失而排除,共1 258例患者纳入本研究。所有患者均经病理学检查确诊,排除转移复发癌。通过上海交通大学医学院附属瑞金医院电子病历系统获取患者的临床病理学资料,通过电话随访或门诊随访的形式获取患者的随访资料。本研究通过上海交通大学医学院附属瑞金医院医学伦理委员会批准,伦理编号为2017瑞北伦审第(2)-1。
1.2 观察和评价标准
观察指标包括年龄、性别、肿瘤部位、浸润深度、转移淋巴结数量、是否发生远处转移、临床TNM分期、MSI状态、dMMR状态、BRAF突变及预后。临床病理学分期参照美国癌症联合会第8版TNM分期标准[16]。MSI状态检测采用聚合酶链反应(polymerase chain reaction,PCR)+毛细管电泳法。BRAF突变检测采用扩增受阻突变体系统PCR(amplification refractory mutation system PCR,ARMS-PCR),试剂盒均购自厦门艾德生物医药科技股份有限公司。dMMR蛋白检测(包括MLH1、PMS2、PMS2和PMS6)采用免疫组织化学法。根据国际标准,MSI-H定义为在5个标准微卫星位点中至少有2个位点发生不稳定性[17],dMMR表现为MLH1、PMS2、MSH2和MSH6这4种主要MMR蛋白中任一或多个蛋白的表达缺失。符合MSI-H及dMMR的病例定义为MSI-H/dMMR型。
1.3 分组
按照BRAF突变状态,分成BRAF野生组和BRAF V600E突变组。BRAF V600E突变组根据MSI状态进一步分成MSI-H/dMMR组和MSI-L+MSS组。
1.4 治疗和随访
大多数患者接受根治性手术治疗,部分患者根据疾病情况需要行新辅助治疗、辅助治疗或靶向治疗。本研究随访截至2024年1月31日。
1.5 统计学处理
使用GraphPad软件对数据进行统计分析。分类变量以n(%)表示。组间比较在满足方差齐性的前提下,采用χ2检验;若方差不齐,则选用非配对t检验。生存时间的预后分析采用Kaplan-Meier生存曲线和log-rank检验进行组间比较。为了量化不同组别间生存风险的差异,本研究还计算了风险比(hazard ratio,HR)。P<0.05为差异有统计学意义。
2 结 果
2.1 MSS-BRAF V600E突变与临床病理学特征的关系
在1 258例肠癌患者中,BRAF V600E突变率为4.29%(54/1 258),MSI-H/dMMR发生率为6.68%(84/1 258)。在BRAF V600E突变组中,MSI-H/dMMR发生率为29.63%(16/54),远高于BRAF野生组的5.65%(68/1 204),详见图1。
与MSS-BRAF V600E突变组患者相比,MSI-H/dMMR-BRAF V600E突变组患者的女性比例更高[75.0%(12/16)vs 44.7%(17/38)],CRC首诊年龄更大[(73.19±9.19)岁 vs(62.39±13.02)岁],右半结肠占比高[75.0%(12/16) vs 42.1%(16/38)]。MSI-H/dMMR-BRAF V600E突变患者错配修复基因表达缺失类型均为MLH1和PMS2双表达缺失。在浸润深度上,两组差异无统计学意义(χ2=1.50,P=0.68)。在淋巴结转移和远处转移上,两组差异有统计学意义(χ2=16.34,P<0.01;χ2=5.82,P=0.02),MSI-H/dMMR-BRAF V600E突变组具有较少的淋巴结转移[71.0%(27/38)vs 14.3%(2/16)]及较低的远处转移[0.0%(0/16)vs 28.9%(11/38)]。MSI-H/dMMR-BRAF V600E突变组临床分期Ⅱ期占比较高[75.0%(12/14)],而MSS-BRAF V600E组临床分期Ⅲ和Ⅳ期占比较高[78.9%(30/38)],详见表1。
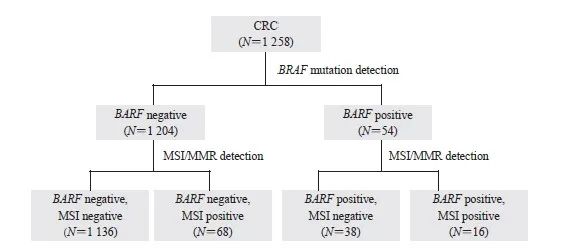
图1 通过BRAF、MSI和MMR检测对CRC患者进行精细的分子分型
Fig. 1 Molecular subtyping of CRC patients through BRAF, MSI and MMR detection
2.2 MSS-BRAF V600E突变患者的预后特征
BRAF V600E突变的54例患者均获得随访,中位随访时间为31.67(19.13~41.10)个月。Kaplan-Meier生存分析和log-rank检验结果显示,MSI-H/dMMR-BRAF V600E组和MSS-BRAF V600E组的3年总生存率分别为87.5%和57.9%,差异有统计学意义(P=0.021)。Kaplan-Meier生存曲线显示,dMMR降低了BRAF V600E突变患者的死亡风险(HR=0.24,95% CI:0.09~0.64,P=0.039 5,图2)。
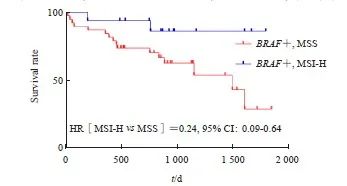
图2 MSS型与MSI-H型BRAF突变肠癌两组间的生存曲线比较
Fig. 2 Survival comparison between MSS type and MSI-H type BRAF-mutated colorectal cancer
The prognosis of MSI-H tumors is markedly superior to that of MSS tumors.
3 讨 论
本研究结果显示,与MSS-BRAF V600E突变患者相比,MSI-H/dMMR-BRAF V600E突变CRC患者更多地出现在临床Ⅱ期,淋巴结转移较少,且生存期较长。Kaplan-Meier生存曲线分析进一步证实,MSI-H/dMMR状态能够显著降低BRAF V600E突变患者的死亡风险。上述发现提示MSI-H/dMMR对手术可切除CRC患者的临床特征和预后的影响可能比BRAF V600E突变更为显著。
BRAF V600E突变和MSI-H/dMMR这两种生物标志物常相互关联,并构成CRC的CMS1分子亚型。MSI-H/dMMR可能源于遗传因素(如林奇综合征)或散发性因素。值得注意的是,当MSI-H/dMMR与BRAF V600E突变共存时,几乎可以确定为散发性的MSI-H/dMMR[18]。一项对4项转移性CRC临床试验的汇总分析[19]显示,在BRAF V600E突变的患者中,约有21%的患者合并MSI-H/dMMR。而在MSI-H/dMMR转移性CRC患者中,约有35%的患者也同时存在BRAF V600E突变。本研究中约29.6%的BRAF V600E突变患者同时存在MSI-H/dMMR,而约19.05%的MSI-H/dMMR患者也携带BRAF V600E突变。
鉴于BRAF突变与MSI-H经常重叠,因此,在BRAF突变的CRC患者中,讨论MSI状态与预后的关系十分重要[20]。BRAF V600E突变在转移性CRC中出现的频率为8%~12%,并且与较差的生存率显著相关[21]。BRAF突变的患者更容易出现腹膜转移,即使进行手术切除,总体生存期也较短[22]。MSI-H在CRC中出现的频率为10%~15%,并且在多数Ⅱ期CRC研究中,MSI-H与预后较好相关,而在晚期转移性CRC中与预后较差相关[23-24]。然而,当MSI-H与BRAF V600E突变共存时,对CRC患者的预后影响需要更为细致的考量。有研究[24]表明,即使在BRAF突变的CRC中,MSI-H仍然显示出较好的生存影响,表明MSI-H状态可能在BRAF突变状态下仍然对预后有积极作用。另一方面,有研究指出,BRAF突变可能会削弱MSI-H带来的生存优势,例如,Karki等[25]在对堪萨斯大学癌症中心的Ⅱ/Ⅲ期CRC患者进行回顾性生存分析发现,对于Ⅲ期CRC患者,携带BRAF V600E突变的患者总体生存率较差,且当MSI-H同时存在时,预后将进一步恶化。然而,对于Ⅱ期CRC患者,BRAF V600E突变且非MSI状态是影响预后的主要因素。这种结论的矛盾性可能源于MSI-H对可手术切除的CRC与晚期转移性CRC预后影响的差异。因此,理论上在BRAF突变状态下,MSI-H/dMMR的预后预测价值应在可切除CRC与转移性CRC之间进行区分评估。本研究纳入了接受根治性手术的CRC患者,其中大部分为Ⅲ期及以下分期。即便是分期为Ⅲ期以上的患者,在经过新辅助治疗后也满足手术根治的条件。因此,本研究结果显示,在BRAF突变状态下,MSI-H/dMMR患者的预后可以得到改善。
MSI-H状态也被认为是免疫检查点抑制剂治疗反应的预测因素,合并BRAF突变是否会影响这部分患者从免疫治疗中获益尚不确定。有研究表明,MSI-H/dMMR的患者即使携带BRAF V600E突变,仍然可能从免疫检查点抑制剂治疗中获益,例如,Diaz等[26]研究指出,BRAF突变型和野生型的MSI-H肿瘤在免疫微环境方面具有相似性,表明BRAF突变状态不会影响MSI-H肿瘤对免疫检查点抑制剂治疗的响应。这一点在KEYNOTE-177研究[27]中得到进一步证实,无论是BRAF突变型还是野生型的MSI-H肿瘤,在接受检查点抑制剂治疗时都能够有相似获益。这表明与BRAF V600E突变相比,MSI-H对肠癌患者的免疫微环境的影响更为显著[28]。
综上所述,本研究揭示了MSI-H肿瘤在BRAF突变状态下的预后优势,但这种优势可能仅限于可手术切除的CRC,未来的研究需要进一步探讨MSI-H/dMMR与BRAF共突变在不同分期CRC中的预后预测价值,以及其对患者的治疗响应和生存结果的影响。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:
李军:患者随访,数据收集,文章撰写;
陆亭伟:数据整理,文章修订;
方旭前:数据分析,文章撰写,论文审阅。
[参考文献]
[1] VILAR E, GRUBER S B. Microsatellite instability in colorectal cancer-the stable evidence[J]. Nat Rev Clin Oncol, 2010, 7(3): 153-162.
[2] 中国临床肿瘤学会结直肠癌专家委员会, 中国抗癌协会大肠癌专业委员会遗传学组, 中国医师协会结直肠肿瘤专业委员会遗传专委会. 结直肠癌及其他相关实体瘤微卫星不稳定性检测中国专家共识[J]. 中华肿瘤杂志, 2019. 41(10): 734-741.
The Colorectal Cancer Expert Committee of Chinese Society of Clinical Oncology, the Genetics Group of the Colorectal Cancer Professional Committee of China Anti-Cancer Association, and the Genetics Committee of the Colorectal Cancer Professional Committee of Chinese Medical Doctor Association. Consensus on the detection of microsatellite instability in colorectal cancer and other related solid tumors in China[J]. Chin J Oncol, 2019. 41(10): 734-741.
[3] 黎相照, 刘焕娇, 梁敏仪, 等. 微卫星不稳定性类型及临床病理特征:基于1394例结直肠癌患者的标本检测[J]. 南方医科大学学报, 2020, 40(11): 1645-1650.
LI X Z, LIU H J, LIANG M Y, et al. Clinicopathological features and types of microsatellite instability in 1394 patients with colorectal cancer[J]. J South Med Univ, 2020, 40(11): 1645-1650.
[4] DIENSTMANN R, VERMEULEN L, GUINNEY J, et al. Consensus molecular subtypes and the evolution of precision medicine in colorectal cancer[J]. Nat Rev Cancer, 2017, 17(2): 79-92.
[5] GROTHEY A, FAKIH M, TABERNERO J. Management of BRAF-mutant metastatic colorectal cancer: a review of treatment options and evidence-based guidelines[J]. Ann Oncol, 2021, 32(8): 959-967.
[6] Chinese Society of Clinical Oncology Diagnosis and Treatment Guidelines for Colorectal Cancer Working Group. Chinese Society of Clinical Oncology (CSCO) diagnosis and treatment guidelines for colorectal cancer 2018 (English version)[J]. Chin J Cancer Res, 2019, 31(1): 117-134.
[7] OLIVEIRA A F, BRETES L, FURTADO I. Review of PD-1/ PD-L1 inhibitors in metastatic dMMR/MSI-H colorectal cancer[J]. Front Oncol, 2019, 9: 396.
[8] SARIDAKI Z, SOUGLAKOS J, GEORGOULIAS V. Prognostic and predictive significance of MSI in stages Ⅱ/Ⅲ colon cancer[J]. World J Gastroenterol, 2014, 20(22): 6809-6814.
[9] HESTETUN K E, ROSENLUND N B, STANISAVLJEVIĆ L, et al. Stage-dependent prognostic shift in mismatch repairdeficient tumors: assessing patient outcomes in stage Ⅱ and Ⅲ colon cancer[J]. Front Oncol, 2022, 12: 853545.
[10] FUJIYOSHI K, YAMAMOTO G, TAKENOYA T, et al. Metastatic pattern of stage Ⅳ colorectal cancer with highfrequency microsatellite instability as a prognostic factor[J]. Anticancer Res, 2017, 37(1): 239-247.
[11] LOUPAKIS F, CREMOLINI C, MASI G, et al. Initial therapy with FOLFOXIRI and bevacizumab for metastatic colorectal cancer[J]. N Engl JMed, 2014, 371(17): 1609-1618.
[12] MAURI G, BONAZZINA E, AMATU A, et al. The evolutionary landscape of treatment for BRAF V600E mutant metastatic colorectal cancer[J]. Cancers, 2021, 13(1): 137.
[13]GUINNEY J, DIENSTMANN R, WANG X, et al. The consensus molecular subtypes of colorectal cancer[J]. Nat Med, 2015, 21(11): 1350-1356.
[14]JOANITO I, WIRAPATI P, ZHAO N, et al. Single-cell and bulk transcriptome sequencing identifies two epithelial tumor cell states and refines the consensus molecular classification of colorectal cancer[J]. Nat Genet, 2022, 54(7): 963-975.
[15]郑民华, 张 森, 马君俊. 结直肠癌的分子分型与精准治疗策略:从经验到精确[J]. 中华消化外科杂志, 2023, 22(10): 1155-1159.
ZHENG M H, ZHANG S, MA J J. Molecular typing and precise treatment strategies for colorectal cancer: from experience to precision[J]. Chin j Dig Surg, 2023, 22(10): 1155-1159.
[16]LIU Q, LUO D K, CAI S J, et al. P-TNM staging system for colon cancer: combination of P-stage and AJCC TNM staging system for improving prognostic prediction and clinical management[J]. Cancer Manag Res, 2018, 10: 2303-2314.
[17]HATCH S B, LIGHTFOOT H M JR, GARWACKI C P, et al. Microsatellite instability testing in colorectal carcinoma: choice of markers affects sensitivity of detection of mismatch repair-deficient tumors[J]. Clin Cancer Res, 2005, 11(6): 2180-2187.
[18]COLLE R, LONARDI S, CACHANADO M, et al. BRAF V600E/RAS mutations and Lynch syndrome in patients with MSI-H/dMMR metastatic colorectal cancer treated with immune checkpoint inhibitors[J]. Oncologist, 2023, 28(9): 771-779.
[19]VENDERBOSCH S, NAGTEGAAL I D, MAUGHAN T S, et al. Mismatch repair status and BRAF mutation status in metastatic colorectal cancer patients: a pooled analysis of the CAIRO, CAIRO2, COIN, and FOCUS studies[J]. Clin Cancer Res, 2014, 20(20): 5322-5330.
[20]AASEBØ K Ø, DRAGOMIR A, SUNDSTRÖM M, et al. Consequences of a high incidence of microsatellite instability and BRAF-mutated tumors: a population-based cohort of metastatic colorectal cancer patients[J]. Cancer Med, 2019, 8(7): 3623-3635.
[21]杨利华, 杨树东. RAS、BRAF基因突变及HER2基因扩增与结直肠癌患者临床病理特征及预后的关系[J]. 中华普通外科杂志, 2022, 37(11): 845-849.
YANG L H, YANG S D. Relationship between RAS, BRAF gene mutations and HER2 gene amplification and clinicopathology and prognosis of colorectal cancer[J]. Chin J Gen Surg, 2022, 37(11): 845-849.
[22]YAEGER R, CERCEK A, CHOU J F, et al. BRAF mutation predicts for poor outcomes after metastasectomy in patients with metastatic colorectal cancer[J]. Cancer, 2014, 120(15): 2316-2324.
[23]TAIEB J, SVRCEK M, COHEN R, et al. Deficient mismatch repair/microsatellite unstable colorectal cancer: diagnosis, prognosis and treatment[J]. Eur J Cancer, 2022, 175: 136-157.
[24]NAKAYAMA I, HIROTA T, SHINOZAKI E. BRAF mutation in colorectal cancers: from prognostic marker to targetable mutation[J]. Cancers, 2020, 12(11): 3236.
[25]KARKI S, SUN W J, MADAN R, et al. Microsatellite instability with BRAF V600E associated with delayed presentation but poor survival in stage Ⅲ colorectal cancer[J]. Fortune J Health Sci, 2023, 6(2): 167-173.
[26]DIAZ L A JR, SHIU K K, KIM T W, et al. Pembrolizumab versus chemotherapy for microsatellite instability-high or mismatch repair-deficient metastatic colorectal cancer (KEYNOTE-177): final analysis of a randomised, open-label, phase 3 study[J]. Lancet Oncol, 2022, 23(5): 659-670.
[27]DING Y W, WENG S S, LI X Y, et al. General treatment for metastatic colorectal cancer: from KEYNOTE 177 study[J]. Transl Oncol, 2021, 14(8): 101122.
[28]JOHNSON B, KOPETZ S. Applying precision to the management of BRAF-mutant metastatic colorectal cancer[J]. Target Oncol, 2020, 15(5): 567-577.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#结直肠癌# #MSI-H/dMMR#
23