Science子刊:中山大学梁振兴/康亮/兰平发现GPT1的表达下调与结直肠癌(CRC)的发生和发展密切相关
14小时前 iNature iNature 发表于陕西省
该研究表明谷丙转氨酶1缺乏介导的代谢重编程促进结直肠腺瘤-癌的进展。
结肠直肠癌(CRC)的肿瘤发生通常遵循正常-腺瘤-癌(N-A-C)序列。然而,结直肠腺瘤癌变的分子机制仍不清楚。
2025年1月1日,中山大学梁振兴、康亮及兰平共同通讯在Science Translational Medicine在线发表题为“Glutamic-pyruvic transaminase 1 deficiency–mediated metabolic reprogramming facilitates colorectal adenoma-carcinoma progression”的研究论文,该研究表明谷丙转氨酶1缺乏介导的代谢重编程促进结直肠腺瘤-癌的进展。
在这里,研究人员分析了结直肠癌患者正常、晚期腺瘤和癌组织中的转录谱变化,揭示了结直肠组织中的谷丙转氨酶1 (GPT1)在NA-C过程中下调,并与结直肠癌预后不良相关。在机制上,GPT1被Krüppel样因子4 (KLF4)转录激活。GPT1不仅通过酶依赖性α-酮戊二酸(α-KG)产生和WNT信号抑制,而且通过与亚甲基四氢叶酸脱氢酶1样(MTHFD1L)结合而非酶依赖性破坏叶酸循环,在细胞和小鼠模型中重新编程代谢并抑制CRC肿瘤发生。此外,研究人员鉴定poliumoside为GPT1激活剂,可抑制细胞、患者来源的CRC类器官和患者来源的CRC异种移植(PDX)模型中的CRC进展。该研究揭示了GPT1在结直肠癌发生中的作用,并表明poliumoside是一种预防和治疗结直肠癌的潜在药物。

结肠直肠癌(CRC)是第三种最常见的癌症,具有高发病率和死亡率。CRC演变为从正常结肠上皮开始的分子改变的渐进累积的结果,随着时间的推移,其可以转变为腺瘤,然后转变为癌。因此,正常腺瘤-癌(N-A-C)序列是CRC发展的典型模型。大约85%的结直肠癌源于腺瘤,晚期腺瘤被认为是导致结直肠癌发生的主要癌前病变。腺瘤检出率的增加与结直肠癌风险和死亡率的降低相关,突出了早期检测和清除癌前病变的重要性。然而,一些切除了腺瘤的患者仍然有增加发展新腺瘤或CRC的风险。美国CRC多协会工作组和欧洲胃肠镜学会指南建议息肉切除术后3年内对晚期腺瘤(大小大于或等于10 mm,具有绒毛状或管状绒毛状组织学,或具有高度发育异常)的个体进行结肠镜检查监测。尽管如此,仍然缺乏准确评估腺瘤癌变风险的有效指标,难以确保高危患者得到及时干预,低危患者避免不必要的结肠镜检查。因此,阐明大肠腺瘤癌变的分子机制具有重要意义。
CRC是由腺瘤通过遗传改变、染色体不稳定性和微卫星不稳定性的逐步累积而发展而来的。结肠腺瘤性息肉病(APC)突变发生在大约70%的腺瘤中,APC的失活启动了正常粘膜向腺瘤的转化,随后是特定顺序的额外遗传改变,包括KRAS和TP53突变。CRC的一些遗传驱动因素也是癌症代谢的调节因素。代谢重新编程是CRC细胞的标志,癌基因和肿瘤抑制因子的失调参与细胞代谢的重新布线。尽管包括糖酵解、谷氨酰胺代谢和脂质代谢在内的核心代谢途径在结直肠癌的发生和发展中起着重要作用,但很少有研究探讨在N-A-C过程中驱动代谢重编程的关键因素。
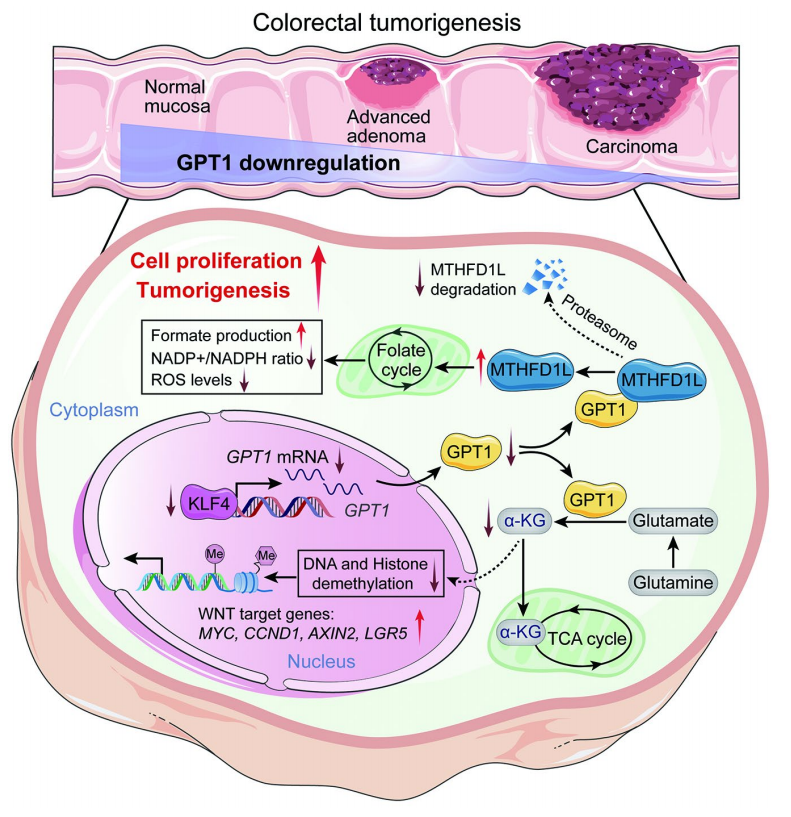
GPT1在CRC肿瘤发生中机制的示意图模型(图源自Science Translational Medicine)
谷丙转氨酶1 (GPT1)及其线粒体同工酶GPT2是中间酶,可逆地催化丙氨酸和α-酮戊二酸(α-KG)之间的转氨作用,产生丙酮酸和谷氨酸,从而在糖异生和氨基酸代谢中发挥关键作用。作为一种细胞质蛋白,GPT1主要分布在肝脏和肠道中。来自CRC组织的单细胞RNA测序(RNA-seq)数据显示GPT1几乎只在上皮细胞中表达。进一步分析显示GPT1在CRC中下调,并且是CRC预后的保护性因素。此外,据报道,GPT1通过改善葡糖丙氨酸循环促进营养缺乏条件下肝细胞癌(HCC)的进展,并通过调节谷氨酰胺代谢促进宫颈癌细胞的增殖和迁移。然而,GPT1在癌症中的确切功能和潜在机制仍未得到充分研究,特别是在CRC的发生和发展中。
在这项研究中,研究人员确定GPT1是一种参与代谢重编程和结直肠癌发生和发展的调节因子。GPT1受KLF4转录调节,从正常粘膜到晚期腺瘤到癌依次降低。GPT1的缺乏通过以酶依赖性和酶非依赖性方式重组细胞代谢来促进CRC肿瘤发生。此外,poliumoside被鉴定为GPT1的细胞活性激活剂,并显示出有效抑制CRC进展。该发现强调了靶向GPT1的酶依赖性和酶依赖性活性可以阻断结直肠癌的进展,并有助于结直肠癌治疗策略的发展。
参考消息:
https://www.science.org/doi/10.1126/scitranslmed.adp9805#tab-contributors
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#结直肠癌# #谷丙转氨酶1缺乏#
5