dMMR/MSI-H III期结直肠癌患者根治性手术后,ctDNA-MRD提示辅助免疫治疗优于化疗
2024-12-28 苏州绘真医学 苏州绘真医学 发表于陕西省
本文呈现了一个有趣的病例系列,涉及两名患有MSI-H III期结肠癌的患者。这两名患者均接受了根治性手术,随后进行传统的辅助联合化疗。
循环肿瘤DNA(ctDNA)是结直肠癌(CRC)中微小残留病灶(MRD)的一项有力检测指标。免疫疗法已在错配修复缺陷或微卫星高度不稳定(dMMR/MSI-H)的转移性CRC中得到广泛应用,在非转移性CRC中的作用仍在快速发展。对于已切除的dMMR/MSI-H的II期CRC,辅助使用氟嘧啶并无益处,因此不被推荐。越来越多的证据表明,在dMMR/MSI-H的局部CRC中,新辅助化疗和放化疗的获益有所降低。本文展示两例dMMR/MSI-H的III期结直肠癌病例,患者接受了根治性手术,术后辅助使用基于奥沙利铂的化疗未能清除血浆中的ctDNA水平,随后改用帕博利珠单抗进行免疫检查点阻断治疗,最终实现了ctDNA的清除。本文的案例表明,对于局部dMMR/MSI-H的结肠癌,化疗可能无法实现最佳的疾病控制,而血浆ctDNA为评估基于奥沙利铂的辅助化疗在清除已切除的dMMR/MSI-H的III期结肠癌微小病灶方面的疗效提供了契机。对于某些特定类型结直肠癌患者,免疫疗法可能比化疗更有效。鉴于在I-III期CRC术后,若未能清除MRD则复发不可避免,且目前化疗仍是已切除的dMMR/MSI-H的III期结肠癌的标准辅助治疗手段,这些发现具有重要的背景意义。
-
ctDNA越来越多地被用于监测接受根治性手术CRC患者的MRD;
-
dMMR或MSI-H状态可预测转移性CRC患者从免疫治疗中获益;
-
越来越多的证据表明,对于已切除的dMMR/MSI-H的II期结肠癌,辅助使用氟嘧啶获益减少;对于dMMR/MSI-H的局部CRC,新辅助常规化疗和放化疗的获益也减少;
-
尽管基于奥沙利铂的化疗仍是已切除的dMMR/MSI-H的III期结肠癌的标准辅助治疗,但本文列举了两个病例,在这两个病例中,基于奥沙利铂的辅助化疗未能清除MRD,这通过血浆ctDNA水平持续呈阳性得以检测出来;
-
改用帕博利珠单抗进行辅助免疫检查点阻断治疗后,两个病例术后的ctDNA水平均大幅下降,且无疾病复发迹象;
-
本研究结果进一步为相关文献提供了依据,引发了人们对常规化疗在已切除的dMMR/MSI-H的III期结肠癌辅助治疗中可能无效的担忧;
-
术后ctDNA监测为评估标准辅助治疗的疗效提供了契机,同时也能及时转向更有效的治疗,特别是对于常规治疗可能无效的分子亚型患者。
研究背景
结直肠癌(CRC)仍是全球第三大常见癌症 ,也是癌症死亡的第二大主要原因。在欧洲和美国,近70%的CRC患者确诊时处于I-III期,此时根治性切除术是标准治疗方案。
手术是局部早期CRC的主要治疗方式,组织病理学分期决定是否需要辅助化疗。最新数据明确表明,辅助化疗对III期(淋巴结阳性)患者有生存获益,而对低风险II期患者则无明显生存获益。
CRC中有一个值得关注的基因亚群,即存在dMMR或MSI-H的患者,这类患者由MLH1、MSH2、MSH6或PMS基因突变所界定,约占非转移性CRC患者的10% - 20%。在辅助治疗方面,一些具有开创性的研究发现,对于已切除的II期结肠癌患者,采用5-氟尿嘧啶(5-FU)化疗并无生存获益,这已成为标准认知。对于已切除的dMMR/MSI-H的III期结肠癌患者,在5-FU辅助治疗方案中加入奥沙利铂则可观察到治疗获益。
ctDNA是一种用于检测局部CRC患者术后MRD的新型工具。血浆ctDNA检测有望在根治性切除术后早期检测到CRC复发,其效果优于传统肿瘤标志物癌胚抗原,并且对无病生存期(DFS)具有高度预后价值,有可能作为预测辅助治疗反应的生物标志物。基于肿瘤知情的超深度下一代测序血浆ctDNA检测方法SignateraTM(Natera公司)已证明能够检测I-III期CRC的复发,平均比影像学检测到复发提前8.7个月。最近,开展了第一项关于ctDNA指导已切除II期结肠癌辅助治疗可行性的前瞻性随机试验,结果表明,与标准管理组相比,ctDNA指导组接受辅助化疗的患者比例更低,且不影响无复发生存期。
本文呈现了一个有趣的病例系列,涉及两名患有MSI-H III期结肠癌的患者。这两名患者均接受了根治性手术,随后进行传统的辅助联合化疗。在这两个病例中,接受标准辅助化疗期间,ctDNA显著升高,促使治疗方案转换为辅助免疫疗法。之后,ctDNA得以清除,且影像学检查未发现疾病迹象。
病例1:
患者为一名54岁的非西班牙裔白人男性,有20年肠易激综合征及胃食管反流病史。接受结肠镜检查时,发现距肛缘50厘米处有一阻塞性肿块病变,导致降结肠严重狭窄。活检显示为中低分化浸润性腺癌,结肠型,伴有KRAS G13D突变,肿瘤突变负荷(TMB)高,为11 muts/Mb,免疫组化检测显示MLH1和PMS2缺失。全面分期检查未发现远处转移病灶。Invitae(加利福尼亚州旧金山市Invitae公司)胚系基因检测(84基因多癌种检测panel)结果为阴性。患者在确诊约6周后接受了腹腔镜下左半结肠切除术。免疫组化检测错配修复状态显示MLH1和PMS2双缺失。病理分期为pT4apN2a,切缘阴性,但组织学分化差,存在淋巴管和神经周围浸润,25个淋巴结中有6个呈阳性。
术后恢复后,患者开始按计划接受为期3个月的辅助卡培他滨(希罗达)和奥沙利铂(XELOX或CAPOX)治疗,同时通过SignateraTM进行ctDNA监测。患者共接受了4个周期的XELOX治疗,由于对奥沙利铂不耐受,治疗降为2个周期的卡培他滨,但在4个周期的XELOX治疗后,术后ctDNA仍持续阳性(图1)。患者的ctDNA水平持续上升,表明存在MRD,且标准辅助化疗无法清除其阳性ctDNA状态。此时,患者转而接受针对其MSI-H状态的帕博利珠单抗治疗。转换为免疫治疗后,在约3个月的免疫治疗期间,ctDNA迅速清除。在帕博利珠单抗治疗的第1周期开始时,他的淋巴细胞总数为1.90×1000个/UL,淋巴细胞与单核细胞比值(LMR)为2.18,中性粒细胞与淋巴细胞比值(NLR)为2。在帕博利珠单抗治疗的第11周期(1年)时,他的淋巴细胞总数为1.67×1000个/UL,LMR为2.42,NLR为2。在撰写本报告时,患者的ctDNA仍为阴性,并完成了1年的免疫治疗,随后的CT影像学监测未发现疾病迹象。帕博利珠单抗耐受性良好,未发生任何免疫相关不良事件(irAEs)。在此期间,癌胚抗原(CEA)一直处于较低水平,因为患者不产生CEA。
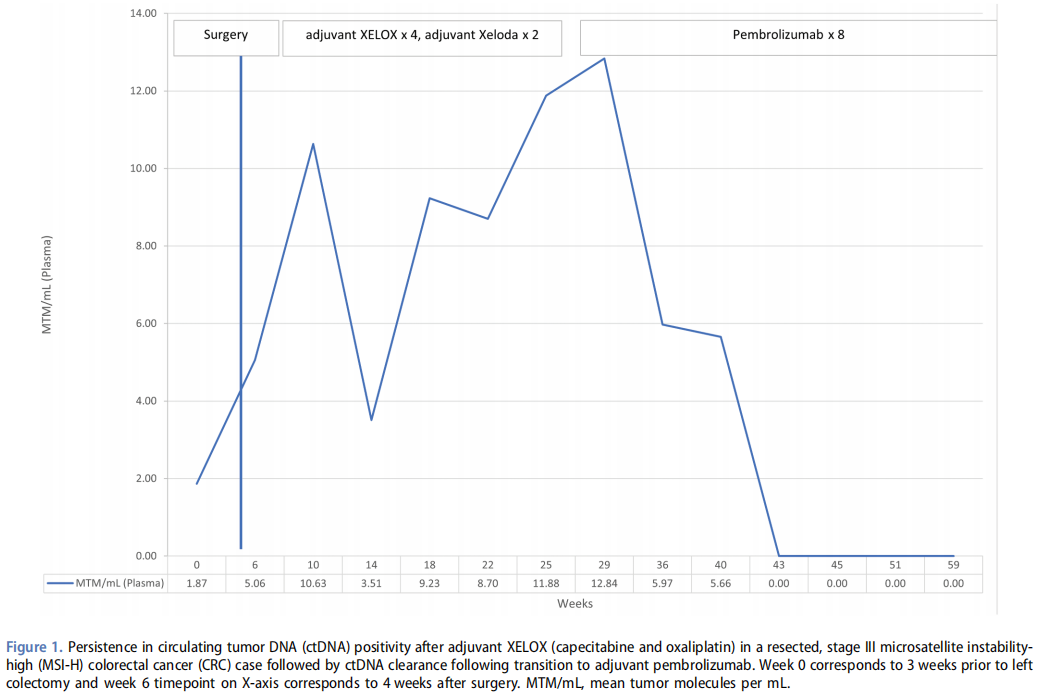
图1
病例2:
该患者为一名43岁的西班牙裔男性,既往有肝脂肪变性和酒精使用障碍病史,因症状性贫血(血红蛋白3.6mg/dL)入院。胸部、腹部及盆腔增强计算机断层扫描(CT)显示升结肠不规则壁增厚,周围脂肪条索影,可见一处5.3×4.2×5.2cm的包裹性含气液性肿物,右侧多发肿大淋巴结。胸部未发现转移性疾病。经食管胃十二指肠镜和结肠镜检查发现升结肠有一梗阻性肿物,最终确诊为浸润性中分化黏液腺癌。患者随后接受了由腹腔镜转为开腹的右半结肠切除术,最终病理显示为IIIC期(pT4bN1a)低分化升结肠癌,且为dMMR/MSI-H。通过Invitae多癌种检测panel进行的胚系检测证实,MLH1基因存在致病性变异c.1459C>T,符合林奇综合征特征。患者开始接受辅助XELOX方案化疗,并通过SignateraTM对ctDNA进行监测。由于该患者处于非转移性阶段且已开始辅助治疗,因此推迟了扩展分子分析或下一代测序。经过3个周期的XELOX化疗后,ctDNA显著上升,基于患者的MSI-H状态,决定转用帕博利珠单抗(图2)。转为免疫治疗后,血浆ctDNA降至几乎检测不到的水平,表明ctDNA得到了大量清除。计划进行纵向ctDNA评估以记录ctDNA的清除情况。在帕博利珠单抗第1周期开始时,他的淋巴细胞总数为1.72×1000个/UL,LMR为3.12,NLR为1.9。在帕博利珠单抗第10周期(6个月)时,他的淋巴细胞总数为2.23×1000个/UL,LMR为4.64,NLR为1.26。在撰写本报告时,患者继续接受帕博利珠单抗治疗,期间的CT成像未发现疾病迹象,且ctDNA水平几乎检测不到。在此病例的辅助治疗过程中,CEA一直处于极低水平,无临床参考价值。值得注意的是,在帕博利珠单抗治疗第6周期时,该患者出现无症状的1级甲状腺炎,甲状腺功能检查显示促甲状腺激素(TSH)为6.33 mIU/L,游离甲状腺素T4为0.65 ng/dL,游离T3为2.7 pg/mL。患者被转至内分泌科,医生对这种免疫相关不良事件(irAE)甲状腺炎采取保守治疗,仅监测甲状腺功能,无需干预,也无需暂停帕博利珠单抗用药。
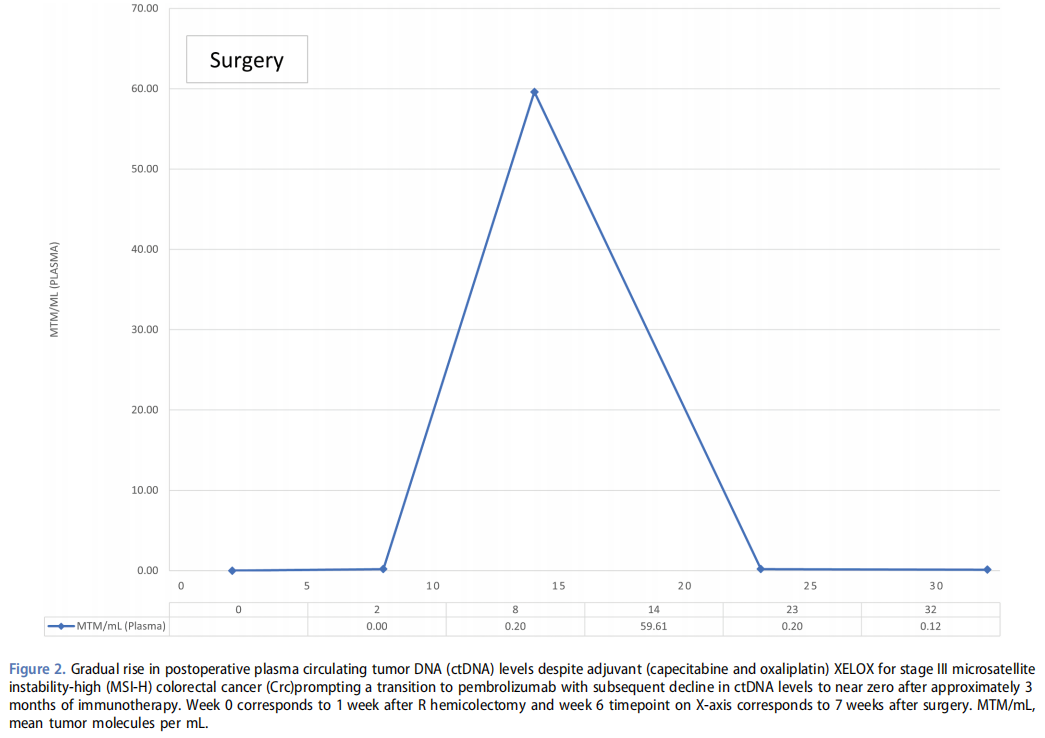
图2
讨 论
免疫检查点抑制剂,包括程序性细胞死亡蛋白1(PD - 1)抑制剂帕博利珠单抗和纳武利尤单抗,无论是否联合细胞毒性T淋巴细胞抗原4(CTLA - 4)抑制剂伊匹木单抗,最初均获美国FDA批准用于治疗难治性转移性结直肠癌(mCRC)且为dMMR/MSI-H的患者。PD - 1抑制剂多塔利单抗(dostarlimab)也获得FDA批准,用于治疗难治性dMMR/MSI-H的mCRC及晚期实体瘤。最近,一项III期、开放标签的随机KEYNOTE - 177试验表明,在未经治疗的dMMR/MSI-H的mCRC患者中,一线使用帕博利珠单抗优于基于5-FU的化疗方案。这项关键的随机对照试验预示着在mCRC治疗中,非化疗一线方案的优越性,而化疗方案作为mCRC全身治疗的主要手段已沿用数十年。与化疗相比,使用帕博利珠单抗不仅使中位无进展生存期翻倍(16.5个月 vs 8.2个月),总缓解率(43.8% vs 33.1%)及完全缓解率(CRs)(11% vs 4%)也有所提高,再次证实了dMMR/MSI-H的mCRC对免疫治疗的高敏感性。
在非转移性CRC领域,新辅助免疫治疗在dMMR/MSI-H亚型的治疗中日益受到关注。最近一项前瞻性II期试验报告称,12例dMMR/MSI-H的II期或III期直肠腺癌患者接受新辅助单药多塔利单抗(抗PD-1药物)治疗后,疗效可观。令人瞩目的是,仅经过6个月(9个周期)的免疫治疗,临床完全缓解率就达到了100%。在中位随访12个月期间,没有患者接受放化疗,且所有患者都避免了手术切除。NICHE和NICHE - 2研究显示,新辅助免疫治疗在dMMR/MSI-H的局部晚期结肠癌治疗中也取得了成功。在II期单臂NICHE - 2试验中,入组研究后仅给予2剂新辅助纳武利尤单抗和伊匹木单抗,随后在6周内进行手术,98%的受试者出现了主要病理缓解(定义为残余存活肿瘤≤10%),68%的受试者出现了病理完全缓解(残余存活肿瘤为0%)。在NICHE - 2试验中入组并接受手术的113例受试者中,中位随访26个月时,无患者出现疾病复发。
鉴于新辅助免疫疗法在dMMR/MSI-H的局部晚期结直肠癌中展现出有前景且持久的缓解率,国家指南现已将新辅助免疫疗法纳入dMMR/MSI-H的局部晚期直肠癌(T3 - T4、T1 - 2N1 - 2,或局部不可切除/医学上不宜手术)以及dMMR/MSI-H的局部晚期结肠癌(T4b、局部不可切除,或医学上不宜手术)的首选治疗方案。这代表了共识指南中的关键转变,特别是在局部晚期直肠癌的治疗方面,如今对于dMMR/MSI-H的局限性疾病,采取器官保留或避免手术切除已成为一种可行的治疗途径。
回顾性及前瞻性(III期)研究的数据均表明,存在一部分数量可观的dMMR/MSI-H局部晚期结直肠癌患者,对新辅助放化疗及以奥沙利铂为基础的新辅助化疗无反应。例如,在FOXTROT试验中,在接受新辅助FOLFOX治疗的dMMR/MSI-H局部晚期结肠癌患者中,高达70%的患者未实现肿瘤退缩,而在接受新辅助FOLFOX治疗的错配修复功能正常(pMMR)或微卫星稳定(MSS)局部晚期结肠癌患者中,仅有27%的患者未实现肿瘤退缩。在dMMR/MSI-H局部晚期直肠癌患者中,在接受根治性治疗的情况下,多达16.6%接受新辅助放化疗的患者发生了疾病进展,而在接受新辅助放化疗的pMMR/MSS局部晚期直肠癌患者中,无疾病进展。在这一系列研究中,dMMR/MSI-H疾病患者对新辅助化疗的总体缓解率为25% - 33.4%,而pMMR/MSS局部晚期直肠癌患者的总体缓解率为85.6% - 87.2%。人们越来越认识到,dMMR/MSI-H局部晚期结直肠癌患者从新辅助化疗中获益减少,这与一些重要报告一致,即dMMR/MSI-H的II期结肠癌患者在手术切除后,接受辅助5 - FU化疗并无获益。
本文所呈现的两个病例,进一步突显了人们日益担忧的一个问题:对于dMMR/MSI-H的局限性结肠癌,传统的细胞毒性化疗可能无法实现理想的疾病控制。利用血浆ctDNA监测MRD状态,为评估以奥沙利铂为基础的辅助化疗,在清除这两例已切除的dMMR/MSI-H III期结肠癌微小病灶方面的疗效,提供了一个契机。在以奥沙利铂为基础的辅助化疗期间,血浆ctDNA水平逐渐升高,持续的ctDNA阳性的清晰图像指导我们将治疗方案转变为辅助免疫治疗,其依据是越来越多的证据表明,在局部和转移性肿瘤中,dMMR/MSI-H CRC对免疫治疗有明显反应。基于一系列数据表明,术后ctDNA持续可检测到的患者,在随访两年内疾病复发率几乎高达95 - 100%,医护人员与患者就获益、风险及其他替代方案进行了讨论,支持了向辅助免疫治疗的转变。
本病例报告引起了人们对以下几方面的关注:对于接受治愈性治疗的dMMR/MSI-H型已切除结肠癌患者,辅助治疗中使用传统化疗可能获益有限;在特定病例中,ctDNA对指导辅助治疗决策的作用;以及在dMMR/MSI-H型已切除结直肠癌中,辅助免疫治疗作用的相关证据仍有待充实。这在日常临床实践中至关重要,因为共识指南倾向于对dMMR/MSI-H型已切除的III期结肠癌患者,采用基于奥沙利铂的辅助化疗,疗程为3 - 6个月。目前正在进行的III期ATOMIC试验备受期待,该试验将dMMR/MSI-H型已切除的III期结肠癌患者随机分为两组,分别接受6个月的FOLFOX方案化疗,或FOLFOX联合阿替利珠单抗治疗,有望证实辅助免疫治疗在该领域的益处(NCT02912559)。
随着针对ctDNA及其在I-III期CRC术后MRD监测和潜在治疗决策改变方面应用的研究不断深入,我们需要更深入地了解改变治疗决策的时机和阈值。正在进行的CIRCULATE - US II / III期试验,旨在评估在已切除的III期结肠癌中,基于MRD指导的辅助治疗强化或弱化策略。该试验要求在术后不超过8周内进行首次Signatera ctDNA检测,并在术后12周内启动辅助治疗。我们通常建议在术后2 - 4周内进行首次术后ctDNA检测。后续检测的频率并不固定,尚无既定的标准指南。然而,正在进行的BESPOKE IO观察性队列研究,旨在评估实体瘤患者接受免疫治疗时,基于定制化ctDNA检测结果做出的治疗调整。该研究将在长达2年的时间里,每2个免疫治疗周期检测一次ctDNA水平。希望这项研究能够揭示临床医生基于连续ctDNA监测改变全身治疗决策的阈值。值得注意的是,在CIRCULATE - US试验中,任何水平的ctDNA阳性都将被视为基于MRD指导辅助化疗的阳性结果。
此外,以检查点阻断形式进行的免疫治疗可能会引发免疫相关不良事件(irAEs),在辅助治疗的情境下,需要权衡其风险与收益。据记载,接受免疫检查点抑制剂治疗的患者中,高达38%会出现irAEs,而且不同类型的irAEs潜伏期不同。例如,皮肤和胃肠道(如结肠炎)相关的irAEs最早可在2 - 6周发病,而内分泌和风湿性irAEs的中位发病时间分别为14.5周和38周。一般来说,1级irAEs通过密切监测就可以控制;2级irAEs通常需要暂停免疫治疗,待严重程度降至1级或以下时再恢复;3级irAEs一般需要停止免疫治疗并使用高剂量的皮质类固醇。有趣的是,最近的回顾性系列研究表明,与其他类型的irAEs(如呼吸系统相关的)相比,特定类型的irAEs(如皮肤和内分泌相关的)的发生与免疫治疗后生存率的提高有关。本文的第二个病例出现了1级甲状腺炎这一irAEs,但患者在使用帕博利珠单抗进行辅助治疗时持续获益。
本研究的病例报告提供了越来越多的证据,表明辅助细胞毒性化疗可能不足以治疗dMMR/MSI-H的局限性结肠癌,使用免疫疗法可能是一种有效的治疗选择。这两个病例也显示了血浆ctDNA在MRD监测中的实际效用,以及它在辅助结肠癌患者群体中指导治疗决策的能力。与传统诊断方式相比,血浆ctDNA的使用可以在接受治疗时更早地识别复发和进展,从而允许过渡到更有益的治疗,特别是在传统治疗可能无效的分子亚型中。
参考文献:
Burley N, Lee Y, Liu L, et al. ctDNA-guided adjuvant immunotherapy in colorectal cancer. Immunotherapy. Published online November 17, 2024. doi:10.1080/1750743X.2024.2430941

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#结直肠癌# #ctDNA-MRD#
27