论文解读| Jiajian Zhou教授团队揭示幽门螺杆菌感染导致胃癌微环境改变促进肿瘤发生
昨天 Genes and Diseases Genes and Diseases 发表于陕西省
本研究利用单细胞RNA测序(scRNA-seq)技术,深入分析了H. pylori感染与IM中肿瘤发生相关的细胞环境变化。
幽门螺杆菌(H. pylori)感染是胃癌发生的关键风险因素,尤其在肠型胃癌的发展中,其作用不容小觑。肠上皮化生(Intestinal metaplasia,IM)作为胃癌发展的重要环节,常由H. pylori感染触发。然而,H. pylori如何促进IM患者肿瘤发生的机制尚未完全阐明。
南方医科大学的Jiajian Zhou教授团队在本刊发表了题为“Helicobacter pylori mediated niche environment aberrations promote the progression of gastric cancer”的研究快讯,利用单细胞RNA测序(scRNA-seq)技术,深入分析了H. pylori感染与IM中肿瘤发生相关的细胞环境变化。
1. 研究方法
研究团队利用scRNA-seq技术,分析了H. pylori感染与未感染IM患者的数据,揭示了炎症异常、上皮细胞异常和细胞间接触异常等现象,并将这些变化与肿瘤发生相关的环境改变联系起来。研究团队还构建了细胞间相互作用网络和基因调控网络,以识别驱动胃癌细胞间相互作用网络异常的关键调控因子。
2. 研究结果
研究发现, H. pylori感染组中,壁细胞(PMC)的比例降低,而腺体黏液细胞(GMC)和巨噬细胞的数量增加(图1B)。巨噬细胞分泌的细胞因子促进了胃癌的炎症和细胞生长、侵袭和转移行为,并与肠型胃癌的预后密切相关。此外,巨噬细胞中 IL-1B、PTGS2和 IL-8 等基因的表达增加,表明炎症反应增强(图1C)。同时,PMC和GMC中 JUN、LMNA、TFF1、HSPA1A、HSPA1B和CDKN1A的表达下调(图1E)。H. pylori感染组中,巨噬细胞迁移抑制因子(MIF)/CD74_CD44/CD74_CXCR4信号通路介导的细胞间相互作用显著增强,表明微环境中主要的细胞间通讯发生了异常(图1F)。在基因调控网络中,FOXO1介导的调控子在PMC中特异表达,且在H. pylori感染组中,PMC的FOXO1介导的调控子活性受到抑制(图1G、H)。
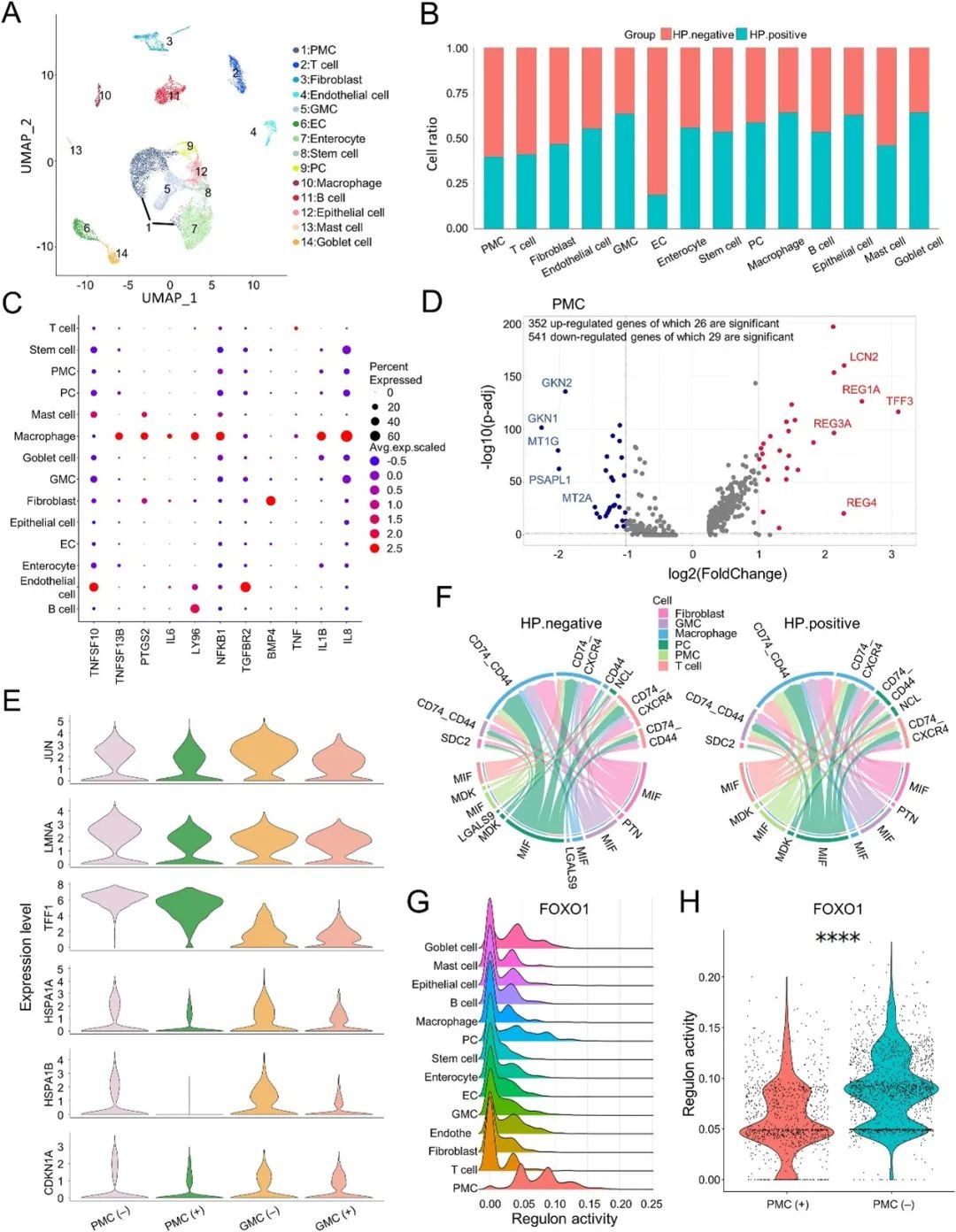
图1 幽门螺杆菌(H. pylori)介导的微环境异常促进胃癌进展
3. 研究结论
H. pylori感染导致肠化生中免疫反应的加剧和微环境的动态变化。H. pylori优先附着在PMC上,进而引发GKN1/2分泌丢失和前恶性炎症。此外,H. pylori诱导的胃炎、肠化生和胃癌中,巨噬细胞迁移抑制因子表达逐渐升高,它与CD74/CD44或CD74/CXCR4结合,激活巨噬细胞产生促炎细胞因子,从而促进肿瘤的发生和发展。
文章来源
免费全文下载链接:
https://www.sciencedirect.com/science/article/pii/S2352304224000047
引用这篇文章:
Yan T, Sun H, Liao Y, Zhou J. Helicobacter pylori mediated niche environment aberrations promote the progression of gastric cancer. Genes Dis. 2024;11(5):101207.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#胃癌# #幽门螺杆菌#
5