J Pathol Clin Res:我国学者揭示胃癌免疫微环境评分预测新辅助化疗疗效及预后
2025-01-01 xuyihan MedSci原创 发表于陕西省
研究人员建立的晚期胃癌的免疫微环境评分模型是预测新辅助化疗疗效和预后的一种非常有效的工具,能够识别可能从这种治疗中受益的胃癌患者。
胃癌(GC)是世界上第五大最常见的恶性肿瘤和第三大最常见的死亡原因。由于缺乏典型的早期症状,大多数胃癌患者在晚期被诊断出来。尽管在手术和化疗方面取得了进展,但晚期胃癌患者的预后仍然很差。新辅助化疗是局部晚期胃癌的标准治疗方法,可提高患者的生存率。然而,在不同的临床中心,NACT的疗效约为50-60%,不同患者的疗效差异很大。因此,在新辅助化疗临床实践中,准确选择从新辅助化疗获益的患者是一个关键问题。目前,NACT的疗效已根据实体肿瘤疗效评价标准(RECIST)指南进行评价。由于判断治疗反应的CT/MRI图像只能在新辅助化疗后才能获得,因此可能会错过手术切除的最佳时机。因此,这项研究建立了一个基于浸润免疫细胞的模型来预测新辅助化疗的疗效。并探讨了新辅助化疗与免疫微环境之间的相关性,以支持随后的免疫治疗选择。

这项研究收集了晚期胃癌患者的配对肿瘤组织(新辅助化疗前和新辅助化疗后)。使用免疫组织化学染色评估TIICs,并使用逻辑回归分析,建立晚期胃癌的免疫微环境评分(ISGC评分)并预测新辅助化疗疗效。Kaplan-Meier曲线用于评价患者的生存结局。
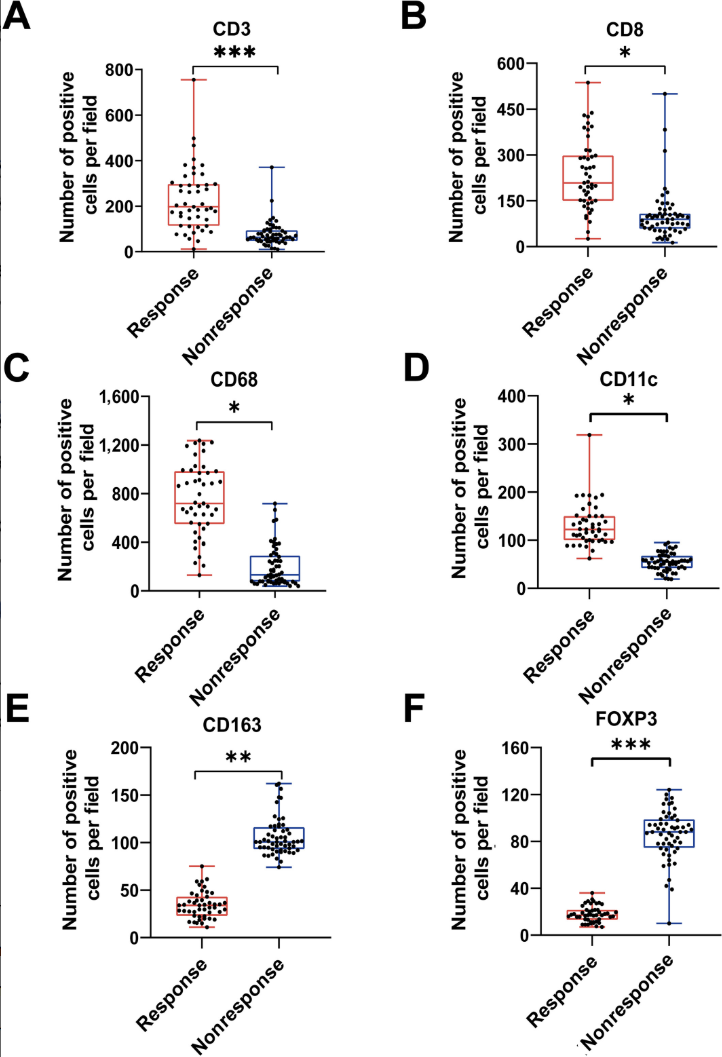
结果显示,在新辅助化疗有反应和无反应的患者中,时间具有显著的异质性。在验证队列中,ISGC评分对新辅助化疗治疗反应表现出良好的预测性能。此外,高ISGC表明晚期胃癌患者有更好的长期生存。此外,反应组肿瘤浸润T细胞(CD3+和CD8+)和CD11c+巨噬细胞显著增加,而新辅助化疗后CD163+巨噬细胞和FOXP3+ Treg细胞减少。然而,在无反应组显示相反的结果。最后,我们发现程序性细胞死亡配体1(PD-L1)阳性肿瘤的比例在NACT前为31%(32/104),在新辅助化疗后为49%(51/104),几乎所有PD-L1升高的患者都在新辅助化疗反应组。
这项研究的结果表明,研究人员建立的晚期胃癌的免疫微环境评分模型是预测新辅助化疗疗效和预后的一种非常有效的工具,能够识别可能从这种治疗中受益的胃癌患者。值得注意的是,基于晚期胃癌的免疫微环境评分和PD-L1的表达,研究人员发现晚期胃癌的免疫微环境评分高且PD-L1阴性的患者更有可能从术后联合免疫治疗中获益。因此,晚期胃癌的免疫微环境评分可能有助于个体化辅助治疗和随访。
原文出处:
Zhao S, Liu Y, Ding L, Zhang C, Ye J, Sun K, Song W, Cai S, He Y, Peng J, Xu J. Gastric cancer immune microenvironment score predicts neoadjuvant chemotherapy efficacy and prognosis. J Pathol Clin Res. 2024 May;10(3):e12378. doi: 10.1002/2056-4538.12378. PMID: 38778559; PMCID: PMC11112142.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#胃癌# #新辅助化疗# #免疫微环境#
29