中山大学黄佳国课题组ACS Nano:肿瘤追踪与酶激活型近红外荧光纳米探针用于时空可视化胃癌淋巴转移
3小时前 BioMed科技 BioMed科技 发表于陕西省
中山大学黄佳国教授团队与广东省第二人民医院韩方海教授团队共同开发了具有高特异性和灵敏度的酶激活型近红外荧光纳米探针用于绘制GC转移淋巴结时空图的实时示踪,辅助外科精准治疗。
胃癌(Gastric Cancer,GC)是全球发病率第二高的消化道恶性肿瘤,同时也是第四大癌症死亡原因。早期GC即可发生潜在淋巴结转移,约70%的GC患者就诊时被诊断为晚期并伴有淋巴结转移。GC转移淋巴结的高特异性和灵敏度的鉴别与示踪在GC外科治疗中具有重要意义。
研究表明,荧光成像技术以其高灵敏度、实时性和无创性,能够对活体内的动态生理病理过程进行精确成像,改变了传统恶性肿瘤的诊断和治疗方法。目前在临床实践中广泛使用的吲哚菁绿,和已报道的其他“常亮型”荧光探针(如聚合物包裹的纳米探针、金纳米簇、IRDye800CW偶联化疗药物等)均存在非特异性成像等问题,导致背景信噪比较低,无法有效区分大/微转移、和良/恶性淋巴结。相比之下,肿瘤相关生物标志物(如过度表达的肿瘤相关酶、肿瘤微环境标志物等)特异性激活型探针可提高精确切除转移灶的灵敏度。以往的研究主要集中于诊断前哨淋巴结转移的频率。而肿瘤细胞在淋巴系统内扩散的时间动态(时间依赖方式)和转移淋巴结的解剖位置(空间依赖方式)却很少被探讨。鉴于此,中山大学黄佳国教授团队与广东省第二人民医院韩方海教授团队共同开发了具有高特异性和灵敏度的酶激活型近红外荧光纳米探针用于绘制GC转移淋巴结时空图的实时示踪,辅助外科精准治疗。
团队开发了RGD靶向/β-半乳糖苷酶激活的荧光纳米探针(MLRs),旨在用于GC转移淋巴结转移程度的实时鉴别与术中示踪。MLRs是一种自组装纳米颗粒,包含不同比率的荧光信号基团及肿瘤识别基团。在健康组织中,MLRs无荧光。当MLRs进入转移淋巴结后,会被肿瘤特异性β-半乳糖苷酶识别并激活荧光,从而实现肿瘤与转移淋巴结的实时成像与示踪。在本研究中,我们首先筛选了最佳比率的探针MLR1,并验证了该探针一方面不仅可用于对大/微小转移淋巴结与良性淋巴结进行鉴别;另一方面,MLR1能以空间依赖的方式对GC早期的跳跃转移淋巴结进行成像示踪,其灵敏度与流式细胞术相当,可绘制小鼠胃癌中转移瘤淋巴结的时空分布图。更重要的是,在临床手术切除的GC患者标本中,MLR1可在1小时内即区分肿瘤组织以及转移淋巴结组织,体现了其在临床上指导GC外科精准治疗的巨大潜力。
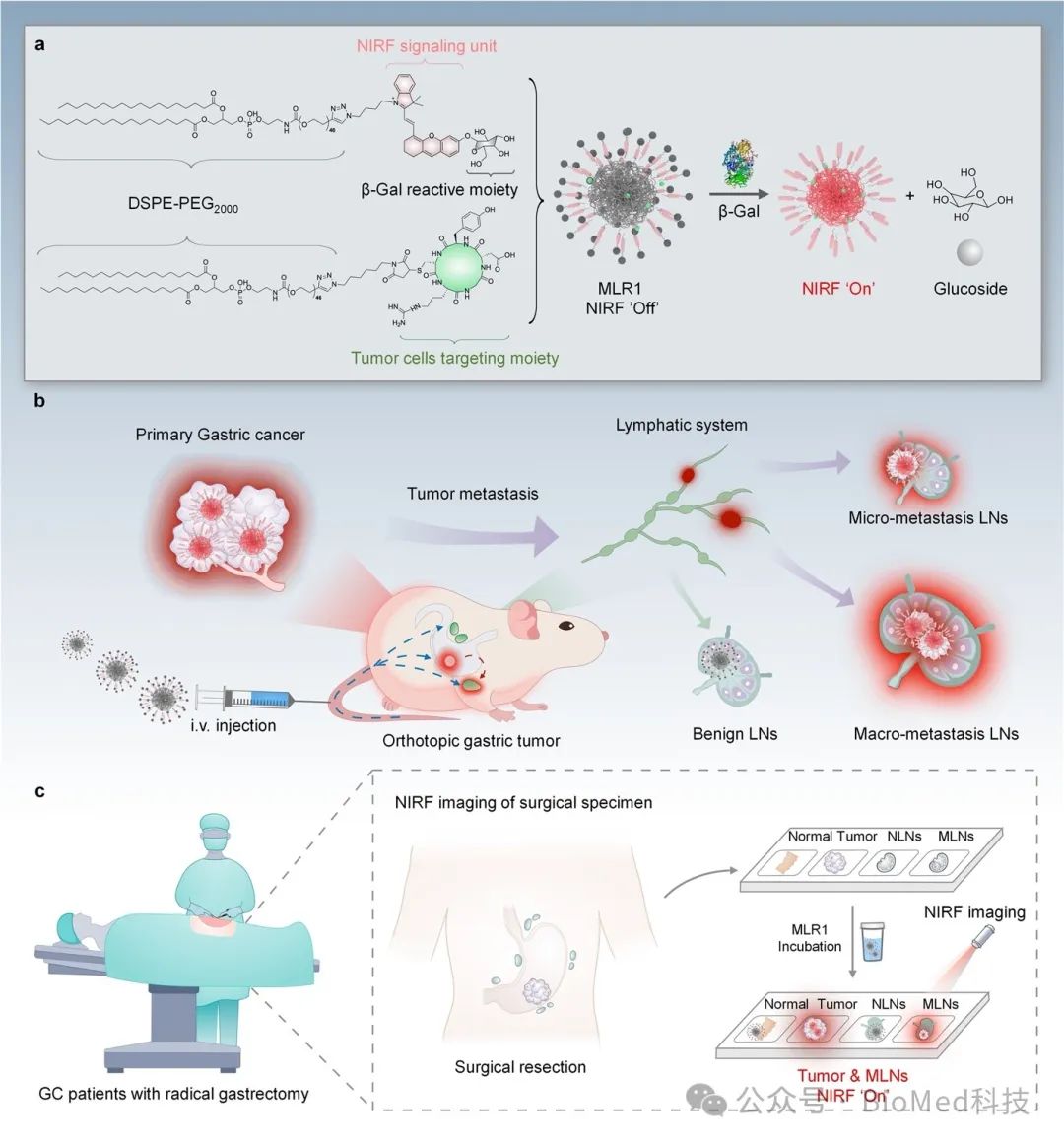
综上所述,本工作报道了近红外荧光纳米探针可在临床前模型和患者标本中对GC转移淋巴结进行早期实时鉴别示踪。该研究成果以“Spatiotemporal Mapping of Lymphatic Metastases in Gastric Cancer Using Tumor-trackable and Enzyme-activatable Near-infrared Fluorescent Nanoprobes”为题在线发表在ACS nano上。广东省第二人民医院的博士后于梦雅和中山大学药学院的博士研究生祝丽娟为本论文的共同第一作者,黄佳国教授、韩方海教授和博士后徐伟平为该文章共同通讯作者。本研究受到广州市重点研发计划和国家自然科学基金等项目资助。
原文链接:
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#胃癌# #近红外荧光纳米探针#
2