GUT:骆卉妍、徐瑞华、李元方、刘泽先等揭示胃癌腹膜转移免疫治疗耐药机制
2024-11-19 iNature iNature 发表于陕西省
该研究首次建立了单细胞分辨率的胃癌腹膜转移肿瘤微环境图谱,揭示了胃癌腹膜转移免疫检查点阻断剂耐药机制,并提出了新的潜在干预策略。
胃癌是威胁我国国民健康的重大疾病,晚期患者预后不佳。胃癌腹膜转移是其最常见的转移方式,且胃癌腹膜转移患者预后较差,对放化疗等传统治疗方式耐药。来自两项III期随机试验的最新证据为胃癌腹膜转移患者带来了新的曙光,其结果表明无论是否存在腹膜转移,胃癌患者均可从免疫检测点抑制剂治疗中显著获益,提示新型的ICB治疗为胃癌腹膜转移带来了全新的机遇。但是仍然有部分患者对ICB治疗无效,因此,甄别ICB治疗的真正获益人群,阐明ICB治疗耐药的机制并开发提高ICB治疗疗效的新方法,具有重要意义,也是目前临床上面临的主要挑战之一。
2024年11月13日,中山大学肿瘤防治中心内科骆卉妍、徐瑞华教授及胃外科李元方教授团队《消化道》(GUT)杂志在线发表了题为“CAF‒macrophage crosstalk in tumor microenvironments governs the response to immune checkpoint blockade in gastric cancer peritoneal metastases”的研究论文。该研究首次建立了单细胞分辨率的胃癌腹膜转移肿瘤微环境图谱,揭示了胃癌腹膜转移免疫检查点阻断剂(Immune checkpoint inhibitors,ICB)耐药机制,并提出了新的潜在干预策略。这对增敏肿瘤免疫治疗,尤其是在胃癌腹膜转移中的免疫治疗,具有重要的临床意义。

为了克服这一临床难题,在徐瑞华教授主导下,骆卉妍教授联合胃外科李元方主任、实验研究部刘泽先研究员等领域专家,组建了涵盖肿瘤内科、外科、生物信息、基础研究的多学科联合攻关团队,开展了一项评估免疫治疗联合化疗治疗在胃癌腹膜转移患者中的疗效和安全性的II期临床研究,并从纳入临床研究的患者中收集了21例高质量胃癌腹膜转移样本进行了单细胞转录组测序。研究团队以此为基础建立了一个包含5种组织类型的>41万细胞的单细胞图谱,以全面表征肿瘤微环境和胃癌腹膜转移的瘤内异质性,并系统地解析与免疫治疗疗效相关的细胞亚群和分子机制。这是第一个在单细胞分辨率下探索胃癌腹膜转移对ICB反应性的分子机制研究。
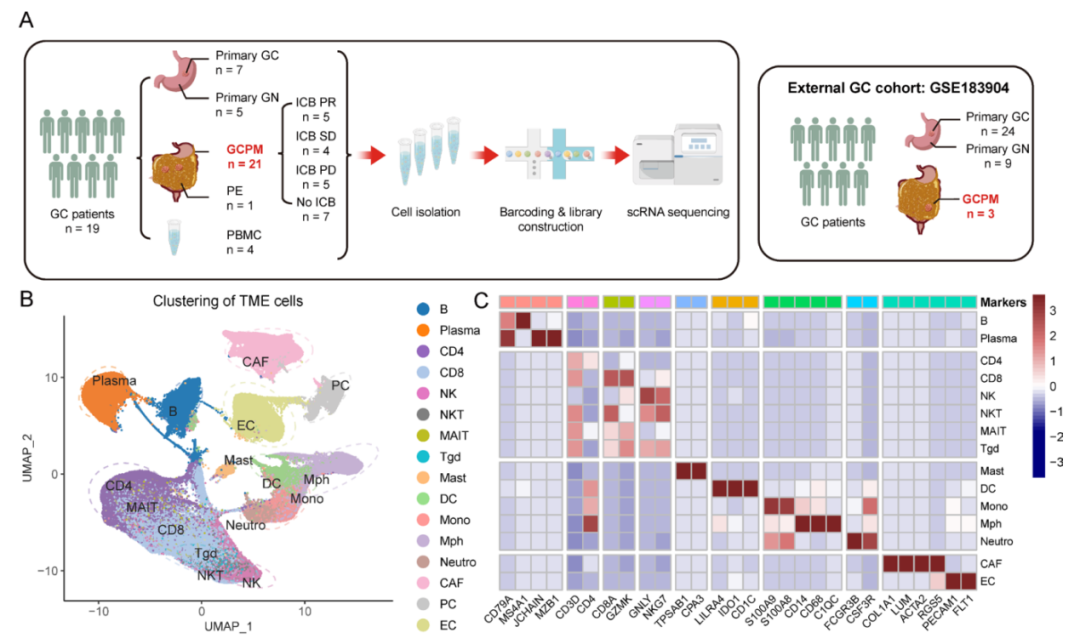
研究设计
该研究发现胃癌腹膜转移灶具有独特的免疫微环境,表现为血管内皮细胞、肿瘤相关成纤维细胞(CAF)等基质成分以及肿瘤相关巨噬细胞(TAM)显著浸润。提示胃癌腹膜转移灶具有不同于原发性胃癌的独特免疫抑制模式。该模式主要由腹膜组织驻留来源的SPP1+ TAMs和THBS2+ mCAFs组成的CAF-巨噬细胞生态位主导。
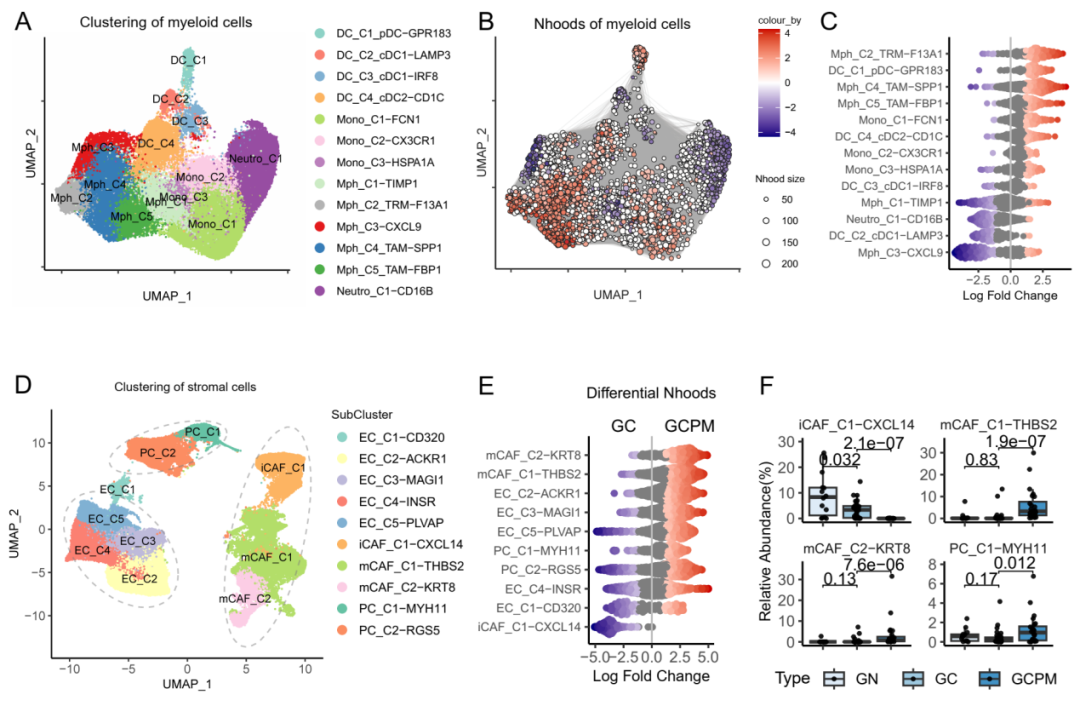
研究结果
这种CAF-巨噬细胞生态位是GCPM中免疫治疗耐药的媒介。进一步的机制研究表明,胃癌腹膜转移中显著富集的THBS2+ mCAFs可通过补体C3-C3AR1轴促进腹膜组织驻留来源的SPP1+ TAMs形成和累积,从而形成促癌和免疫抑制的CAF-巨噬细胞生态位。最后,研究团队构建了小鼠体内瘤模型,证实C3-C3AR1轴阻断可破坏CAF-巨噬细胞相互作用,从而显著改善免疫治疗疗效。
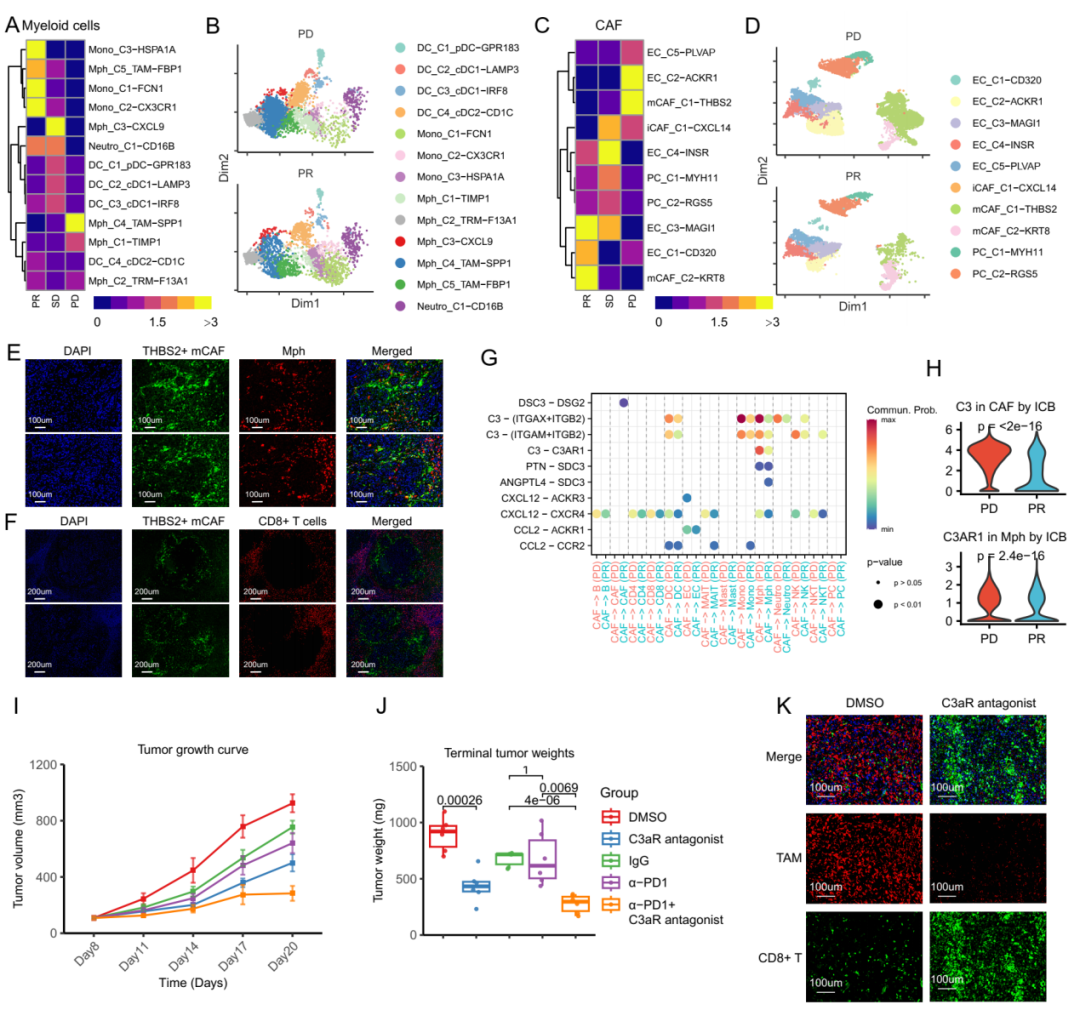
研究结果
综上所述,本研究构建的包含41万个单细胞的单细胞转录组图谱,为胃癌腹膜转移显著改变的免疫微环境提供了一个系统的视角。研究揭示了由SPP1+ TAMs和THBS2+ mCAFs组成的CAF-巨噬细胞生态位是胃癌腹膜转移ICB耐药的主因。此外,我们观察到THBS2+ mCAF成分在胃癌腹膜转移灶中异常聚集,这些成分可通过补体C3-C3AR1轴促进了腹膜组织驻留来源的SPP1+ TAMs的聚集,形成了一个促癌和免疫抑制的基质-髓系细胞相互作用。阻断C3-C3AR1轴可破坏基质-髓系细胞的相互作用,从而显著改善ICB的益处。此研究从肿瘤微环境角度为胃癌腹膜转移免疫治疗耐药机制提供了新的见解,并为开发ICB增敏药物的开发提供了新的实用靶点。
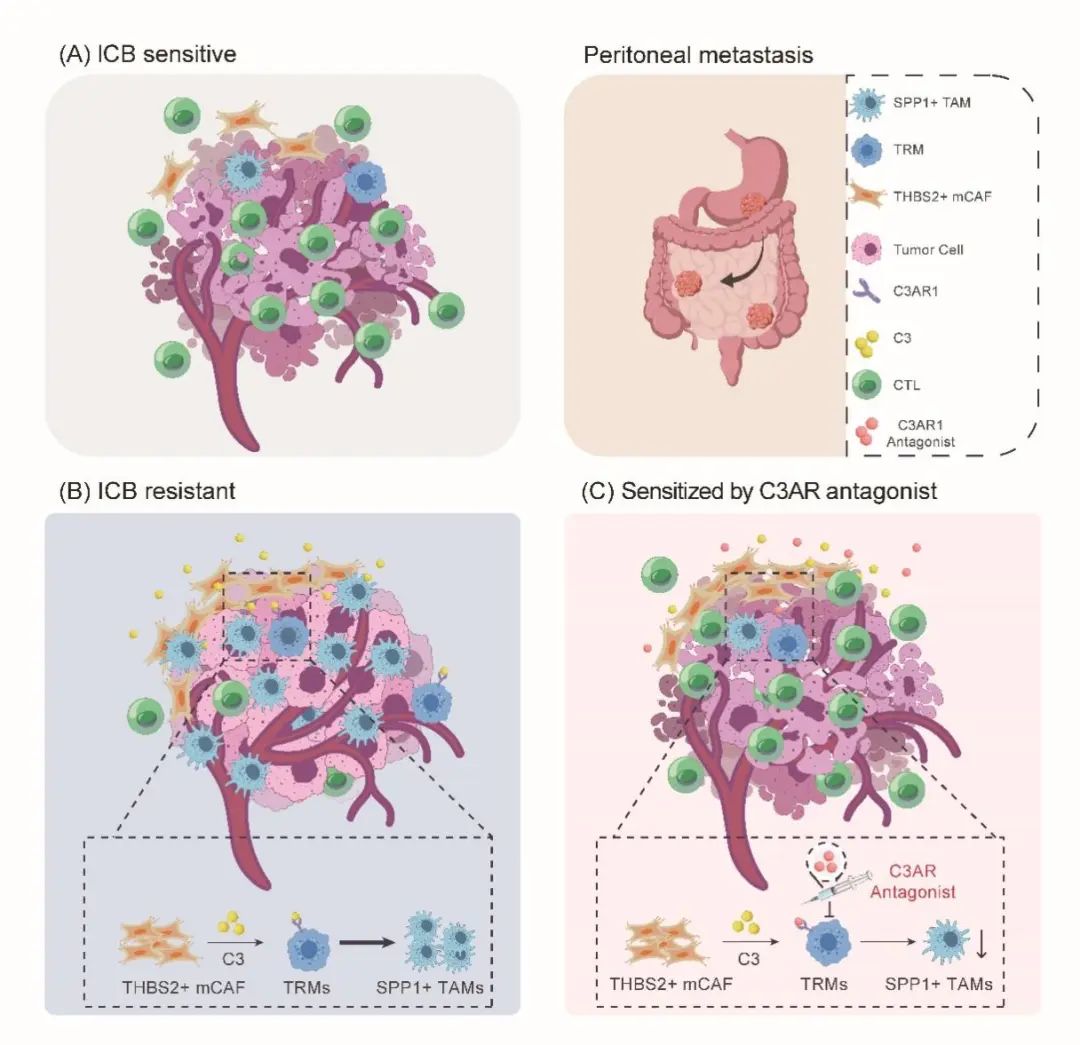
研究模式图
作者介绍
中山大学肿瘤防治中心内科骆卉妍教授、徐瑞华教授、刘泽先教授为论文的共同通讯作者。胃外科李元方教授、第二届“志光计划”入选者郑永强博士、研究生黄佳倩、胃外科聂润聪教授、病理科吴其年教授以及博士生左志军为该论文的共同第一作者。该项目获得了国家“免疫力数字解码”重大计划培育项目的资助。
原文链接:
https://gut.bmj.com/content/early/2024/11/12/gutjnl-2024-333617
参考文献:
1. Li Y, Zheng Y, Huang J, et al: CAF-macrophage crosstalk in tumour microenvironments governs the response to immune checkpoint blockade in gastric cancer peritoneal metastases. Gut Published Online First: 12 November 2024. doi: 10.1136/gutjnl-2024-333617
2. Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin 2021;71:209-49.
3. Janjigian YY, Shitara K, Moehler M, Garrido M, Salman P, Shen L, et al. First-line nivolumab plus chemotherapy versus chemotherapy alone for advanced gastric, gastro-oesophageal junction, and oesophageal adenocarcinoma (CheckMate 649): a randomised, open-label, phase 3 trial. Lancet 2021;398:27-40.
4. Qiu MZ, Oh DY, Kato K, Arkenau T, Tabernero J, Correa MC, et al. Tislelizumab plus chemotherapy versus placebo plus chemotherapy as first line treatment for advanced gastric or gastro-oesophageal junction adenocarcinoma: RATIONALE-305 randomised, double blind, phase 3 trial. BMJ 2024;385:e078876.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#胃癌# #腹膜转移#
59