GUT:骆卉妍、徐瑞华、及李元方团队揭示胃癌腹膜转移免疫治疗耐药机制
2024-11-22 网络 网络 发表于香港
近日,中山大学肿瘤防治中心内科骆卉妍、徐瑞华教授及胃外科李元方教授团队在《消化道》(GUT)杂志,在线发表了题为“肿瘤微环境中的CAF——巨噬细胞交互作用介导胃癌腹
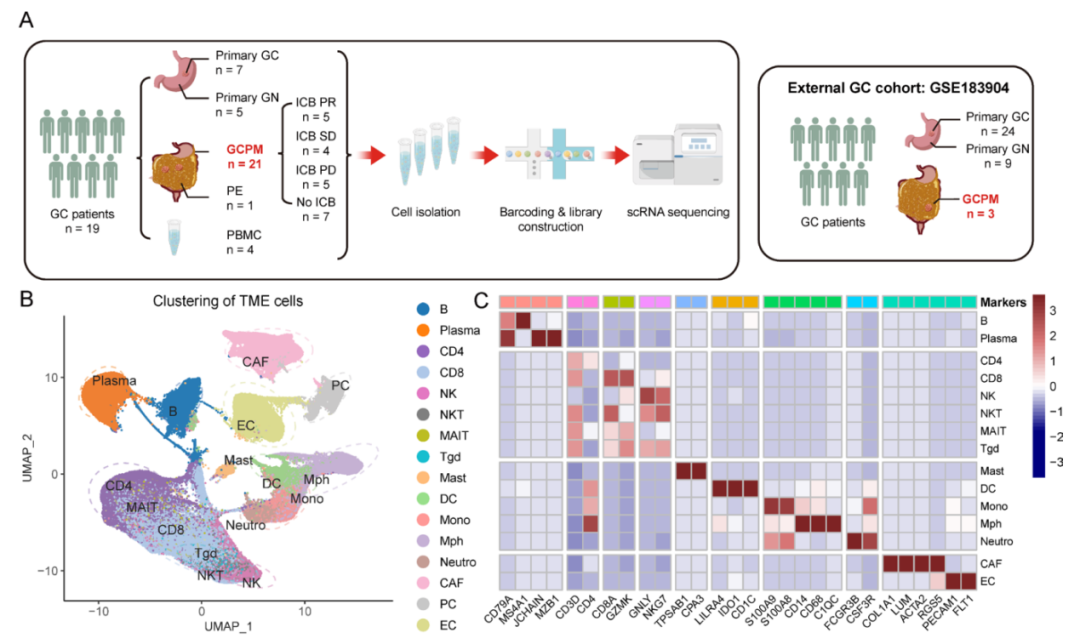
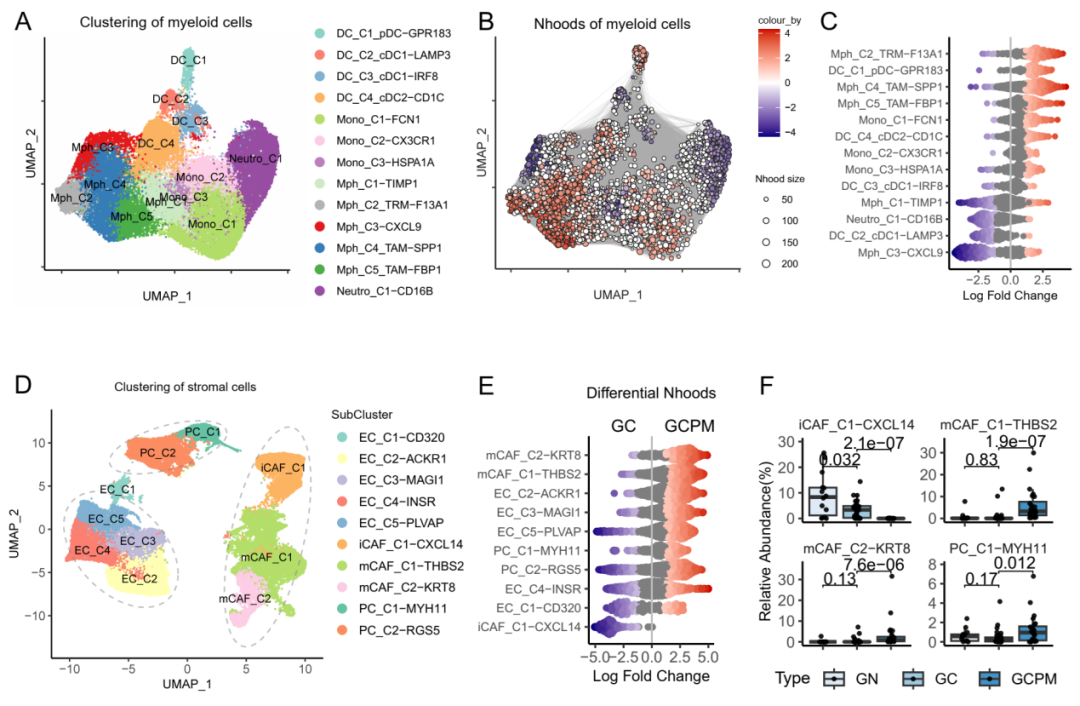
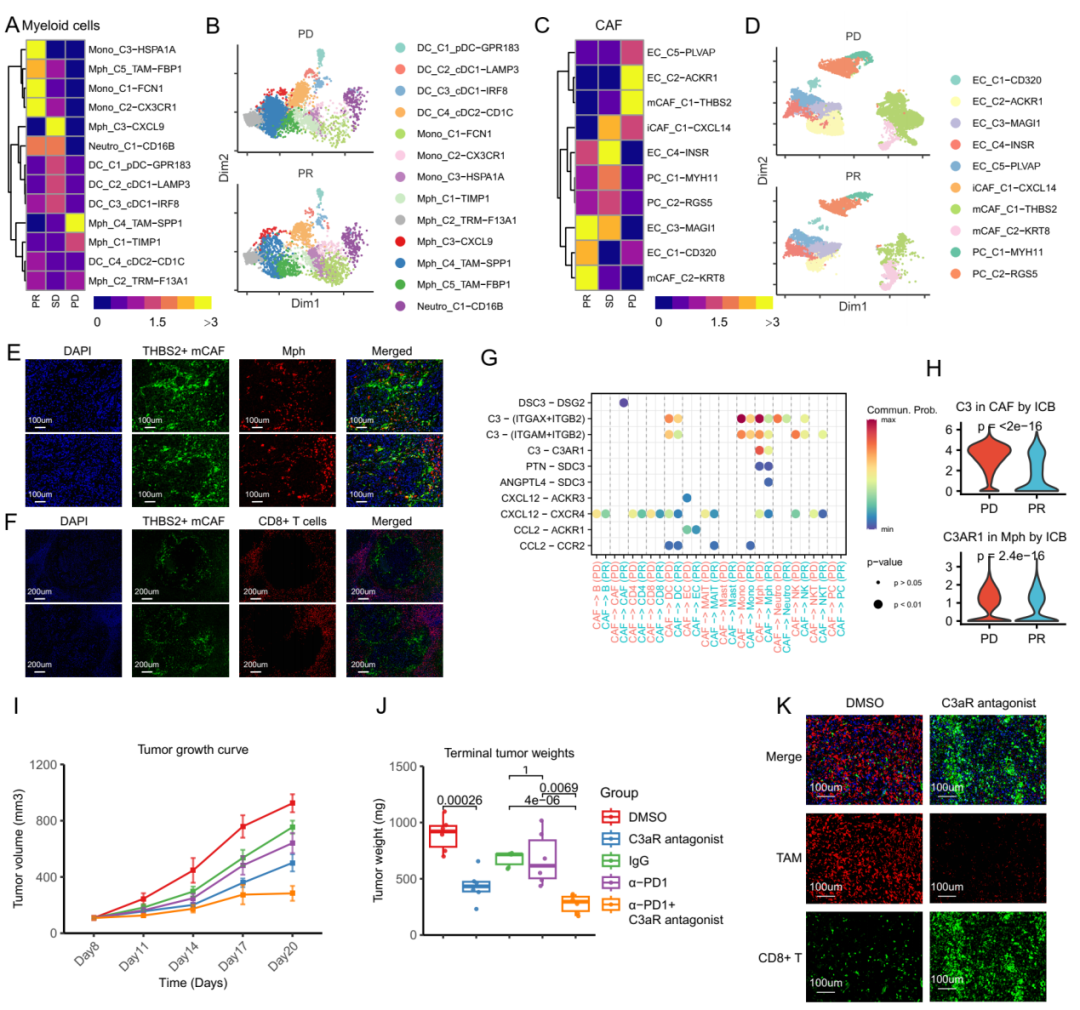
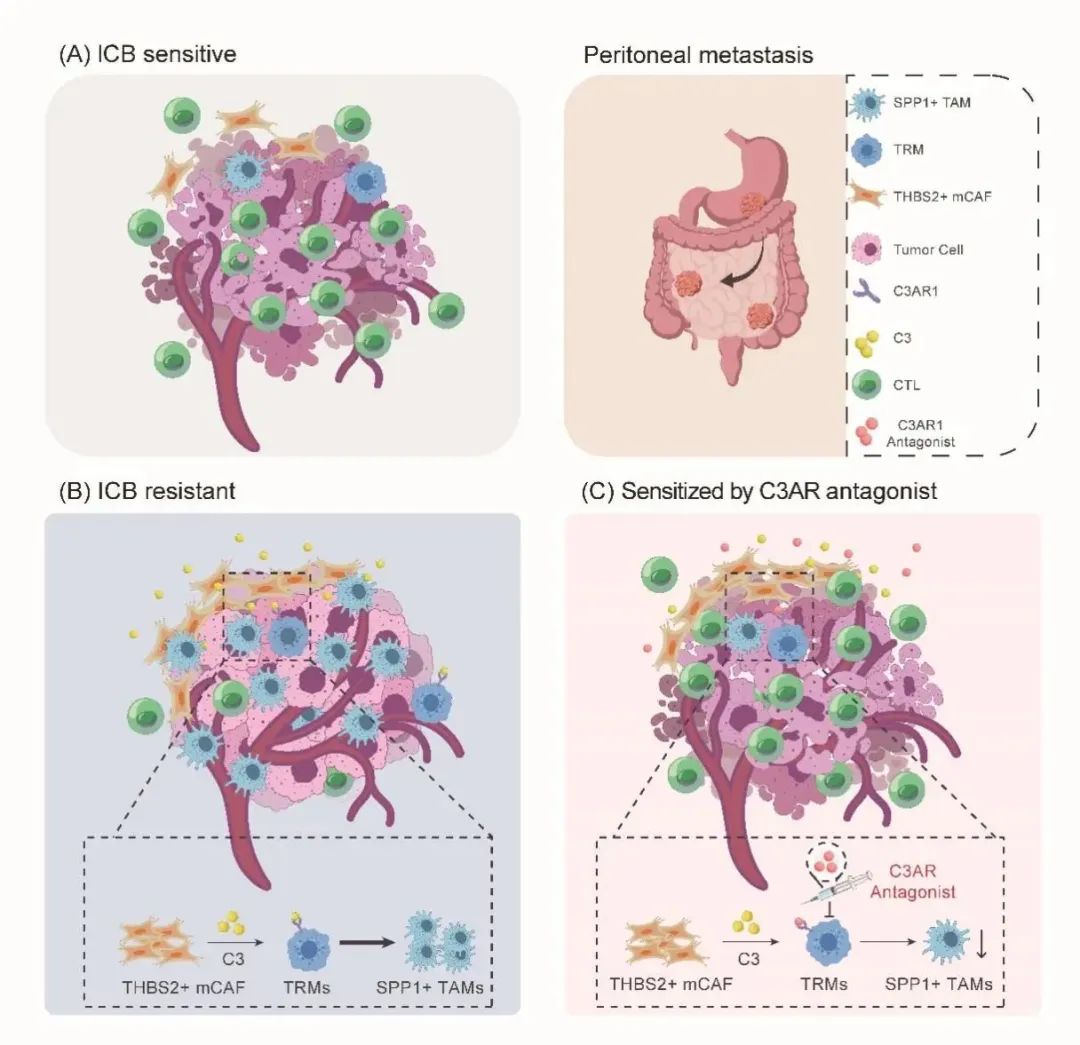
近日,中山大学肿瘤防治中心内科骆卉妍、徐瑞华教授及胃外科李元方教授团队在《消化道》(GUT)杂志,在线发表了题为“肿瘤微环境中的CAF——巨噬细胞交互作用介导胃癌腹膜转移免疫治疗耐药”的研究论文。该研究首次建立了单细胞分辨率的胃癌腹膜转移肿瘤微环境图谱,揭示了胃癌腹膜转移免疫检查点阻断剂(Immune checkpoint inhibitors,ICB)耐药机制,并提出了新的潜在干预策略。这对增敏肿瘤免疫治疗,尤其是在胃癌腹膜转移中的免疫治疗,具有重要的临床意义。 研究背景 研究方法 研究结果 研究结果 这种CAF-巨噬细胞生态位是胃癌腹膜转移(GCPM)中免疫治疗耐药的媒介。进一步的机制研究表明,胃癌腹膜转移中显著富集的THBS2+ mCAFs可通过补体C3-C3AR1轴促进腹膜组织驻留来源的SPP1+ TAMs形成和累积,从而形成促癌和免疫抑制的CAF-巨噬细胞生态位。最后,研究团队构建了小鼠体内瘤模型,证实C3-C3AR1轴阻断可破坏CAF-巨噬细胞相互作用,从而显著改善免疫治疗疗效。 研究结果 研究总结 综上所述,本研究构建的包含41万个单细胞的单细胞转录组图谱,为胃癌腹膜转移显著改变的免疫微环境提供了一个系统的视角。研究揭示了由SPP1+TAMs和THBS2+mCAFs组成的CAF-巨噬细胞生态位是胃癌腹膜转移ICB耐药的主因。此外,我们观察到THBS2+mCAF成分在胃癌腹膜转移灶中异常聚集,这些成分可通过补体C3-C3AR1轴促进了腹膜组织驻留来源的SPP1+TAMs的聚集,形成了一个促癌和免疫抑制的基质-髓系细胞相互作用。阻断C3-C3AR1轴可破坏基质-髓系细胞的相互作用,从而显著改善ICB的益处。此研究从肿瘤微环境角度为胃癌腹膜转移免疫治疗耐药机制提供了新的见解,并为开发ICB增敏药物的开发提供了新的实用靶点。 研究模式图 中山大学肿瘤防治中心内科骆卉妍主任医师、徐瑞华教授、实验研究部刘泽先研究员为论文的共同通讯作者。胃外科李元方副主任医师、第二届“志光计划”入选者郑永强博士、研究生黄嘉倩、胃外科聂润聪副主任医师、病理科吴其年副主任医师以及博士生左志军为该论文的共同第一作者。该项目获得了国家“免疫力数字解码”重大计划培育项目的资助。 专家介绍 徐瑞华 中国医学科学院学部委员、教授,博士生导师 中山大学肿瘤防治中心主任、医院院长、研究所所长 华南恶性肿瘤防治全国重点实验室主任 中国临床肿瘤学会前任理事长 中国抗癌协会副理事长 中国抗癌协会靶向治疗专委会首届主任委员 中国抗癌协会化疗专委会候任主任委员 中国临床肿瘤学会肠癌专委会主任委员 以最后通讯作者(少量共同)在NEJM、JAMA(2)、BMJ、Cell、Nature Med(5)、Nature Mater、Lancet Oncol(2)、Cancer Cell(3)、Ann Oncol(2)、JCO(2)、Lancet G&H(2)、JAMA Oncol(2)等发表高水平成果论文200 余篇(34篇IF>30),成果被写入57部国际指南,连续3年入选科睿唯安(Clarivate)全球高被引科学家,连续7年入选中国高被引学者榜单,H指数85。 以第一完成人获国家科技进步二等奖2项、中华医学科技奖、教育部科技奖及广东省科技奖等省部级一等奖共6项。全国创新争先奖1项、何梁何利基金科学与技术进步奖、吴阶平医药创新奖、谈家桢临床医学奖及CSCO年度成就奖。 入选国家百千万人才工程、全国先进工作者、国务院特殊津贴专家、南粤百杰人才培养工程、国家卫生计生突出贡献中青年专家等人才项目。 骆卉妍 医学博士、博士生导师 中山大学肿瘤防治中心内科主任医师 中国抗癌协会胃癌专业委员会青年委员会副主任委员 广东省临床医学学会消化肿瘤综合治疗青年专业委员会主任委员 广东省医学教育协会肿瘤学专业委员会副主任委员 Precision Clinical Medicine、Frontiers in Oncology、MedComm Future Medicine期刊编委 从事消化道肿瘤临床和基础转化研究十余年,在阐明肿瘤的复发转移、化疗耐药的机制、分子标志物的筛选和优化临床治疗方面取得了一系列的创新性成果。 研究成果以通讯作者或第一作者发表在 JAMA、Nat Mater、Lancet Oncol、GUT、Signal Transduct Target Ther、Sci Tran Med、Ann Oncol、PNAS、Clin Cancer Res等期刊,4项研究成果被9部国际国内指南采纳,获得国家发明专利授权7项,2项研究成果实现成功转化。 主持多项国家自然科学基金重大计划培育项目、面上项目、科技部国家重点研发计划子课题、广东省自然科学基金面上项目等。 先后荣获国家科技进步二等奖、中华医学会科技进步省部级一等奖、第二届“人民好医生 金山茶花计划”称号、第六届“国之名医 优秀风范”称号等。 李元方 医学博士、硕士生导师 中山大学肿瘤防治中心胃外科副主任(主持工作) 《CSCO胃癌诊治指南》执笔专家 中华医学会肿瘤分会胃肠学组委员 中国抗癌协会胃癌专业委员会委员 CSCO胃癌专家委员会委员 中国医师协会肿瘤外科专委会委员 长期从事胃癌微创手术、胃癌围手术期治疗优化、腹膜转移发生机制研究,以第一或通讯作者(含共同)在GUT、JNCI、Nature Medicine、Eur J Cancer等杂志发表多篇高质量SCI论文,主持广东省自然科学基金项目面上项目、希思科临床肿瘤学研究基金等基金。 原始出处: CAF-macrophage crosstalk in tumour microenvironments governs the response to immune checkpoint blockade in gastric cancer peritoneal metastases.Gut. 2024 Nov 12:gutjnl-2024-333617. doi: 10.1136/gutjnl-2024-333617



本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#胃癌# #胃癌腹膜转移#
9