ACS Nano:暨南大学韩方海等团队制备肿瘤可追踪和酶可激活的近红外荧光纳米探针对胃癌淋巴转移进行时空定位
6小时前 iNature iNature 发表于陕西省
该研究报道了具有可激活光输出的转移性LN报告基因(MLR),用于胃癌淋巴转移的精确时空定位。
前哨淋巴结活检在癌症治疗中具有重要意义,由于缺乏特异性和敏感性的光学探针,转移淋巴结(LN)的早期检测和精确切除方面仍面临挑战。
2024年12月16日,暨南大学/中山大学韩方海和中山大学黄佳国、徐伟平共同通讯在 ACS Nano 在线发表题为 “Spatiotemporal Mapping of Lymphatic Metastases in Gastric Cancer Using Tumor-Trackable and Enzyme-Activatable Near-Infrared Fluorescent Nanoprobes” 的研究论文。该研究报道了具有可激活光输出的转移性LN报告基因(MLR),用于胃癌淋巴转移的精确时空定位。
MLRs是自组装实体,包含具有亲脂性尾部和肿瘤靶向配体或荧光部分的混合两亲物,该配体或荧光部分被肿瘤特异性β-半乳糖苷酶(β-gal)裂解的开关包围。引流到LN后,在扩散的肿瘤细胞存在的情况下,MLRs选择性地激活其近红外荧光。在原位胃癌小鼠模型中,代表性报告基因MLR1将宏/微转移LNs与良性LNs区分开,并能够以空间依赖的方式检测早期跳跃性LNs转移。这种主动传感机制与流式细胞术分析的灵敏度和特异性相当。在手术切除的患者标本中,MLR1在1小时内将癌组织和转移性淋巴结与正常组织和良性淋巴结区分开来。因此,该研究制备了NIRF纳米探针,极易检测胃癌患者样本中的淋巴结转移,并重点介绍了一种用于了解转移进展的纳米探针。

胃癌(GC)是第二大最常见的恶性胃肠道肿瘤,也是癌症死亡的第四大原因,2020年全球约有110万新发病例和76万例死亡。由于早期缺乏特异性症状,大约70%的GC患者在晚期被诊断出来,通常伴有淋巴结(LN)转移。虽然LN转移是与生存率差密切相关的重要不良预后因素,但其在GC中的扩散途径仍知之甚少。无创成像技术,如正电子发射断层扫描(PET)、计算机断层扫描(CT)和磁共振成像(MRI)已用于术前分期,但其在检测早期淋巴转移方面缺乏敏感性。99m-锝(99 mTc)的淋巴闪烁显影是检测和切除前哨LN的金准临床方法,但会带来放射性影响。尽管前哨LN活检(SLNB)有效,但识别纤维脂肪组织内的转移性LN仍具有挑战性,假阴性率相对较高,为13-52%。因此,迫切需要替代方法来实现转移性LN的无创早期检测,并引导医生精确切除。
荧光成像能够以高灵敏度实现活体受试者中动态生物病理学过程的实时、无创可视化。临床上,吲哚菁绿(ICG)用作信噪比(SBR)示踪剂,用于淋巴管和前哨LN的术中实时可视化。然而,由于人体内的非特异性相互作用,其“始终开启”的荧光可能导致假阳性结果,从而阻碍准确的癌症转移追踪。虽然已经探索了其他具有被动(如聚合物涂层纳米探针、金纳米簇或量子点)或主动(如IRDye800CW偶联的贝伐珠单抗、西妥昔单抗或帕尼单抗)肿瘤靶向能力的探针,但其具有非特异性生物分布,导致信噪比低,且无法充分区分宏观/微观转移LN与良性LN。相比之下,对肿瘤生物标志物(如过表达酶、异常酸度)产生特异性反应的可激活探针为精确切除转移灶提供了更高的敏感性。然而,很少有研究报道可激活探针用于早期检测转移性LN内扩散的癌细胞。此外,GC中的淋巴转移模式非常复杂,异常的淋巴引流模式经常发生跳跃性LN转移。以往研究主要集中在调查前哨LN转移的频率,尚不清楚淋巴网络内肿瘤细胞扩散的时间动力学(时间依赖性方式)和转移性LN的解剖位置(空间依赖性方式)。
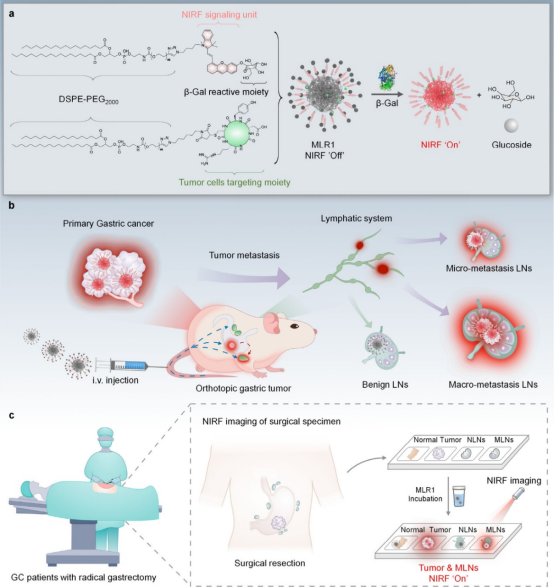
图1 肿瘤可追踪和酶激活NIRF纳米探针用于转移性LN的时空定位示意图(摘自ACS Nano)
该研究报道了一种肿瘤可追踪和酶激活的NIRF纳米探针(MLR),用于转移性LN的时空定位。MLR是自组装的纳米复合物,包含两种化学修饰的1,2-二硬脂酰-sn-甘油-3-磷酸乙醇胺-聚(乙二醇)(DSPE-PEG)衍生物。每种衍生物都有一个亲脂性DSPE尾部,用于高效的LN递送,另一端用靶向整合素的环精氨酸-甘氨酸-天冬氨酸肽(cRGDyC)功能化,该肽在癌症中作为肿瘤识别基序过表达,或锁定半菁NIRF荧光团的d-半乳糖残基,可被肿瘤标志物β-半乳糖苷酶(β-Gal)作为传感基序切割。因为笼状苯酚基团抑制了电子供体能力,MLR本质上是非荧光的。它们仅在扩散的肿瘤细胞中β-Gal增加的情况下发出荧光,因此能够特异性识别淋巴结转移。同时,作者描述了皮下胃肿瘤模型中MLR1-3的构建和筛选。MLR1在肿瘤靶向和传感方面表现出最佳性能,在原位胃肿瘤模型中进一步优化,用于转移性LN的时空定位,将宏观和微观转移性LN与良性LN区分开来,并能够以空间依赖性方式早期检测跳跃性LN转移模式。最后,作者展示了该探针在收集的根治性胃切除术期间切除人体标本中,鉴定癌组织和转移性LNs的应用,展示了该探针在临床上协助早期诊断转移性LNs的潜力。
参考消息:
https://pubs.acs.org/doi/10.1021/acsnano.4c12915
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












前往app查看评论内容
5 0