淋巴瘤中循环肿瘤DNA的检测技术及应用
2025-03-24 聊聊血液 聊聊血液 发表于陕西省
ctDNA 为 cfDNA 子集,可作淋巴瘤无创诊断等生物标志物。本文介绍淋巴瘤分子遗传特征、ctDNA 检测方法及在各亚型应用,指其机遇与挑战,助推进个性化医疗。
ctDNA
淋巴瘤是一种来源于淋巴细胞和淋巴组织的恶性肿瘤,临床表现复杂且异质性,需要准确的患者分类进行适当的治疗。虽然淋巴结或淋巴组织的侵入性病理学检查仍然是淋巴瘤诊断的金标准,但其在深部肿瘤中的实用性有限,如腹膜内和中枢神经系统淋巴瘤。此外,活检存在固有的并发症风险。计算机断层扫描 (CT) 和正电子发射断层扫描/计算机断层扫描 (PET/CT) 成像对于治疗评估和监测至关重要,但缺乏检测早期克隆演变和微小残留病 (MRD) 的能力。
基于液体活检的循环游离DNA(cfDNA)是指由细胞凋亡(程序性细胞死亡)或坏死(因损伤或疾病导致的细胞死亡)释放到血液或其他体液中的小片段DNA,可在血液、尿液、唾液及其他体液中被检测到,在临床和研究领域受到了广泛关注。循环肿瘤 DNA(ctDNA) 是cfDNA的一个子集,来源于肿瘤细胞,携带特定于癌症的独特遗传和表观遗传特征(图1),分析ctDNA提供了一种非侵入性的替代方法,允许重复采样,可克服空间异质性和侵入性活检的局限性。ctDNA 可提供淋巴瘤的遗传学和表观遗传学见解,并作为诊断、风险分层和治疗反应的动态、可量化的生物标志物。
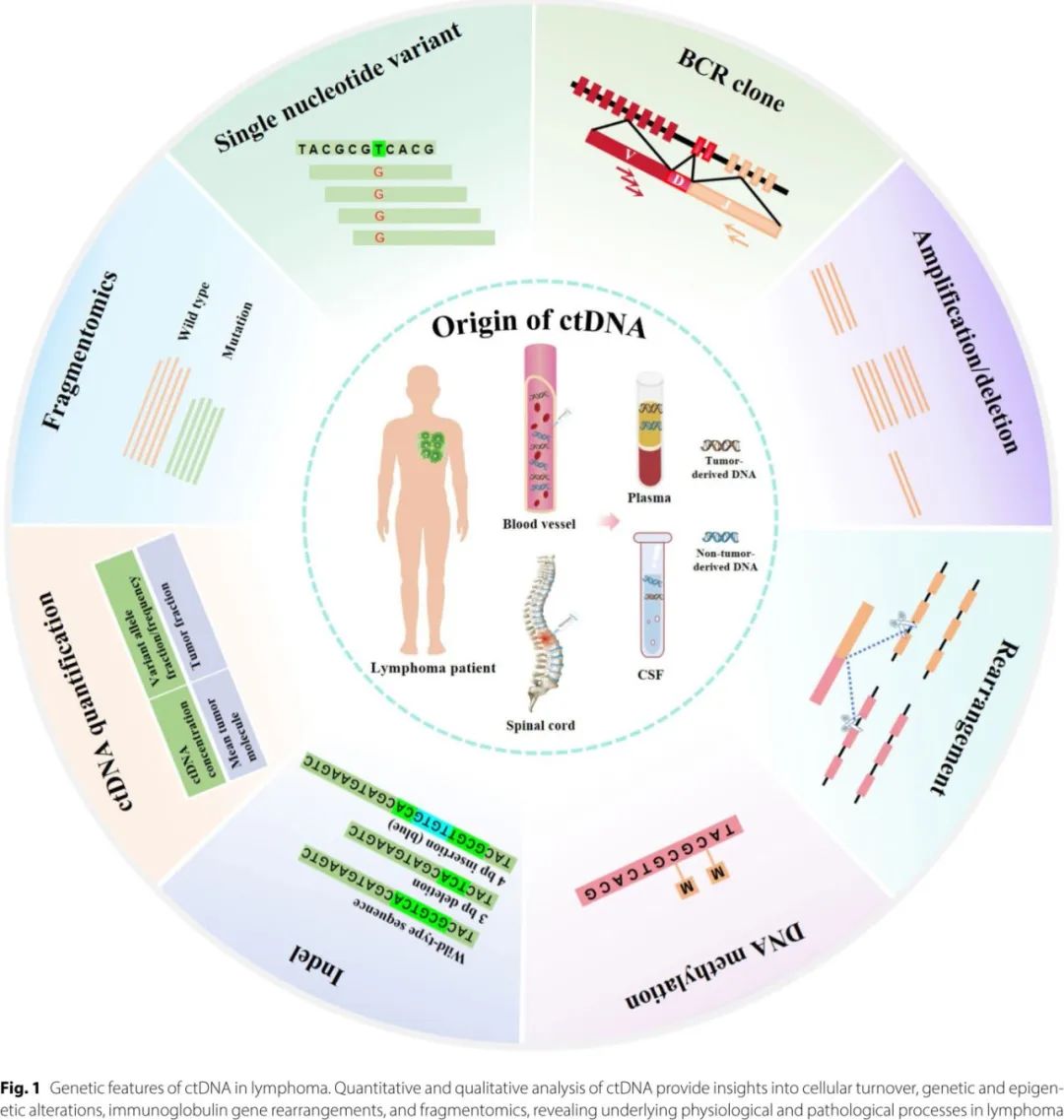
《Journal of Hematology & Oncology》近日发表综述,提供了淋巴瘤常见的遗传改变的全面概述,并评估目前的ctDNA检测技术,包括 PCR 检测和二代测序 (NGS)等,还研究了ctDNA在各种恶性淋巴瘤的无创基因分型、风险分层、治疗反应监测和 MRD 检测中的最新进展,强调了其在通过非侵入性方法推进个性化医疗中的关键作用。

淋巴瘤的分子遗传学
淋巴瘤大致分为两种主要类型:非霍奇金淋巴瘤 (NHL),约占病例的85-90%,霍奇金淋巴瘤 (HL),其余占10-15%。NHL 本身代表着一组具有不同基因特征的不同恶性肿瘤,大约85-90%的 NHL 病例起源于 B 细胞,包括弥漫性大B细胞淋巴瘤(DLBCL)、滤泡性淋巴瘤 (FL)、边缘区淋巴瘤 (MZL) 和套细胞淋巴瘤 (MCL),而其余来源于 T 细胞或NK)细胞。NGS 的最新进展为这些淋巴瘤亚型的基因组特征提供了全面的见解,如图2所示。
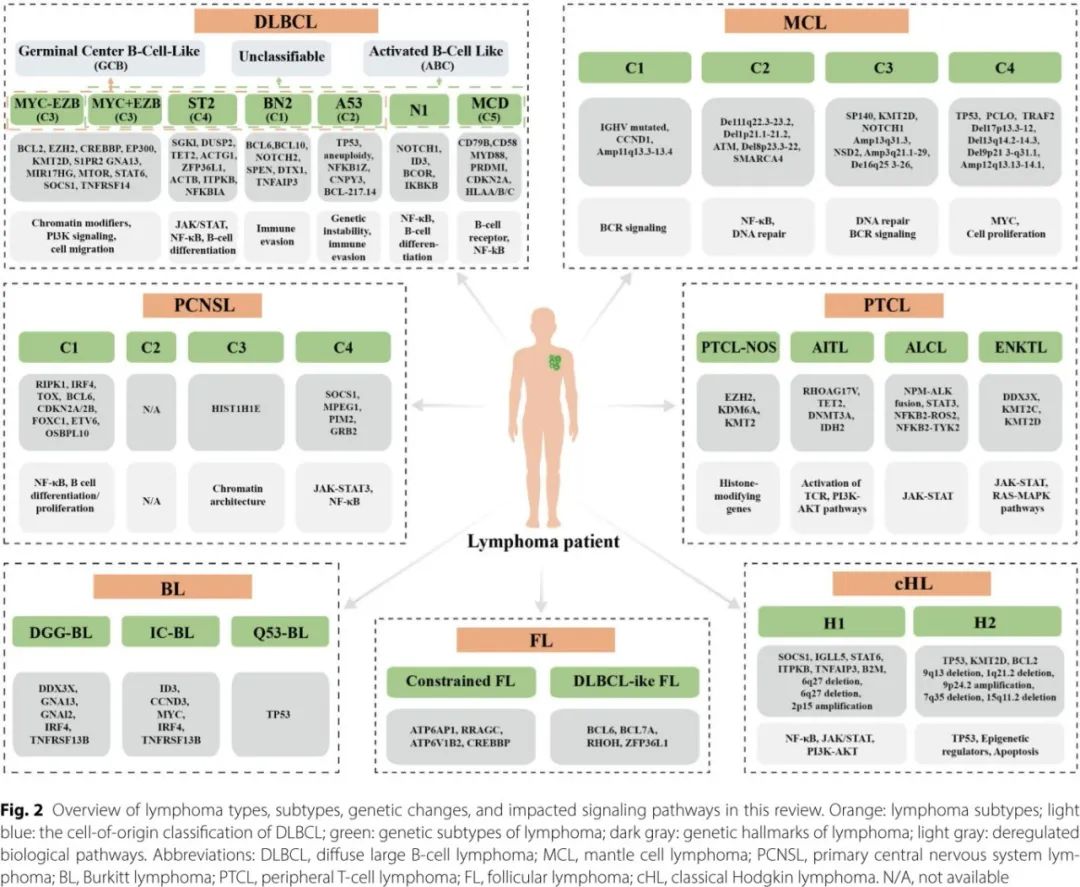
弥漫性大B细胞淋巴瘤
DLBCL 占 B 细胞 NHL 的30-40%,表现出明显的遗传异质性,使其异常特征的完整定义变得复杂(图2)。对大型活检队列的综合分析阐明了其遗传变异,而 ctDNA 分析则可以检测组织活检中遗漏的改变。致病性改变可影响DLBCL的关键过程:B细胞分化(BCL-6易位破坏生发中心反应,PRDM1改变增强NF-κB活化并损害浆细胞分化);B细胞受体信号传导(CD79B和 CARD11 突变,BCL10扩增,Toll样受体信号传导中的 MYD88L265P 突变,TNFAIP3 突变、REL表达增加、PTEN缺失和PI3K–AKT–mTOR通路中 PIK3CA 扩增或激活突变);细胞凋亡(BCL2和 FAS 改变);表观遗传调控(KMT2D、CREBBP、EZH2和 EP300 突变);免疫逃避(PD-L1过表达)。
基于这些特征的分子亚型可通过基于 RNA 的细胞起源分类(生发中心 B 细胞样和活化 B 细胞样)和基于基因组畸变的系统定义5个clusters (C1-C5) 和7个亚型(EZB MYC +、EZB MYC-、ST2、BN2、A53、N1和MCD)进行风险分层(图2),血浆 ctDNA 基因分型可进一步补充基于 RNA 的分类。总的来说,这些遗传学见解强调了 DLBCL 的复杂性,并提出了靶向治疗和预后标志物的路径。
套细胞淋巴瘤和伯基特淋巴瘤
MCL和BL具有独特的遗传特征。MCL的特征为t(11;14)(p13;q32)易位(导致CCND1过表达),以及DNA损伤修复(ATM、TP53)、表观遗传调控(NSD2、KMT2D、MEF2B、KMT2C、SMARCA4)和细胞稳态与生长(CCND1、CDKN2A、BIRC3、CARD11、TRAF2、RB1、POT1、NOTCH1/2)的反复变异。BL的特征为t(8;14)易位激活MYC,以及TCF3、ID3、CCND3、TP53和CDKN2A的突变。MCL和BL都可以根据全面的基因组和转录组学特征划分为与预后相关的亚型。
滤泡性淋巴瘤和边缘区淋巴瘤
FL和MZL是常见的惰性B细胞非霍奇金淋巴瘤(B-NHL),其中约15%的病例会转化为侵袭性B细胞淋巴瘤。滤泡性淋巴瘤的特征为t(14;18)(q32;q21)易位,这一易位对于其发展是必要的,但并非充分条件,并且经常出现表观遗传调控因子的改变,如CREBBP、KMT2D、EZH2和EP300。边缘区淋巴瘤包括三个亚型:结外型、脾型和结内型。结外MZL常与t(11;18)(q21;q21)易位相关,该易位产生API2-MALT1融合,较少与t(14;18)(q32;q21)易位(IGH-MALT1)或t(1;14)(p22;q32)易位(BCL10-IGH)相关。脾MZL和结内MZL共享基因组改变,包括KMT2D、NOTCH2、PTPRD、TNFAIP3和KLF2的突变。基于这些遗传特征的预测模型已被开发用于评估FL和MZL转化为侵袭性淋巴瘤的风险。
中枢神经系统淋巴瘤(CNSL)
CNSL是一种罕见但具有侵袭性的NHL亚型,包括原发性中枢神经系统淋巴瘤(PCNSL)和继发性中枢神经系统淋巴瘤(SCNSL),后者指从全身性疾病转移至中枢神经系统的淋巴瘤。PCNSL在诊断时局限于CNA,其特征为关键基因(PIM1、MYD88、CD79B、KMT2D和BTG2)中反复出现的体细胞突变,这些突变影响关键信号通路(JAK-STAT、NF-κB和B细胞受体),并推动了淋巴瘤的发生和发展。此外,还可出现18q21.23和6p21的反复扩增和缺失,以及显著的MHC I类表达缺失,这可能有助于免疫逃逸。对240例PCNSL病例的综合分析识别出四个不同的分子clusters(C1、C2、C3和C4)(见图2),每个cluster都有独特的遗传和表观遗传特征以及预后结果。这些分类为PCNSL的异质性提供了宝贵的见解,并对个性化治疗策略和预后具有重要意义。
外周T细胞淋巴瘤(PTCL)
PTCL是一组罕见且多样化的侵袭性非霍奇金淋巴瘤,起源于成熟的T细胞和NK细胞。其主要亚型包括PTCL-非特指型(PTCL-NOS)、血管免疫母细胞性T细胞淋巴瘤(AITL)、ALK阳性和阴性间变性大细胞淋巴瘤(ALCL)以及结外NK/T细胞淋巴瘤(ENKTL)(图2)。PTCL-NOS常携带组蛋白修饰基因(EZH2、KDM6A和KMT2)的突变。AITL以反复出现的RHOAG17V失活突变和表观遗传调控因子(TET2、DNMT3A和IDH2)的改变为特征,同时伴有TCR和PI3K-AKT通路的激活。ENKTL表现出RNA解旋酶基因(如DDX3X)的突变、JAK-STAT和RAS-MAPK通路的异常以及表观遗传调控因子(KMT2C、KMT2D)的改变。ALK阳性ALCL由NPM-ALK融合定义,激活STAT3;而ALK阴性ALCL涉及NFKB2-ROS2和NFKB2-TYK2融合,驱动STAT3激活。全面的基因组分析已经明确了具有独特特征的四个不同分子和微环境PTCL亚型。
霍奇金淋巴瘤(HL)
超过90%的HL病例为经典型霍奇金淋巴瘤(cHL),而结节性淋巴细胞为主型霍奇金淋巴瘤(NLPHL)占5%到10%。由于霍奇金和Reed-Sternberg(HRS)细胞数量稀少,仅占肿瘤细胞总数的0.1%到10%,因此基于组织的cHL基因组分析受到限制。相比之下,非侵入性的cfDNA分析表现更为出色。cfDNA和流式分选的HRS细胞测序揭示了SOCS1、TNFAIP3、B2M、STAT6、CSF2RB、GNA13、PTPN1、ARID1A、ZNF217、IL4R、NFKBIA、ACTB、PCBP1、CISH、NFKB2和连接组蛋白H1-5的反复突变,以及反复出现的拷贝数变异(CNVs),包括2p15(REL)、9p24.1-9p24.2(PDL1)、5p15.33(TERT)、17q21.31(MAP3K14)、6q27(TNFAIP3)、17p13.1(TP53)、9p21.3(CDKN2A/B)、11q22.3(BIRC3)和6p21-22(H1-5、HLAA和HLA-C)。对366例患者的靶向ctDNA测序定义了两个cHL亚型:H1(68%的病例),其特征为NF-κB、JAK/STAT和PI3K-AKT通路的突变;H2(32%),表现出更广泛的结构异常,并携带TP53和KMT2D的突变。
NLPHL显示出独特的遗传特征。它以淋巴细胞为主细胞的存在为特征,并且缺乏cHL中常见的许多突变。在NLPHL中,靶向测序揭示了SGK1、DUSP2和JUNB的突变,以及频繁的BCL6易位——这一发现在cHL中较为罕见。此外,cHL中常见的STAT6、JAK2、TNFAIP3和NFKBIA的突变在NLPHL中很少见。
ctDNA检测和分析方法
传统的淋巴瘤基因组分析在临床应用中面临挑战,主要原因在于肿瘤的空间异质性以及通过细针穿刺和核心针活检通常只能获得有限的肿瘤组织。ctDNA分析则提供了一种非侵入性的方法,能够全面捕捉肿瘤的分子特征,而无需受到这些采样限制,显示出在淋巴瘤的基因分型、治疗反应评估和MRD监测中的潜力。
液体活检技术(特别是通过分析外周血等体液中的ctDNA)已成为淋巴瘤检测和监测的有力工具。最佳的ctDNA收集和处理依赖于关键的预分析因素,包括血液体积、血浆分离的时机以及使用细胞稳定管以防止细胞DNA污染。在ctDNA分析技术中,基于PCR的方法和基于二代测序(NGS)的方法最为常见,并且在过去几年中得到了广泛研究(见表1;图3)。
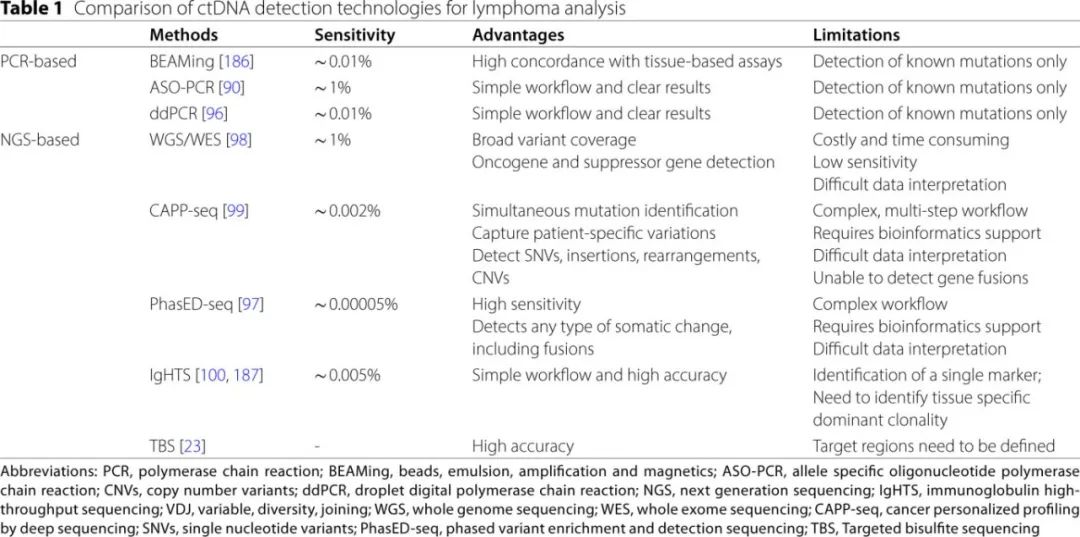

基于PCR的方法
基于PCR的检测方法,包括BEAMing(磁珠、乳化、扩增和磁性分离)、等位基因特异性寡核苷酸PCR(ASO-PCR)和数字PCR(ddPCR),因其成本效益高和快速的周转时间,非常适合用于淋巴瘤的ctDNA检测(见图3)。BEAMing利用磁珠基础的PCR扩增技术,在微乳化液中进行,并结合流式细胞术,使用链霉亲和素包被的磁珠和生物素标记的寡核苷酸,通过荧光标记和分析PCR产物来高灵敏度地检测和定量核苷酸变异(图3a);灵敏度可低至0.01%,能够可靠地检测ctDNA中的遗传变异,并与患者组织样本中识别的变异高度一致(表1)。
ASO-PCR也称为扩增阻滞突变系统(ARMS),使用独特设计的引物,仅在单核苷酸变异(SNV)或野生型序列完全匹配时才扩增DNA,通过特定的PCR产物模式实现精确的SNV检测(图3b)。例如,Jimenez等使用ASO-PCR可靠地检测了淋巴增殖性疾病中的MYD88L265P突变,突出了其作为一种灵敏、成本效益高的诊断工具的实用性。
ddPCR是定量DNA突变的金标准,因其可将DNA分子分配到数千个滴液中进行单独的PCR扩增,从而实现高灵敏度和绝对定量,无需标准曲线(图3c)。其在识别淋巴瘤中的遗传变异方面非常有效,例如检测FL中的t(14;18)易位、MCL中的t(11;14)易位以及PCNSL中的MYD88L265P突变。
尽管PCR方法具有诸多优势,但它们通常仅限于检测已知的单一或少数突变,灵敏度阈值约为0.01%等位基因频率(AF)(表1)。
基于NGS的方法
基于NGS的技术能够对DNA分子进行大规模并行测序,从而全面评估突变景观,包括单核苷酸变异(SNVs)、插入和缺失以及拷贝数变异(CNVs)。靶向扩增子基础和杂交捕获的NGS方法相较于单基因检测具有优势,能够在无需针对患者进行优化的情况下识别淋巴瘤中广泛的遗传变异。例如,Dubois等开发了Lymphopanel(一个应用于215例患者的34基因检测panel),可揭示DLBCL亚型之间的分子异质性,并识别出具有潜在治疗和预后意义的突变。
免疫球蛋白高通量测序(IgHTS)已获得美国食品药品监督管理局(FDA)批准,用于检测慢性淋巴细胞白血病(CLL)、多发性骨髓瘤(MM)和B细胞急性淋巴细胞白血病(B-ALL)中的MRD。该技术使用通用引物进行免疫球蛋白基因组区域的PCR扩增,随后通过测序识别扩增的IgV(D)J克隆型(图3d)。IgHTS的灵敏度约为0.005%,尽管其有效性可能受到体细胞超突变和cfDNA分析量的限制(见表1)。由于不需要患者特异性引物,该技术应用广泛,尽管对于高度突变的淋巴瘤亚型存在一些限制。
癌症个性化深度测序分析(CAPP-seq)最初为非小细胞肺癌开发,覆盖约125 kb,结合独特的条形码策略和生物信息学算法,可提高灵敏度,能够检测到约0.002%等位基因频率的ctDNA(图3e;表1)。这种超灵敏检测方法被用于多种肿瘤学研究领域,包括早期检测、非侵入性基因分型、耐药突变识别和疾病负担定量。
分相变异富集和检测测序(PhasED-Seq)是一种杂交捕获方法,利用分相变异,在同一DNA链上150个碱基对内检测突变,以提高ctDNA的灵敏度(图3f)。由于正常和异常的体细胞超突变,B细胞淋巴瘤特定基因组区域中常见分相突变。通过将淋巴瘤ctDNA稀释在健康cfDNA中进行分析灵敏度测试,检测阈值达到0.00005%(表1)。
其他技术包括焦磷酸测序、全外显子测序(WES)和全基因组测序(WGS)等,已广泛用于淋巴瘤患者的ctDNA分析(图3g)。此外,评估表观遗传修饰作为淋巴瘤诊断和监测生物标志物的方法正在探索中(图3h)。Kristensen等使用焦磷酸测序证明在DLBCL患者血浆cfDNA中检测异常启动子DNA甲基化的可行性;他们发现异常的DAPK1甲基化是一个独立的预后标志物,与治疗反应和患者生存相关。此外,利用ctDNA对超过10万个基因组区域进行靶向亚硫酸氢盐测序(TBS),能够在所有阶段检测到包括淋巴瘤在内的50多种癌症类型,平均灵敏度为54.9%,特异性超过99%,单个假阳性率低于1%。
尽管已报告了多种技术,但在淋巴瘤ctDNA分析中仍面临重大挑战,包括检测低绝对量和比例(通常小于0.5%)的ctDNA,以及淋巴瘤中存在的突变多样性(表1)。
ctDNA检测在淋巴瘤中的应用
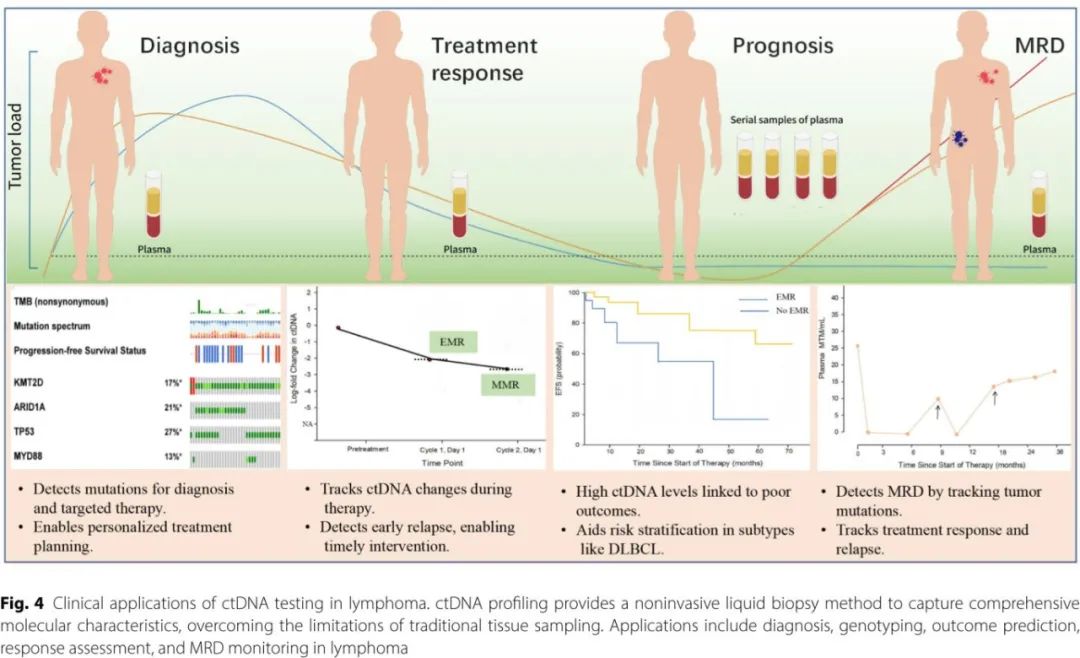
关于ctDNA在淋巴瘤中的应用研究主要集中在DLBCL,也有部分研究扩展到其他淋巴瘤亚型(表2和3)。本节总结ctDNA在各种淋巴瘤亚型中用于非侵入性基因分型、治疗反应监测以及MRD评估的临床应用(图4)。
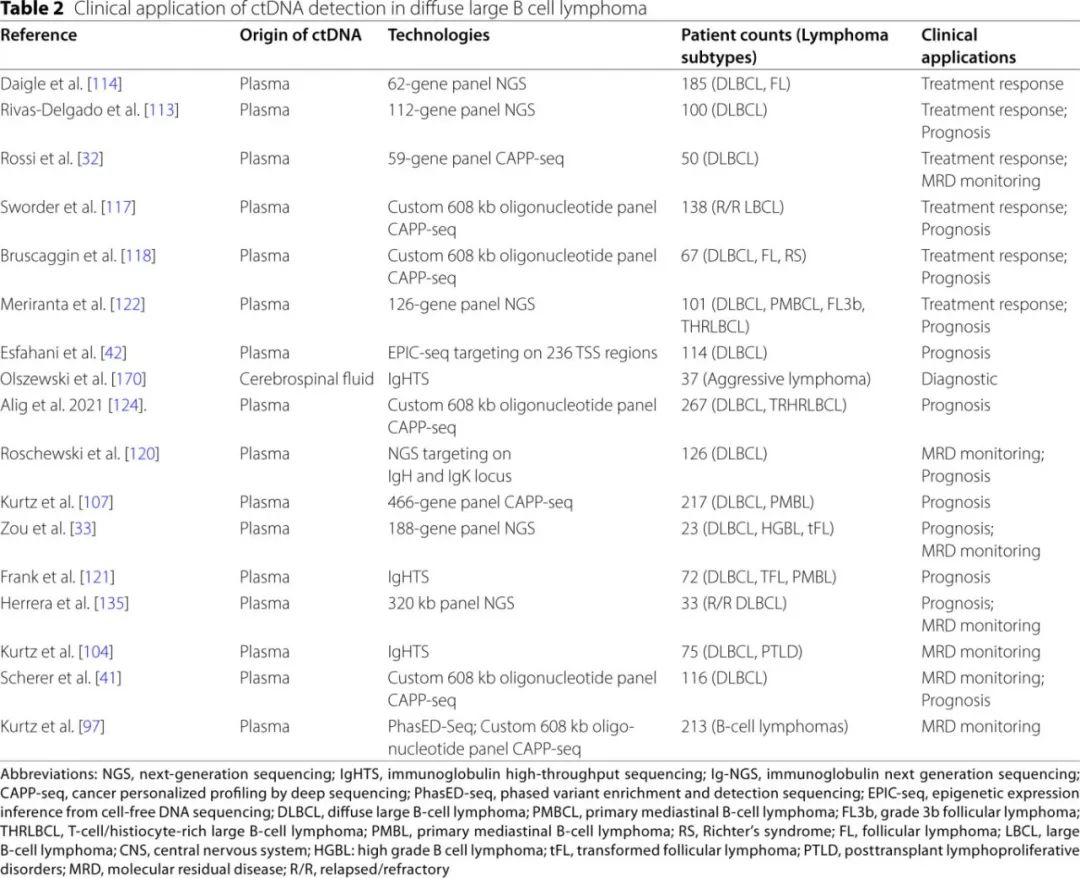
DLBCL中ctDNA检测的临床意义
ctDNA作为一种非侵入性基因分型生物标志物
通过活检或手术获取的淋巴瘤组织的遗传分析对于诊断和亚型分类至关重要,然而由于肿瘤的空间异质性以及通过细针穿刺或核心针活检获得的组织材料有限,这种组织分析可能面临挑战。为了克服这些限制,ctDNA作为一种非侵入性生物标志物被研究用于全面捕捉DLBCL的分子特征(表2)。研究表明,DLBCL中ctDNA和基于组织的基因分型之间的一致率超过70%。这种高度一致性突出了ctDNA基因分型在DLBCL个体化治疗选择中的潜力。例如,携带B细胞受体突变(尤其是MYD88突变)的ABC-DLBCL亚型患者对伊布替尼的反应率高达80%。此外,基于ctDNA的细胞起源(COO)分类工具与肿瘤活检结果高度一致,并已有效用于个体化风险分层。此外,ctDNA分析经常检测到组织活检中未发现的新突变,这可能是由于肿瘤的空间异质性、复发中的克隆进化或靶向治疗的选择性压力。这些发现强调了ctDNA基因分型是一种对DLBCL患者临床可行的非侵入性工具。
通过ctDNA定量评估肿瘤负荷和治疗效果
除了基因分型外,治疗前的ctDNA水平可以可靠地评估疾病负荷,并预测DLBCL的治疗结果。基线ctDNA水平与总代谢肿瘤体积(TMTV)、国际预后指数(IPI)、乳酸脱氢酶(LDH)水平和Ann Arbor分期相关,对于接受标准免疫化疗的患者具有较高的临床结果预测价值。Alig等的研究表明,治疗前的ctDNA水平还可以预测较短的诊断至治疗间隔,并作为267例DLBCL患者无事件生存(EFS)的独立预后标志物。
传统的风险分层工具,如IPI和TMTV,通常在治疗前只使用一次,并未达到个体化治疗所需的精确度。受CML和CLL中分子反应模型的启发,最近的研究调查了在使用蒽环类药物方案治疗的DLBCL中ctDNA分子反应的预后效用。在一项早期研究中,经过两周期剂量调整的EPOCH-R治疗后,通过lgHTS检测不到中期ctDNA的DLBCL患者显示出良好的5年PFS。基于这些发现,Kurtz等提出了使用CAPP-seq在一线R-CHOP治疗后一个周期的早期分子学反应(EMR)的阈值。在他们的框架中,ctDNA减少2个对数定义为EMR,两个周期后减少2.5个对数为主要分子学反应(MMR)。EMR和MMR均与接受一线或挽救治疗的患者24个月时改善的EFS显著相关,因素量分析表明EMR和MMR可独立预测EFS和OS。研究还表明,分子学反应(EMR或MMR,风险比为6.5–10和11–26)比治疗前ctDNA(风险比为2.4–2.6)更能强烈预示结局。此外,经过四个治疗周期后ctDNA的清除为多因素分析中的独立预后生物标志物。
为解决固定点ctDNA评估的局限性,Kurtz团队开发了连续个体化风险指数(CIRI),这是一个动态模型,结合IPI、治疗前ctDNA、COO、EMR、MMR和中期PET/CT,以提供个体化的风险特征。CIRI模型在预测结果方面优于传统方法。此外,将MMR与中期PET/CT相结合可改善PFS分层,在不同风险组中得出2年PFS率分别为84%、17%和0%(p<0.001)
复发/难治性(R/R)DLBCL中ctDNA用于风险分层和治疗反应评估
在R/R DLBCL中,ctDNA水平的临床应用显示出在多种治疗方案中的潜力,尤其是在CAR-T细胞疗法中。
在一项对72例接受阿基仑赛治疗的R/R DLBCL患者的研究中,输注后一周内ctDNA检测不到的患者中有70%获得持久缓解,而疾病进展的患者中只有13%检测不到ctDNA(p<0.0001)。此外,第28天可检测到ctDNA预示着PFS和OS更差。另一项使用CAPP-seq在两个独立的CAR-T细胞队列中的研究显示,在治疗后的第1周和第4周,ctDNA水平较高与疾病进展显著相关(p<0.05),治疗前的ctDNA水平(p=0.003)和第4周的最小分子残留(p=0.028)可以预测EFS。
在另一项研究中,CAPP-seq用于评估接受维泊妥珠单抗联合苯达莫司汀和利妥昔单抗(BR)或单独BR治疗的R/R DLBCL患者的基线ctDNA水平,结果显示基线ctDNA水平与PFS和OS均存在相关性。与未达到完全缓解(CR)的患者相比,达到CR的患者ctDNA水平显著下降。在40例接受panobinostat治疗的R/R DLBCL患者(27例de novo,13例为转化型)中,无论是否联合利妥昔单抗,与基线ctDNA水平相比,第15天的ctDNA变化在预测治疗反应方面显示出71.4%的敏感性和100%的特异性。
在中国医学科学院血液病医院一项纳入23例R/R DLBCL患者的动态ctDNA监测研究中,接受CD19 CAR-T细胞治疗后第28天ctDNA检测不到的患者与PFS(p=0.004)和OS(p=0.004)更长相关。此外,较短的ctDNA片段(<170 bp)与较差的PFS(P=0.002)和OS(p=0.008)相关。这些发现表明,基线ctDNA水平、早期ctDNA动态变化和片段大小是R/R DLBCL治疗反应和生存结局的有希望的预测因子。
MRD监测中的ctDNA应用
在DLBCL中,即使患者在一线蒽环类药物治疗后达到缓解,复发仍然是一个令人担忧的问题。传统的监测技术(包括临床检查和影像学检查)通常缺乏检测早期复发的敏感性和特异性。而ctDNA监测提供了一种非侵入性和无辐射的替代方法,允许通过肿瘤信息或疾病特异性检测进行个性化的MRD检测。多项研究强调了ctDNA在DLBCL的MRD监测中优于影像学检查的效用。两项独立研究显示,通过IgHTS分析血浆ctDNA可提供更高的特异性和高阴性预测值,能够在放射学证据出现前3到3.5个月检测到复发。Scherer等将CAPP-seq应用于监测达到完全缓解(CR)或复发的DLBCL患者的血浆ctDNA,发现MRD检测平均提前6个月预测复发,优于IgHTS和影像学技术。PhasED-Seq进一步提高了灵敏度,在活检确认复发之前,检测到所有CAPP-seq无法检测到的样本中的MRD。此外,将ctDNA片段分析与基于突变的MRD监测相结合可能进一步提高检测准确性,特别是在基于突变的检测结果为阴性或PET结果为阳性的患者中。
其他淋巴瘤类型中ctDNA检测的临床意义
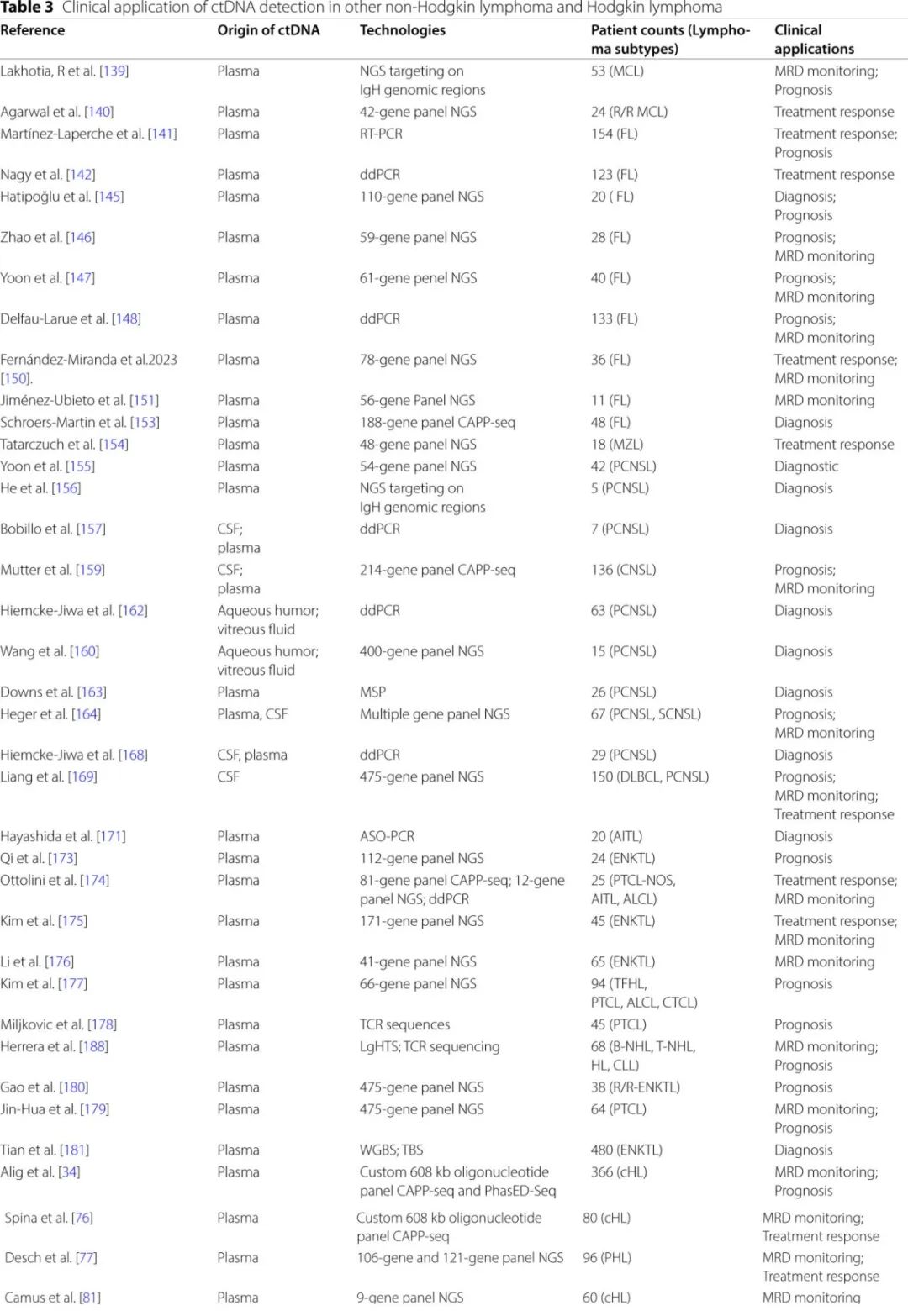
ctDNA的应用还扩展到其他NHL类型,包括MCL、FL、MZL、CNSL、PTCL和HL,具体见表3。
套细胞淋巴瘤
在初治MCL患者中,较高的治疗前ctDNA水平与多个预后指标相关,包括国际预后指数(IPI)(P=0.0004)和总代谢肿瘤体积(TMTV)(r=0.73;P=0.0001)。然而,在治疗前ctDNA水平较高(高于中位数)的患者和较低(低于中位数)的患者之间,并未观察到统计学上显著的生存差异。非侵入性的ctDNA基因分型还可以提供对治疗耐药机制的见解。例如,在接受伊布替尼-维奈克拉治疗的MCL患者中,ctDNA分析揭示所有5例患者的9号染色体9p21.1-p24.3缺失和与耐药相关的特定突变。尽管这些发现很有希望,但仍需要进一步研究来确定这种基因型数据是否可以指导MCL的个性化治疗。
在一项对53例初治MCL患者的纵向研究中,中位随访时间为12.7年,经过两周期诱导治疗后ctDNA检测不到的患者比ctDNA可检测的患者有显著更长的无进展生存期(PFS)和总生存期(OS)(中位PFS:2.7年vs 1.8年,P=0.005;中位OS:13.8年 vs 7.4年,P=0.03)。在7例患者中,分子复发在临床进展之前就可以检测到,表明MRD引导的治疗策略可能会改善预后。然而仍需要进一步研究来通过比较抢先治疗与MCL的传统治疗,以评估MRD引导的治疗。
滤泡性淋巴瘤和边缘区淋巴瘤
EZH2是指导FL一线治疗的重要生物标志物,他泽司他(tazemetostat)已在美国和中国获批用于携带EZH2突变的FL患者。在123例FL患者的队列中,多重数字PCR(ddPCR)通过配对活检组织和ctDNA检测到EZH2突变频率为41.5%,高于之前估计的20%到27%。这突显了在FL的ctDNA样本中进行常规EZH2突变筛查的潜在需求,可优化患者选择和进行靶向治疗。
除了遗传突变筛查外,液体活检分析也为FL的预后特征提供了进一步的见解。在FL中,BCL2、KMT2D、EP300、STAT6、CREBBP和TP53等基因的血浆ctDNA突变高水平与不良生存结果相关、。ctDNA、循环肿瘤细胞(CTCs)和总代谢肿瘤体积(TMTV)各自的预后价值已被明确证明。TMTV升高(>510cm³,p=0.0004)、CTC计数高(>0.0018 PB细胞,p=0.03)或cfDNA水平增加(>2550等效基因组/ml,p=0.04)的FL患者显示出较低的4年PFS。在多因素Cox分析中,cfDNA和TMTV仍是独立预测结果的因素,强调了它们的预后意义。
在FL中,治疗前的ctDNA水平具有特别的预后价值,高水平是多因素分析中与PFS相关的唯一独立因素(HR=4,p=0.039)。治疗前ctDNA水平高的患者预后明显较差,与获得CR或未发生POD24的患者相比,未获得CR或发生POD24的患者的ctDNA水平更高(p=0.02和p<0.001)。在13例经过一线化疗后达到CR的FL患者的纵向研究中,持续存在或重新出现ctDNA突变与疾病复发密切相关,强调了ctDNA在监测复发早期迹象中的效用。
ctDNA水平还在评估不同FL治疗方案的治疗反应方面显示出潜力。在接受CD19 CAR-T细胞治疗的FL患者中,4例治疗后PET/CT阳性的患者中有2例通过ctDNA分析判定为MRD阴性,并且在中位随访34个月后未发生复发,表明ctDNA监测对于FL可补充PET/CT在确认治疗成功和评估MRD状态方面的作用。
从惰性FL向侵袭性DLBCL的转变通常预示着预后恶化。Scherer等开发了一种基于ctDNA的非侵入性预测模型,用于识别FL的转变,该模型的灵敏度为83%,特异性为89%,允许更早地检测到转化。在一个案例中,ctDNA模型在临床转变之前就捕捉到了惰性和侵袭性克隆,突显出ctDNA反映肿瘤异质性的能力。同样,Schroers-Martin等的研究使用CAPP-seq对预诊断样本进行分析,发现血液中的CREBBP突变有助于识别有发展为FL风险的患者,表明ctDNA在早期检测和风险分层中可能发挥作用。
在MZL中,通过靶向NGS检测的ctDNA分析显示,在疾病进展时初始ctDNA水平增加,而在实现PR的患者中ctDNA突变负担减少,表明ctDNA有潜力作为治疗反应的标志物。
中枢神经系统淋巴瘤(CNSL)
对脑脊液(CSF)或血浆进行微创的ctDNA分析,对于增强CNSL的诊断、监测和预后具有重大潜力。采用靶向NGS对原发性中枢神经系统淋巴瘤(PCNSL)患者的ctDNA进行的研究表明,检测原发肿瘤组织中存在的突变的灵敏度为45%。然而,对血浆中IgH基因重排进行评估以追踪残留疾病的效果有限,在4名患者中仅检测到1个追踪克隆,这突显了在PCNSL中进行ctDNA监测的挑战。有趣的是,与血浆ctDNA相比,CSF ctDNA的遗传特征与组织的一致性更高,表明CSF是CNSL分析中更可靠的介质。
在此基础上,超灵敏ctDNA分析在CNSL患者治疗前血浆样本中检测到ctDNA的比例为78%,而在所有CSF样本中均检测到ctDNA。治疗前血浆中可检测到ctDNA的患者PFS显著更短(P<0.0001),OS也更短(P=0.0001),基于血浆ctDNA的MRD监测能有效识别高危患者(PFS,P=0.0002;OS,P=0.004)。此外,基于ctDNA突变模式和负荷的无活检CNSL识别模型在CSF中的灵敏度为59%,在血浆中为25%,同时保持100%的特异性和阳性预测值。此外,对于眼内淋巴瘤,来自房水的ctDNA测序与玻璃体液的检测结果高度一致,表明房水ctDNA可能是玻璃体液用于诊断和监测治疗反应的可行、非侵入性替代物。
与这些遗传学分析同期发展的是ctDNA中的表观遗传学生物标志物,这些标志物在多种实体瘤中建立,也在评估用于CNSL。在一项初步研究中,两个甲基化标志物(cg054和SCG3)在区分PCNSL与其他CNS肿瘤方面显示出20%的灵敏度。此外,一个外周残留疾病生物标志物显示出对复发的高预测价值,将其与临床风险因素和放射学反应整合到一个分子预后指数中时可为CNSL的结局提供了强大的预测能力。
除了原发性CNSL外,预测DLBCL患者的CNS复发也仍然存在挑战。在临床诊断前大约一个月,可在CSF ctDNA中检测到MYD88L265P和CD79BY196的突变,表明它们可用于早期检测淋巴瘤患者的CNS复发。然而由于15%到20%的CNSL病例缺乏这些突变,因此对阴性结果应谨慎解读。在一项包括126例新诊断DLBCL和24例PCNSL的队列研究中,使用包含475个白血病和淋巴瘤相关基因的检测panel分析时,治疗前CSF ctDNA在预测CNS复发方面显示出100%的灵敏度和77.3%的特异性。此外,在所有有实质CNS受累的患者的CSF ctDNA样本中,以及36%的侵袭性淋巴瘤患者中,均识别出克隆型DNA,表明CNS复发的风险为29%。
外周T细胞淋巴瘤(PTCL)
ctDNA分析作为一种非侵入性诊断和遗传分析工具,在PTCL中具有广泛的临床应用前景。在AITL患者中,通过检测血浆ctDNA中的TET2、RHOA、DNMT3A和IDH2等基因的突变,可提供一种非侵入性的诊断方法。在ENKTL患者中,血浆ctDNA检测显示出72.4%的敏感度,能够检测到肿瘤活检样本中的变异。此外,对PTCL患者的cfDNA进行CAPP-seq分析,发现了新的RHOA突变,包括c.73 A > G(p.Phe25Leu)和c.48 A > T(p.Cys16*),这些突变也在额外的组织队列中得到验证。这一发现表明,ctDNA测序能够识别肿瘤基因组DNA中未检测到的体细胞突变,克服肿瘤的空间异质性,并提供全面的遗传信息。ctDNA分析的诊断能力,再加上识别新突变的能力,不仅凸显了其在初始诊断中的潜力,也凸显了其在指导后续治疗策略中的作用。
尽管化疗是大多数PTCL亚型的标准一线治疗方案,但治疗耐药性限制了其疗效。非侵入性的ctDNA监测提供了分子负荷、治疗反应、预后风险和MRD的动态评估。在ENKTL患者的ctDNA中检测到的DDX3X和KMT2D突变与较差的PFS相关。对于14例EB病毒(EBV)DNA在全血中无法检测到的患者,有7例患者的ctDNA中发现突变,表明ctDNA分析可以补充EBV DNA定量在ENKTL监测中的应用。对94例PTCL患者的血浆ctDNA突变谱进行靶向NGS分析发现,治疗后的ctDNA水平与生存结局显著相关。此外,使用基于NGS的TCR测序分析ctDNA,在76%的患者中识别出肿瘤特异性克隆;治疗后可检测到ctDNA预示着更差的生存结局,尽管在整个治疗过程中的预后意义并不具有统计学显著性。另一项纳入64例中国PTCL患者的研究发现,治疗前高ctDNA水平与不良临床标志物显著相关,而MRD阴性与更高的缓解率相关。这些数据表明,ctDNA可能具有非侵入性监测PTCL患者治疗反应和预测结局的潜力,新出现的证据也强调了其在高危亚组中的作用。
在高危ENKTL患者中,对肿瘤组织进行靶向NGS以及对血浆ctDNA进行纵向分析表明,治疗前低cfDNA浓度与有利的生存结局相关(1年PFS:90.0% vs 36.4%;p=0.012)。与持续可检测到突变的患者相比,ctDNA突变快速清除的患者实现显著更高的完全缓解率(80.0% vs 0%;p=0.004)和更有利的PFS(79.0% vs 20.0%;p=0.002)。一项评估ctDNA生物标志物的1b/2期研究纳入38例接受抗PD-1抗体治疗的复发/难治性ENKTL患者,发现将血浆ctDNA与EBV DNA结合使用,比单独使用任一生物标志物具有更好的预后价值;值得注意的是,STAT3突变预示着预后较差。这些发现强化了ctDNA动态变化在风险分层和治疗反应评估中的临床效用。然而由于样本量有限,需要更大的队列来验证ctDNA监测对治疗结局的预测价值。
除了肿瘤特异性遗传变异外,ctDNA中的表观遗传改变也已被研究用于ENKTL的诊断和预后目的。一个包含7个ctDNA甲基化标志物的诊断预测模型在独立验证队列中达到0.988的曲线下面积(AUC)。通过将7个标志物的ctDNA甲基化预后评分与PINK风险系统的预后指数相结合,开发了PINK-C风险分层模型,在预测预后方面达到了0.773的AUC。PINK-C模型展示了不同的预后分层水平。然而由于这些模型基于回顾性数据,其特异性和敏感性需要在未来前瞻性研究中进行验证。
霍奇金淋巴瘤(HL)
对于cHL,使用CAPP-seq进行的ctDNA分析显示出巨大的潜力。具体来说,ctDNA分析识别出80例新诊断患者和32例难治性患者的活检样本中存在的约87.5%的肿瘤变异,支持ctDNA作为一种潜在的非侵入性分析工具。值得注意的是,与活检样本相比,血浆ctDNA显示出更高的中位变异等位基因频率,可能反映出cHL活检样本中通常存在的低肿瘤细胞含量。这一观察结果进一步强调了ctDNA在分子分析中的效用。ctDNA检测到的某些突变,包括XPO1E571K、STAT6和SOCS1,有助于区分cHL与其他淋巴瘤类型,如DLBCL、PMBL、ALCL和MGZL。
除了诊断信息外,ctDNA分析还可提供关于cHL克隆结构和进化的有价值信息。一些癌基因和抑癌基因中的突变(如GNA13、XPO1、NFKBIE、IKBKB、CSF2RB和B2M)是克隆性的,存在于大多数细胞中;而其他突变(如PRBM1、NOTCH2、CHD2和BCR)则表现为亚克隆突变。对13例患者的41份样本进行的纵向ctDNA监测显示,化疗可部分重塑亚克隆多样性,而以那武利尤单抗进行的挽救治疗抑制了优势克隆,并促进了新克隆的出现,这突显了ctDNA在治疗过程中追踪克隆变化的效用。
ctDNA分析在cHL中还具有预后意义。例如,通过ddPCR检测到的XPO1E571K突变与较短的PFS相关,突变阳性患者的2年PFS为57.1%,而突变阴性患者为90.5%。同样,ctDNA中的TP53突变与较差的PFS相关(p=0.0038)。治疗前的基线ctDNA水平与临床特征相关,如高总代谢肿瘤体积(TMTV)、高Hasenclever国际预后评分(≥3)、高乳酸脱氢酶(LDH)水平和晚期疾病阶段,表明基线ctDNA可能是传统预后标志物的有价值补充。
此外,ctDNA在监测治疗反应和预测复发方面的作用也在HL中得到证明。纵向ctDNA监测结合PET/CT成像在38%的患者中识别出疾病进展,当ctDNA和PET/CT结果均为阴性时,其阴性预测值为99%,表明ctDNA可能提高PET/CT在临床管理中的预测准确性。此外,在晚期cHL患者中,经过两周期ABVD化疗后,ctDNA水平降低2个对数与CR相关,支持了之前在DLBCL中验证的阈值。
治疗期间ctDNA评估的时机会影响预后准确性。治疗前ctDNA水平高且在整个治疗过程中(例如,在第1周期第15天、第3周期第1天和4个周期后)可检测到ctDNA的患者的PFS显著更差(p<0.05)。分子缓解率在连续时间点(第1周期第15天、第2周期第1天和第3周期第1天)有所提高,MRD阴性率分别达到38%、85%和90%。此外,治疗开始后一周的ctDNA监测结果与PET反应相关,并可预测PFS。在儿童霍奇金淋巴瘤中,靶向NGS显示,在实现早期PET反应(qPET<3)的患者中,ctDNA无法检测可预示良好结局。尽管ctDNA在HL的临床应用中显示出相当大的潜力,但仍需要进一步的前瞻性临床试验来确定MRD状态(可检测或不可检测)是否能够可靠地指导治疗强化或降级的决策。
总结与展望
ctDNA作为一种生物标志物的出现,是淋巴瘤管理方面的一项重大进步,其应用范围涵盖诊断、风险分层、治疗监测以及MRD评估。通过非侵入性采样提供全面的分子见解,ctDNA能够实时追踪疾病负荷、治疗反应以及克隆进化,为淋巴瘤的个性化治疗铺平了道路。ctDNA分析的最新进展(包括ctDNA片段化和甲基化分析)进一步拓展了其在诊断和预后方面的能力,有望改善淋巴瘤的精准医疗。
ctDNA所带来的机遇是巨大的。它促进了非侵入性基因分型,克服了组织活检的局限性,例如空间异质性和样本材料不足。ctDNA定量提供了肿瘤负荷的动态评估,与IPI和TMTV等已确定的预后因素相关。此外,其在MRD检测中的作用在敏感性和特异性方面超越传统成像技术,使得在复发时能够更早地进行干预。当与NGS和表观遗传分析等新兴技术结合时,ctDNA可以完善预后模型并识别治疗靶点。然而在将ctDNA完全整合到常规临床实践之前,还必须克服几个挑战(图5)。标准化预分析工作流程至关重要,因为样本处理和加工的差异可能会影响检测的准确性。此外,尽管ctDNA提供了宝贵的见解,但确定临床决策(如MRD或治疗反应)的最佳阈值还需要在大型前瞻性研究中进行进一步验证。此外,ctDNA数据的复杂性需要强大的计算方法来整合多个分子和临床参数。机器学习的进步可能有助于克服这些挑战,并最终推进ctDNA作为淋巴瘤管理中可靠工具的临床应用。
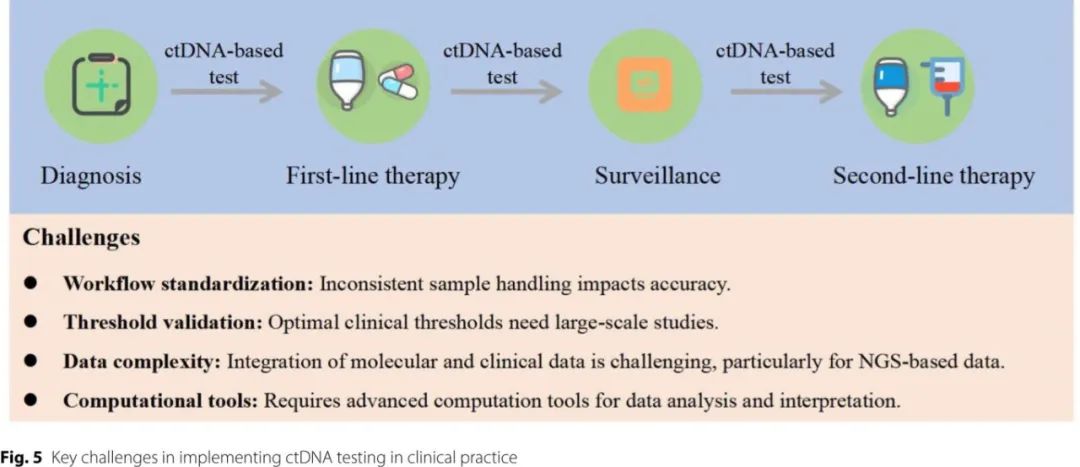
尽管在临床实施方面存在挑战,但越来越多的证据支持ctDNA作为一种动态生物标志物来指导淋巴瘤治疗。将ctDNA检测整合到临床试验设计中,可能通过实现对治疗反应、MRD和克隆进化的早期和准确监测,从而提高治疗的精确性,这可能超越传统的成像和活检方法。例如,未来的侵袭性淋巴瘤(如DLBCL)试验可以纳入早期ctDNA监测,根据患者对一线化疗免疫治疗(如R-CHOP)的分子反应来对患者进行分层。在治疗一到两个周期后ctDNA迅速清除的患者可能适合减少治疗强度,从而在不降低疗效的情况下减少对潜在毒性方案的暴露。相反,持续ctDNA阳性的患者可以被分配到包含新药(如靶向治疗或免疫调节剂)的强化或替代治疗组,以克服早期耐药性。这种适应性方法利用ctDNA的动态变化来指导实时、个性化的治疗决策,最终可能改善PFS和OS。
在惰性淋巴瘤(如FL)中,其病程缓慢但变化多样,且存在显著的克隆异质性,连续的基于ctDNA的检测可以帮助追踪克隆进化以及在靶向治疗(如PI3K抑制剂、免疫调节剂)期间出现的耐药突变。未来的试验可能会在整个治疗和随访过程中定期评估ctDNA特征,从而早期识别与耐药相关的遗传改变。这反过来又可以促使及时更换治疗方法或增加旨在在明显复发之前抑制耐药克隆的联合策略。这种个性化的方法不仅完善了治疗决策,还为推动疾病进展和耐药的分子机制提供了更深入的见解。
参考文献
Fu, L., Zhou, X., Zhang, X. et al. Circulating tumor DNA in lymphoma: technologies and applications. J Hematol Oncol 18, 29 (2025). https://doi.org/10.1186/s13045-025-01673-7

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#淋巴瘤# #基因分型#
6