Nat Commun 中国医学科学院阜外医院汪一波团队联合宋雷课题组揭示体细胞变异在肥厚型心肌病中的作用
2025-04-07 论道心血管 论道心血管
该研究首次揭示体细胞变异在肥厚型心肌病发生发展中的关键驱动作用,通过揭示NAP1L1 p.D349E体细胞变异激活cGAS-STING-IFN信号通路。
肥厚型心肌病是一种以心肌增厚为表现的心肌病,是最常见的遗传性心脏病,约36%~64%的病例是由致病性肌节变异引起的[1]。然而,仍有很多肥厚型心肌病患者经过基因检测未发现致病变异,限制了肥厚型心肌病的遗传学诊断、分子分型和精准治疗。
中国医学科学院阜外医院汪一波教授团队专注于心血管病遗传致病机制研究,系统的将体细胞遗传引入心血管病的机制解析。前期阐明了KRAS/BRAF和MAP3K3/PIK3CA体细胞突变分别是散发性动静脉畸形和海绵状血管畸形的核心遗传致病机制(Brain 2019, Brain 2021, 封面文章)[2, 3],解释了约87%和91%的散发病例,定义了亚型CCM4和CCM5 (OMIM#619538和#621032),并首次绘制了不同突变类型的人类海绵状血管畸形单细胞图谱(Exp Mol Med, 2023)[4],发展了血管畸形的胚系叠加体细胞突变的多重打击理论(Brain, 2024)[5],提出了一种新的局灶性Dio2介导的畸形脑血管适应机制,靶向TH信号可能代表了一种潜在的脑血管疾病治疗方法(Circ Res 2025)[6]。血管疾病的体细胞遗传机制愈发明确,然而心肌病中是否也有类似机制呢?
2025年4月1日,该团队在Nature Communications杂志上发表了题为“Somatic NAP1L1 p.D349E promotes cardiac hypertrophy through cGAS-STING-IFN signaling”的研究论文。该研究首次揭示体细胞变异在肥厚型心肌病发生发展中的关键驱动作用,通过揭示NAP1L1 p.D349E体细胞变异激活cGAS-STING-IFN信号通路,将心血管疾病的遗传研究从传统的胚系变异层面拓展至体细胞变异领域,开创了肥厚型心肌病新的遗传致病模式的研究。

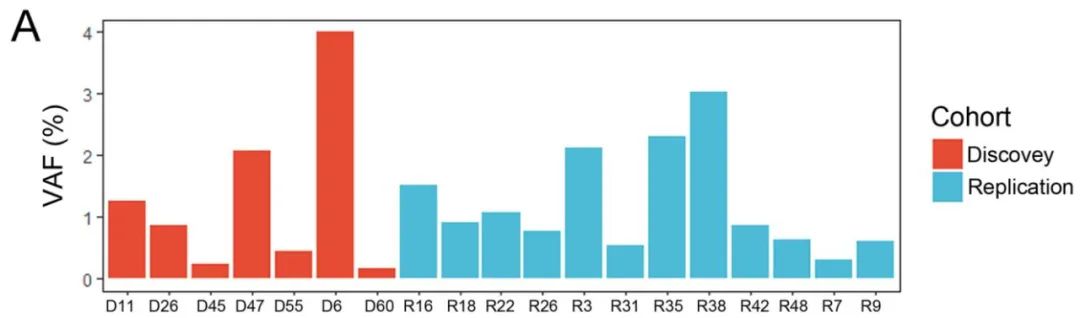
首先,为研究肥厚型心肌病患者肥厚的心肌组织中体细胞变异,研究团队通过全外显子测序和液滴数字PCR技术,在基因未明的散发性肥厚型心肌病患者中发现35%的发现队列和20%的验证队列携带体细胞变异NAP1L1 p.D349E,该变异在正常人群数据库中未被发现,且主要存在于心肌细胞中。临床数据显示,携带该变异的患者纽约心脏协会分级更高,提示其与疾病进展密切相关。
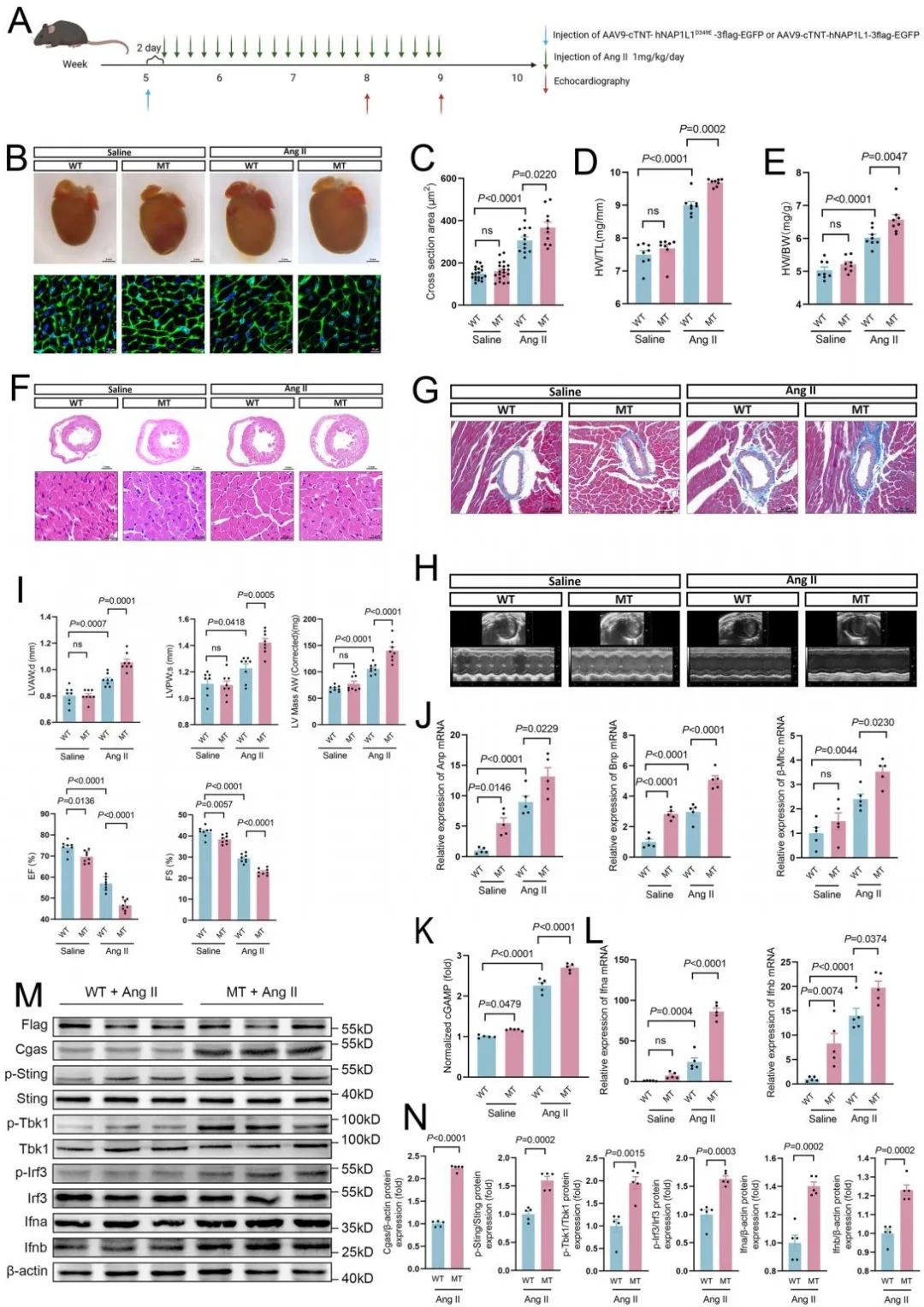
为验证该变异的致病性,研究团队构建了AAV9介导的心肌细胞特异性NAP1L1 p.D349E过表达小鼠模型,发现相比于给予野生型NAP1L1的小鼠,给予D349E突变型NAP1L1的小鼠在血管紧张素刺激下出现显著的心肌肥厚、纤维化及心功能损伤。机制上,心肌组织中cGAMP (cGAS-STING通路的第二信使)水平升高,IFN-α/β表达上调,且STING、TBK1磷酸化增强。此外,突变型干预的小鼠心肌细胞凋亡增加,巨噬细胞浸润显著,进一步验证了炎症微环境对心肌重构的驱动作用。
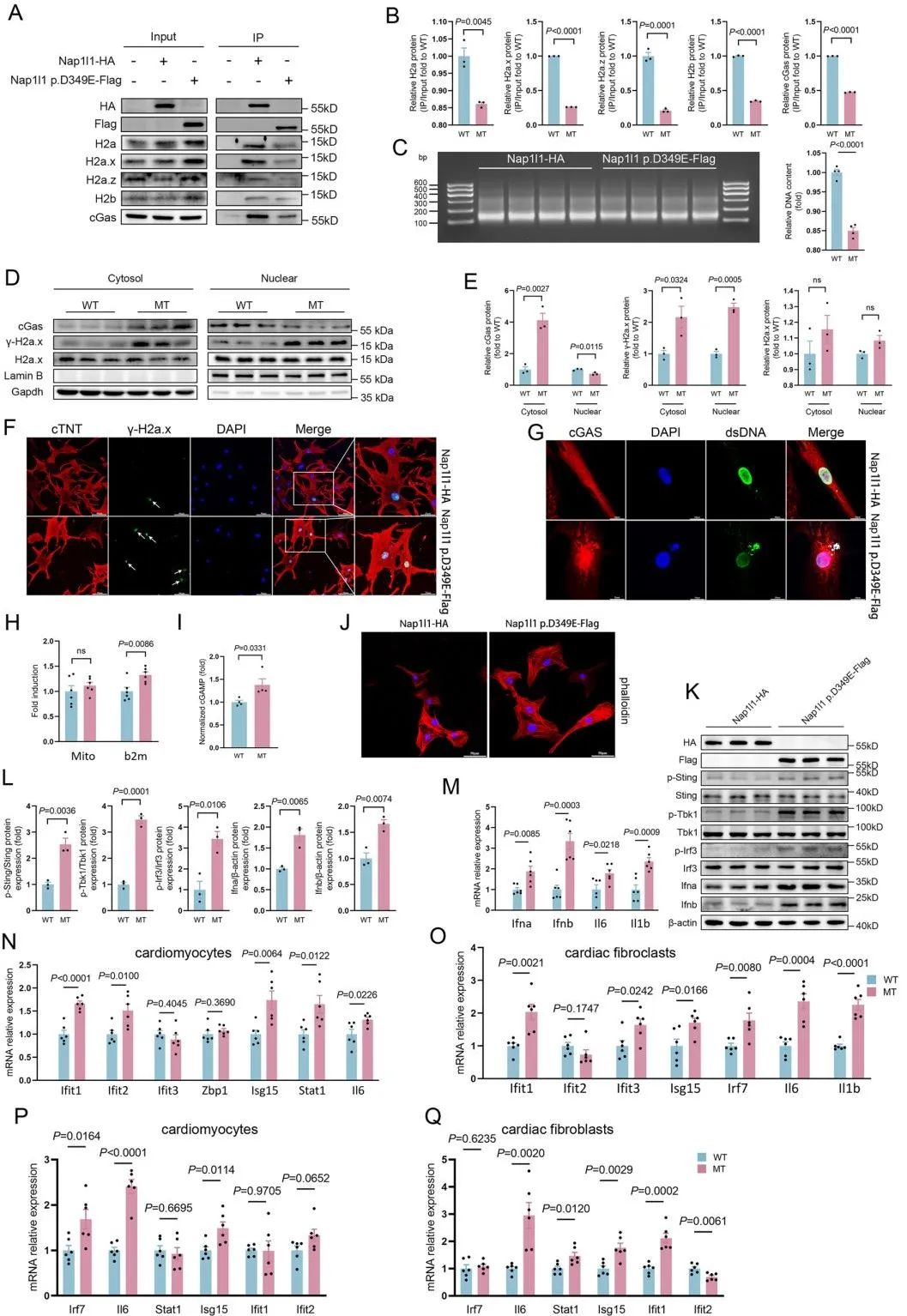
细胞学实验显示,D349E变异通过削弱NAP1L1与组蛋白H2A/H2B的寡聚化作用,导致核小体稳定性下降。MNase实验间接证实突变细胞中完整核小体数量减少。细胞质DNA来源分析表明,细胞质中泄漏的DNA主要为核基因组片段,而非线粒体DNA。进一步研究发现,突变通过激活cGAS-STING通路促进心肌细胞肥大,且旁分泌实验显示突变细胞释放的IFN可诱导邻近细胞ISGs表达,形成“种子效应”。
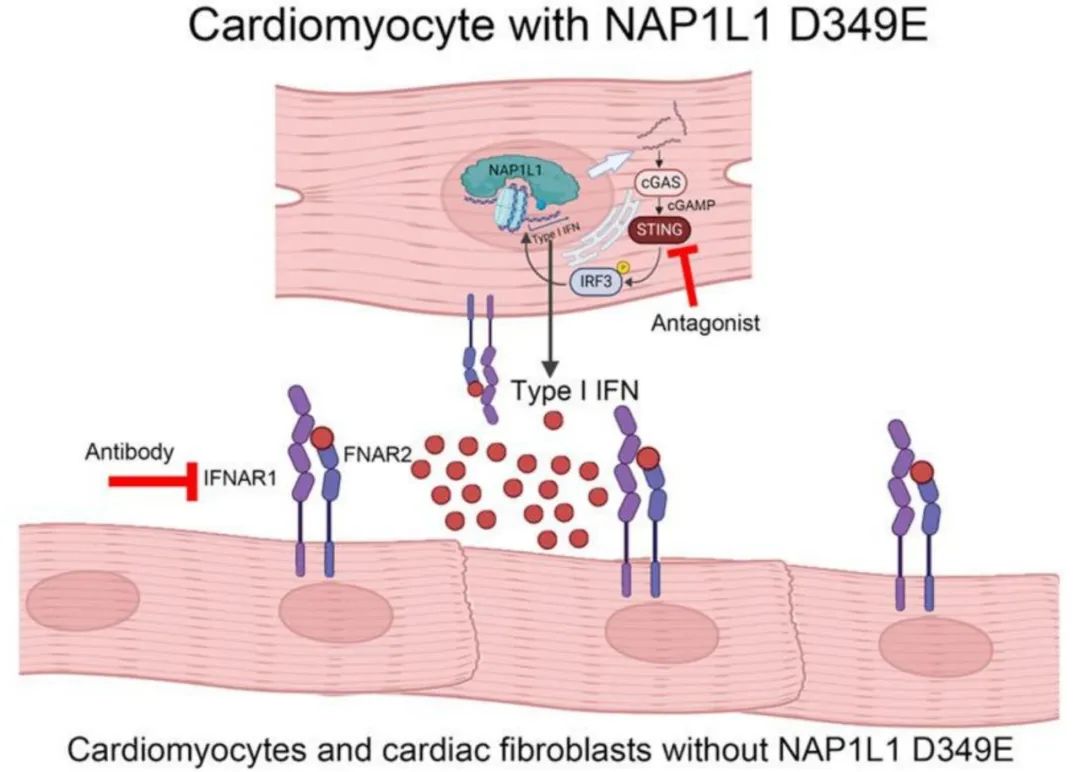
综上,该研究首次揭示了体细胞变异NAP1L1 p.D349E通过破坏核小体组装,进而激活cGAS-STING-IFN通路,从而驱动心肌肥厚的机制。这一发现突破了传统对胚系突变的认知框架,首次将体细胞突变引入心肌病领域,开辟了探索体细胞机制在复杂疾病中作用的新方向。此外,该研究证实了STING通路的靶向干预可有效缓解病理表型,为精准治疗的开发提供了重要的理论依据。
中国医学科学院阜外医院汪一波教授和宋雷教授为该论文通讯作者,博士生吕城、夏依旦·阿力木、肖晓、王菲和王继征研究员为该论文共同第一作者。该研究得到了首都医科大学安贞医院杜杰教授、中国医学科学院基础医学研究所陈厚早教授和西安交大一附院吴岳教授的指导和支持。同时得到了中国医学科学院创新工程、国家自然科学基金、国家重点研发计划和心血管疾病国家重点实验室基础研究基金的支持。
参考文献:
[1] HO C Y, DAY S M, ASHLEY E A, et al. Genotype and Lifetime Burden of Disease in Hypertrophic Cardiomyopathy: Insights from the Sarcomeric Human Cardiomyopathy Registry (SHaRe) [J]. Circulation, 2018, 138(14): 1387-98.
[2] HONG T, YAN Y, LI J, et al. High prevalence of KRAS/BRAF somatic mutations in brain and spinal cord arteriovenous malformations [J]. Brain, 2019, 142(1): 23-34.
[3] HONG T, XIAO X, REN J, et al. Somatic MAP3K3 and PIK3CA mutations in sporadic cerebral and spinal cord cavernous malformations [J]. Brain, 2021, 144(9): 2648-58.
[4] REN J, XIAO X, LI R, et al. Single-cell sequencing reveals that endothelial cells, EndMT cells and mural cells contribute to the pathogenesis of cavernous malformations [J]. Exp Mol Med, 2023, 55(3): 628-42.
[5] LI R, XIAO X, YAN Y, et al. GPRASP1 loss-of-function links to arteriovenous malformations by endothelial activating GPR4 signals [J]. Brain, 2024, 147(4): 1571-86.
[6] LI R, TANG Y, WANG H, et al. Local DIO2 Elevation Is an Adaption in Malformed Cerebrovasculature [J]. Circ Res, 2025.
原文链接:
https://www.nature.com/articles/s41467-025-58453-7

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#肥厚型心肌病# #体细胞变异#
8
仍有很多肥厚型心肌病患者经过基因检测未发现致病变异,限制了肥厚型心肌病的遗传学诊断、分子分型和精准治疗。
8