癌症纤维炎症反应:肿瘤微环境的隐形推手
2025-03-26 小药说药 小药说药 发表于陕西省
肿瘤微环境中的纤维炎症反应在肿瘤发生、转移与耐药中起关键作用。癌细胞通过激活 CAFs、招募免疫细胞等操控纤维炎症;CAFs 具有多种异质性亚型,影响肿瘤发展;纤维炎症通过多种机制抑制肿瘤免疫。
-01-
引言
癌症不仅是遗传变异的结果,其生存环境——肿瘤微环境(TME)的复杂性更是治疗成败的关键。其中,纤维炎症反应(Fibroinflammation)作为TME的核心特征,在肿瘤发生、转移与耐药中扮演着“双刃剑”角色。这一过程由成纤维细胞与先天免疫细胞协同驱动,通过纤维化(ECM重塑)与慢性炎症持续重塑肿瘤生态。理解纤维炎症的作用机制,或将为攻克癌症提供新突破口。
-02-
一、肿瘤细胞如何“操控”纤维炎症?
癌细胞内在致癌和肿瘤抑制途径通过驱动调节TME纤维化和炎症的异常细胞信号传导,产生了一个有利于癌细胞存活、增殖和转移的复杂生态系统。
1. 激活CAFs:肿瘤释放TGF-β、IL-6等因子,刺激邻近的癌症相关成纤维细胞(CAFs)分泌更多胶原蛋白,导致ECM硬化,形成物理屏障限制药物渗透。
2. 招募免疫“叛军”:癌细胞释放CXCL12、VEGF等趋化因子,募集并极化巨噬细胞(TAMs)、中性粒细胞(TANs),使其分泌促炎细胞因子(如IL-1β、IL-10),进一步加剧纤维炎症。
3. “恶性循环”信号轴:CAFs与TAMs通过TGF-β、IL-6等通路相互激活,形成正反馈循环,推动ECM异常沉积与免疫抑制。
-03-
二、CAFs的异质性
成纤维细胞是肿瘤微环境中最重要的细胞类型之一,它们在肿瘤的发生和发展中发挥着多重作用。成纤维细胞的异质性表现在不同的亚型上,每种亚型在肿瘤微环境中扮演着不同的角色。例如,位于肿瘤边缘的肌成纤维CAFs通过分泌LOX蛋白交联胶原,形成致密基质阻碍T细胞浸润;而肿瘤核心的iCAFs则通过IL-6等招募免疫抑制性髓系细胞,营造“冷肿瘤”微环境。
1. 肌成纤维细胞(myCAFs):这些细胞是肿瘤微环境中主要的成纤维细胞亚型,具有高度的增殖能力和产生ECM的能力。CAFs通过产生大量的胶原蛋白和其他ECM成分,促进肿瘤的生长和侵袭。此外,CAFs还能通过分泌多种细胞因子和生长因子,调节肿瘤微环境中的免疫反应。
2.炎症性成纤维细胞(iCAFs):这些细胞主要通过分泌促炎细胞因子,如IL-6和IL-1β,来调节肿瘤微环境中的免疫反应。iCAFs能够招募免疫抑制性细胞,如调节性T细胞(Tregs)和髓源性抑制细胞(MDSCs),从而抑制抗肿瘤免疫反应。
3.抗原呈递成纤维细胞(apCAFs):这些细胞具有一定的抗原呈递能力,能够激活T细胞,但它们在肿瘤微环境中通常被抑制。apCAFs的存在可能表明肿瘤微环境中存在一定的免疫活性,但这种活性往往不足以抑制肿瘤的生长。
4.肿瘤抑制性成纤维细胞:这些细胞具有抑制肿瘤生长的特性,通过产生抗炎细胞因子或抑制ECM的产生来实现。然而,这些细胞在肿瘤微环境中的具体作用仍需进一步研究。
-04-
三、纤维炎症如何“改写”肿瘤免疫状态?
纤维炎症反应与肿瘤免疫状态密切相关。一方面,纤维炎症反应通过产生大量的ECM成分,形成物理屏障,限制免疫细胞的浸润,从而抑制抗肿瘤免疫反应。另一方面,纤维炎症反应还能够通过调节免疫细胞的极化和功能,进一步抑制抗肿瘤免疫反应。纤维炎症通过以下机制将TME推向免疫抑制的深渊:
1. 物理屏障:ECM硬化形成“沙漠化”区域,阻止CD8+ T细胞浸润(免疫排斥型肿瘤)。
2. 生化压制:CAFs分泌CXCL12结合T细胞表面的CXCR4受体,将其“诱捕”在肿瘤外围;TGF-β直接抑制T细胞活性,并诱导调节性T细胞(Treg)扩增。
3. 巨噬细胞极化:CAFs通过IL-34–CCL8轴驱使巨噬细胞向M2型(促修复表型)转化,分泌IL-10、PD-L1等抑制免疫应答。
4. 血管畸形:异常ECM导致血管渗漏,加剧肿瘤缺氧,进而诱导VEGF过度分泌,形成功能失调的血管网络,进一步限制免疫细胞运输。
在胰腺癌等“冷肿瘤”中,纤维炎症主导的ECM信号与基质硬度抑制免疫活性;而“热肿瘤”(如部分黑色素瘤)虽存在T细胞浸润,但因CAFs大量表达PD-L2、FASL等,仍可能导致免疫治疗无效。
-05-
四、攻克纤维炎症的破局之道
CAF在癌症发展过程中发挥的促瘤作用使其成为抗癌治疗的理想靶点。CAF导向的抗癌策略通常可分为靶向CAF的肿瘤促进功能、下游效应器和CAF激活表型的正常化。
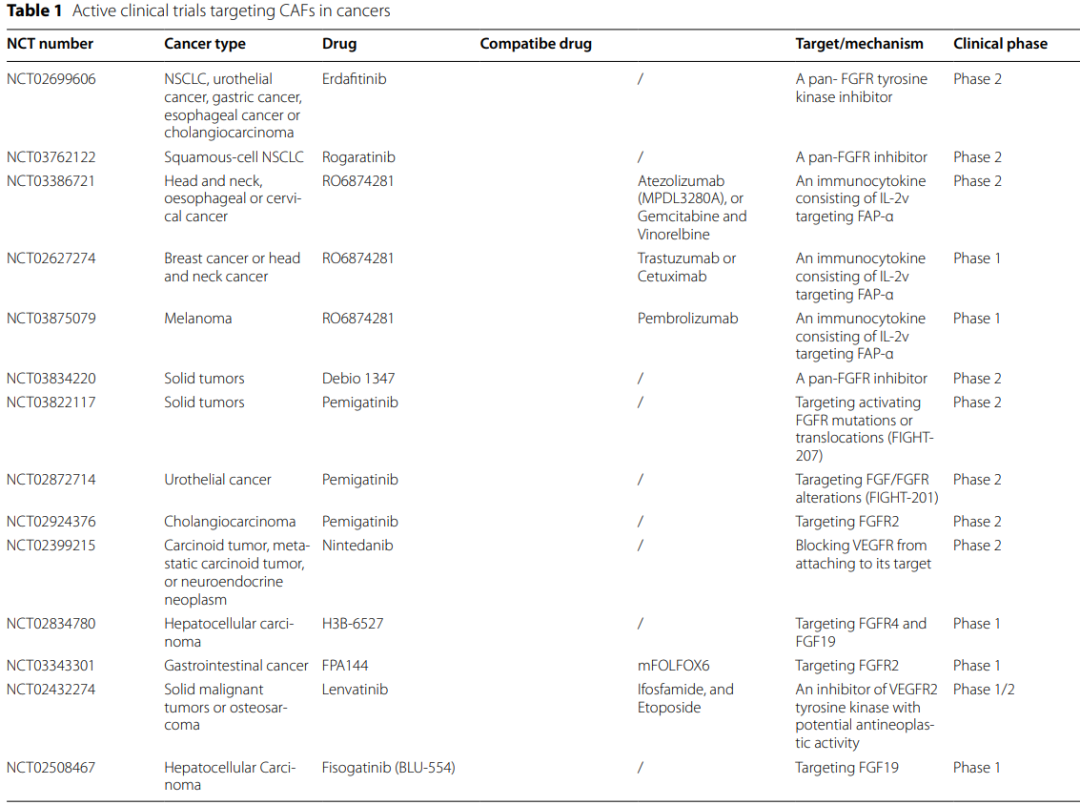
抗CAF治疗主要集中在通过靶向特定表面标记物去除CAF,例如成纤维细胞活化蛋白(FAP)。以FAP+CAF为目标的DNA疫苗增加了CD8+和CD4+T细胞在肿瘤内的浸润。进一步的策略,如FAP-CAR-T细胞治疗和FAP靶向溶瘤腺病毒促进针对FAP+CAF的特异性免疫攻击,上调促炎细胞因子,增加抗原呈递、T细胞功能以及转运,从而增强抗肿瘤疗效。
Simlukafusp alfa(FAP-IL2v,RO6874281/RG7461)是一种免疫细胞因子,包含针对FAP的抗体和对IL-2Rβγ具有偏向性亲和力的IL-2变体。它被证明是一种有效的免疫细胞因子,在体外和体内增强了基于T细胞和NK细胞的不同癌症免疫疗法的疗效。
另一种策略是靶向CAF的下游效应器和/或信号通路,包括CAF衍生的细胞因子和趋化因子。例如,针对IL-6、IL-6R和IL-6下游JAK/STAT3信号通路的药物已被FDA批准用于骨髓增生性疾病和自身免疫性疾病,以抑制FAP+CAF诱导促炎细胞因子和促血管生成因子,它们增加癌细胞增殖和转移,并负性调节T细胞和NK细胞毒性活性。
除IL-6外,靶向TGF-β信号的治疗剂还可以干扰CAF的激活或减少CAF的数量,从而抑制肿瘤生长并具有抗肿瘤作用。Galunisertib是一种TGF-βRI激酶抑制剂,可特异性下调SMAD2的磷酸化,从而消除经典途径的激活。其已经对胶质母细胞瘤、肝细胞癌和胰腺癌患者进行了研究。
此外,靶向CAF还可以将促肿瘤性CAF的激活状态恢复为相对静止状态或肿瘤抑制表型。维生素D治疗可诱导基质重编程,使CAF活化表型正常化,抑制炎症和纤维化,提高化疗药物的摄取和胰腺星状细胞的存活率。
-06-
结语
纤维炎症反应如同一张交织的网,连接着肿瘤进展、免疫逃逸与治疗耐药。随着对CAFs异质性和动态互作的深入理解,靶向纤维炎症的策略正从“粗放型”走向“精准化”。未来,结合多组学技术、新型药物递送系统和跨学科合作,我们有望将“促癌微环境”转化为“治疗突破口”,让更多患者受益于这场癌症治疗的变革。
参考资料:
1.Cancer-associated fibroblasts andresistance to anticancer therapies: status, mechanisms, and countermeasures. CancerCell Int. 2022; 22: 166.
2. The fibroinflammatory response in cancer. Nat Rev Cancer.2025 Mar 17.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#肿瘤微环境# #纤维炎症反应#
6