香港理工大学邢本刚讲席教授《Angew》:酶激活正交蛋白水解嵌合体用于肿瘤微环境响应性免疫调节
2025-02-28 BioMed科技 BioMed科技 发表于陕西省
香港理工大学邢本刚团队设计酶激活的可点击 PROTACs,可原位合成降解 BRD4,下调 PD-L1,提升肿瘤渗透性和治疗效果,为肿瘤治疗提供新途径。
肿瘤微环境(TME)的复杂性是影响免疫治疗效果的关键因素,近年来,蛋白水解靶向嵌合体(PROTACs) 作为一种新兴的蛋白降解策略,在精准肿瘤治疗领域展现出巨大潜力。然而,如何实现肿瘤特异性降解,并克服传统PROTAC分子量大、细胞渗透性差的局限性仍然是一大挑战。针对这一问题,香港理工大学邢本刚讲席教授团队提出了一种酶激活的可点击PROTACs,可在肿瘤微环境中特异性触发,精准降解肿瘤相关表观遗传蛋白BRD4,并有效重塑肿瘤免疫微环境。相关研究成果以“Enzyme-Activated Orthogonal Proteolysis Chimeras for Tumor Microenvironment-Responsive Immunomodulation”为题,发表在Angewandte Chemie International Edition上。

在本研究中,研究人员设计了一种高效可靠的酶响应型可点击PROTAC,其中短肽标记的pomalidomide衍生物可被肿瘤中过表达的Cathepsin B组织蛋白酶裂解,释放出活性巯基,进而与修饰了2-氰基苯并噻唑(CBT)的JQ1发生肿瘤选择性的体内点击反应,最终形成可降解BRD4的具有异质结构双功能的PROTAC分子。这种新的技术实现了PROTAC的体内原位合成,避免了传统PROTAC需要预先合成大分子降解剂的繁琐过程,并且大大提高了生物利用度和组织渗透性。
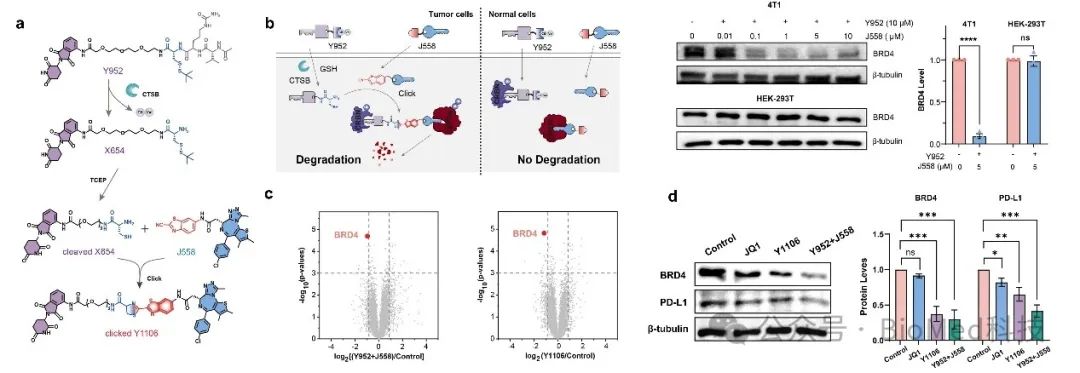
图1. 酶响应型可点击PROTAC在肿瘤细胞中选择性降解BRD4并下调PD-L1表达
此外,该研究通过蛋白定量分析,系统验证了该可点击PROTAC的选择性降解能力,只针对肿瘤细胞内的目标蛋白进行特异性的调控,并且选择性的对肿瘤细胞有着显著的杀伤能力。同时更进一步的蛋白组学研究结果表明,该策略不仅能高效降解肿瘤中的BRD4,还能有效下调下游免疫检查点蛋白PD-L1的表达,从而实现免疫检查点的阻断并增强肿瘤免疫应答。更重要的是,与传统高分子量PROTAC相比,在3D细胞球模拟实验中表明可点击的PROTAC分子碎片展示出更优异的肿瘤渗透性,对深层组织的蛋白降解有着显著的增强效果,进一步提升了体内抗肿瘤治疗效果。
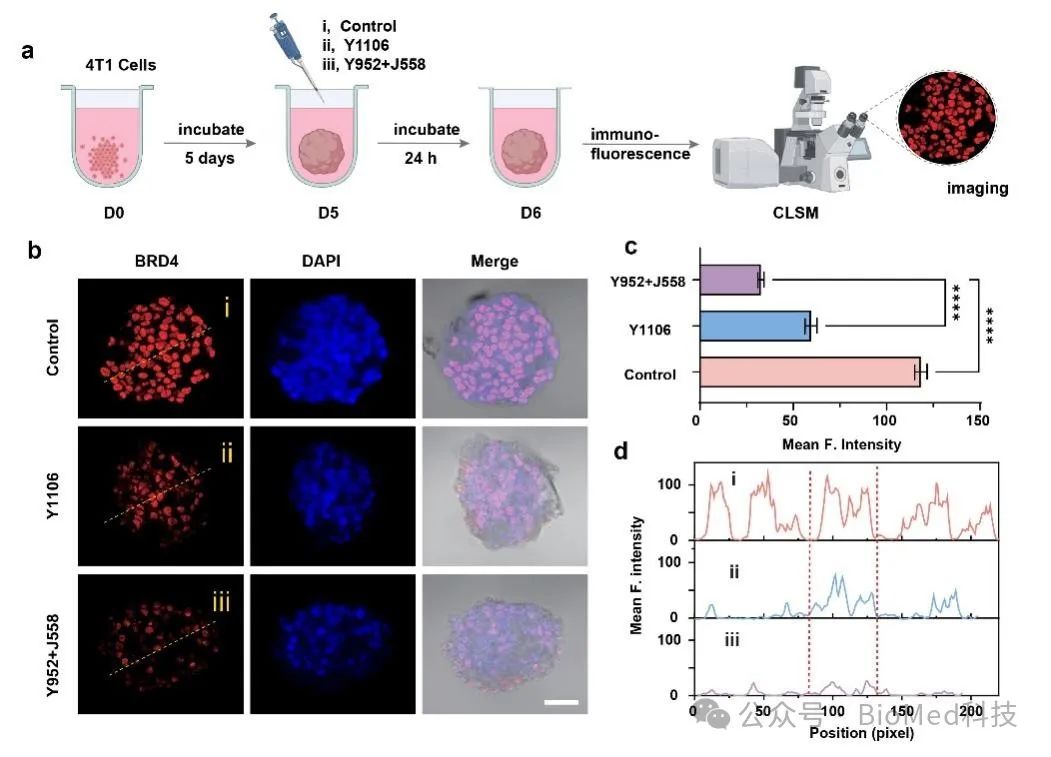
图2 酶响应型可点击PROTAC碎片在3D细胞球模型中展现出更出色的渗透能力
在小鼠体内实验中,该可点击PROTAC能够特异性降解肿瘤组织中的BRD4,并显著降低PD-L1的表达,促进CD8+T细胞浸润,从而增强抗肿瘤免疫效应。此外,与传统BRD4抑制剂(如JQ1)或标准结构的蛋白降解剂(如Y1106)相比,该酶激活可点击PROTAC在抑制肿瘤生长方面表现出更高的疗效。
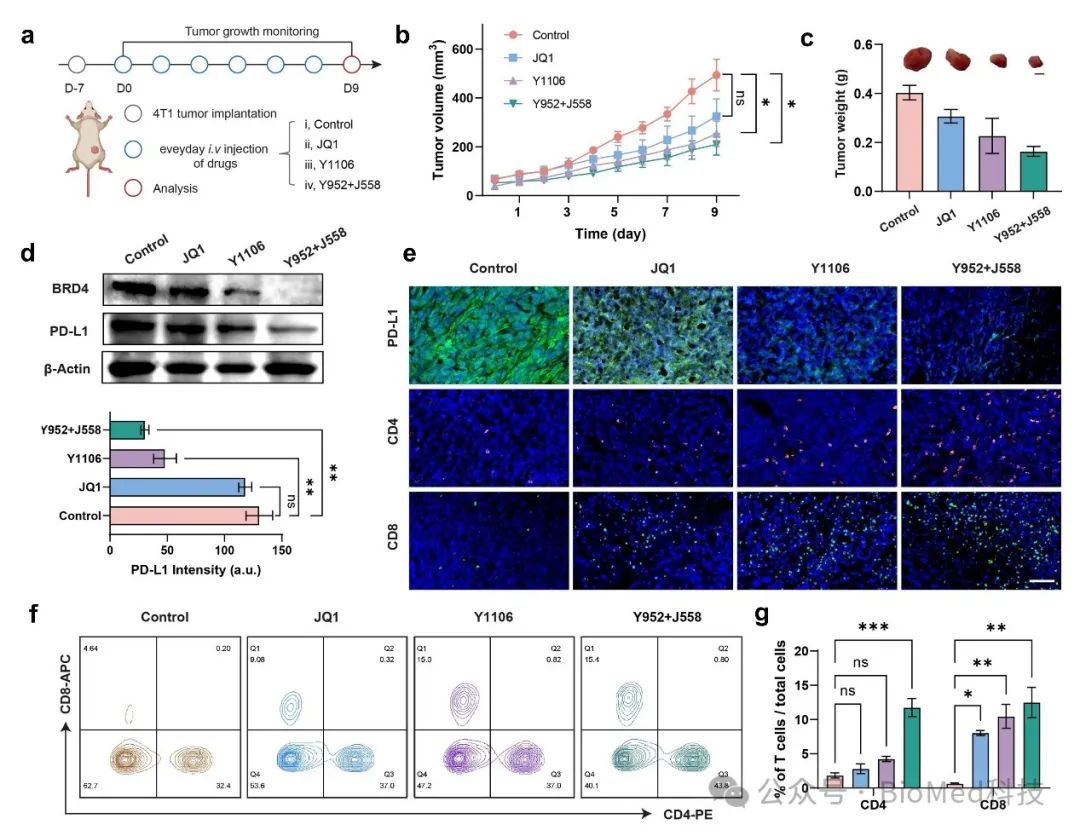
图3 酶响应型可点击PROTAC在小鼠肿瘤模型中表现出明显的肿瘤生长抑制和激活活体内的抗肿瘤免疫活性
本研究强调了一种基于酶响应点击化学的精准肿瘤降解策略,通过肿瘤特异性激活可点击片段,实现靶向蛋白降解和免疫微环境重塑,为未来肿瘤治疗提供了一种高效、精准的新途径。
现任香港理工大学,应用生物与化学科技学系邢本刚讲席教授为该论文的通讯作者。本研究受到香港理工大学Global STEM Professorship and start-up fund,新加坡南洋理工大学A*Star, MOE Tier 1等项目资助。
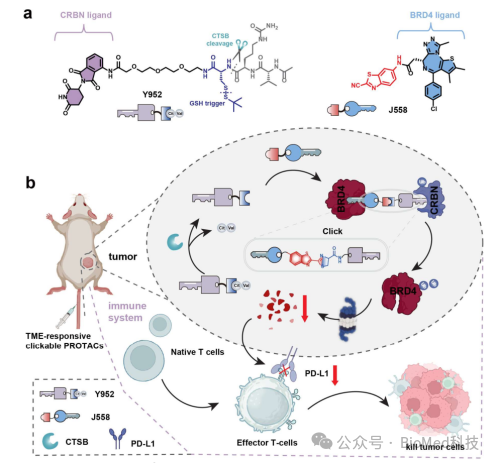
图4 酶激活正交蛋白水解嵌合体重塑肿瘤微环境以增强免疫治疗示意图
原文链接:

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#免疫治疗# #肿瘤微环境#
11