Dev Cell:厦门大学尤涵等揭示乳酸代谢重编程驱动LSD1乳酰化作为黑色素瘤靶向耐药的表观遗传机制
2025-03-27 iNature iNature 发表于陕西省
该研究揭示了乳酸代谢重编程驱动LSD1乳酰化作为黑色素瘤靶向耐药的表观遗传机制。
用BRAF抑制剂(BRAFi)和MEK抑制剂(MEKi)治疗的BRAFV600E突变黑色素瘤几乎总是产生耐药性,并伴有葡萄糖代谢的恢复。恢复糖酵解如何控制获得性耐药仍然未知。
2025年3月24日,厦门大学尤涵、空军军医大学叶菁共同通讯在Developmental Cell在线发表题为“ALactylation of LSD1 is an acquired epigenetic vulnerability of BRAFi/MEKi-resistant melanoma”的研究论文,该研究揭示了乳酸代谢重编程驱动LSD1乳酰化作为黑色素瘤靶向耐药的表观遗传机制。
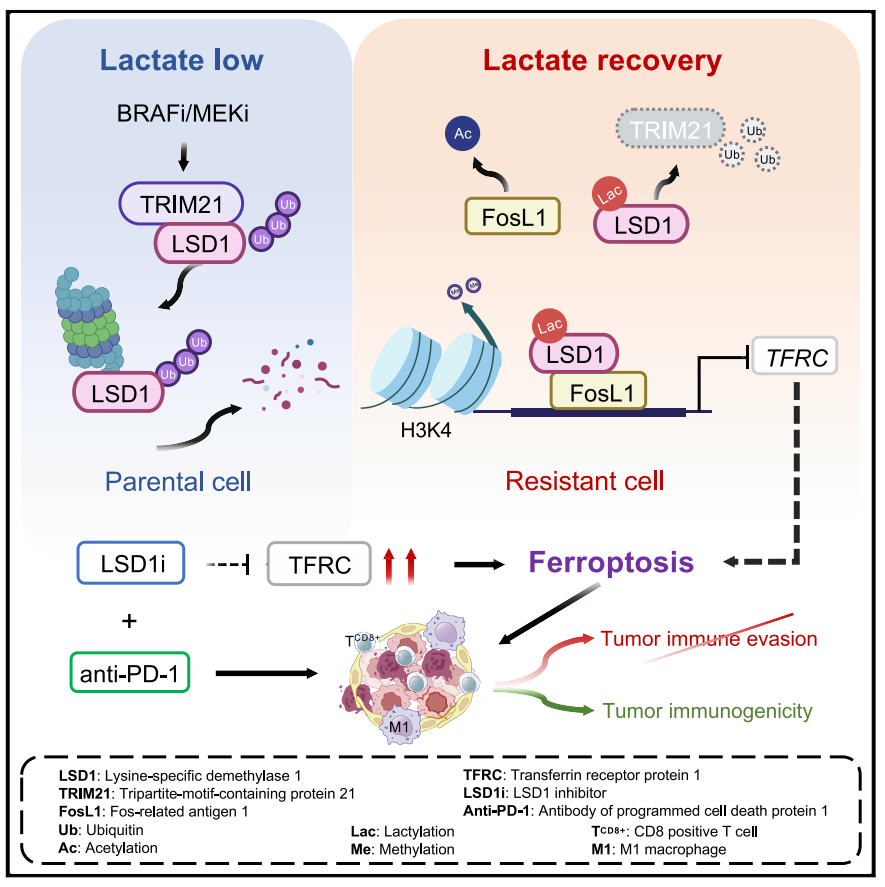
该研究发现在人类和鼠BRAFi/MEKi耐药黑色素瘤细胞中,由再积累乳酸诱导的赖氨酸特异性去甲基化酶1 (LSD1)乳酸化通过表观遗传重编程选择性地驱动存活。从机理上讲,LSD1的乳酸化促进了其与Fos相关抗原1 (FosL1)的相互作用,防止其被E3连接酶含三基序的蛋白21 (TRIM21)降解,并选择性地增强其基因组富集。进一步证明,乳酸化的LSD1与FosL1共同指导基因转录,通过干扰转铁蛋白受体蛋白1 (TFRC)介导的铁摄取来抑制铁死亡。当与免疫疗法结合时,LSD1抑制激活眼睑下垂,导致抗药性鼠黑色素瘤的急剧退化。该研究结果强调了在BRAFi/MEKi耐药的黑色素瘤中,代谢重新布线诱导的表观遗传重编程作为旁路耐药机制的重要作用,提供了一种治疗上可行的策略来克服对靶向治疗和免疫治疗的耐药性。

在B-Raf原癌基因,丝氨酸/苏氨酸激酶(BRAFi突变黑色素瘤中,对BRAFi丝裂原活化蛋白激酶激酶7 (MEK)抑制的获得性耐药性在中位时间9-11个月后临床出现。通常由于大鼠肉瘤(Ras)/BRAF/MEK/丝裂原活化蛋白激酶1 (ERK)通路中基因的遗传改变而导致的通路再激活,代表了迄今为止所描述的最常见的耐药性趋同。同时,新出现的证据表明“通路旁路”机制作用于更下游的肿瘤输出。遗憾的是,驱动黑色素瘤细胞对BRAFi/MEKi治疗的非突变适应的“旁路信号”机制仍然知之甚少。
研究表明,BRAFi的急性给药通过转录因子网络抑制糖酵解,这些转录因子对BRAFV600E黑色素瘤中的完整BRAFi反应至关重要。有趣的是,糖酵解随着BRAFi耐药性的发展而恢复。最近的研究揭示了乳酸的关键作用,通过调节组蛋白赖氨酸残基的乳酸化,乳酸作为表观遗传代谢物在各种病理生理条件下发挥作用。由于BRAFi耐药性黑色素瘤细胞中乳酸的重新积累而导致的表观遗传后果仍然未知。
机理模式图(图源自Developmental Cell)
在真核细胞的细胞质中,铁被还原为亚铁(Fe2+)并主要进入线粒体。细胞内铁的耗竭可能会损害关键的铁依赖通路,导致线粒体功能障碍和氧化应激的途径,而其过量可能引发铁依赖的细胞死亡途径,如铁死亡。转铁蛋白受体蛋白1 (TFRC)增加铁的摄取,TFRC对铁死亡的刺激作用已经得到证实。有新的证据表明铁死亡有助于免疫疗法的抗肿瘤功效。有趣的是,在对靶向治疗有耐药性的黑色素瘤中发现了对免疫疗法的交叉耐药性。如果BRAFi/2000研究调节难治性黑色素瘤中铁稳态的信号通路可能会导致增加铁死亡并最终克服交叉耐药性的靶向策略的发展。
该研究对药物敏感和耐药黑色素瘤细胞进行了定量蛋白质组学分析,发现赖氨酸特异性去甲基化酶1 (LSD1)是获得性BRAFi (dabrafenib)/MEKi(曲马替尼)耐药(以下称为DTR)黑色素瘤的致命弱点。研究证明DTR黑色素瘤细胞中糖酵解的恢复触发了LSD1的乳酸化,通过与Fos相关抗原1 (FosL1)形成复合物导致表观基因组和转录组的改变。这种LSD1乳酸化依赖复合物协同指导基因转录,使DTR细胞能够通过消除TFRC依赖性铁死亡而存活。相反,LSD1抑制促进肿瘤内铁死亡,从而增强肿瘤免疫原性并重塑免疫抑制微环境,从而使DTR细胞对抗程序性死亡1 (PD-1)治疗敏感。总之,该研究提供了LSD1i和抗PD-1联合给药用于治疗黑色素瘤获得性对BRAFi/MEKi耐药的合理组合的机制性见解,通过产生会聚于铁死亡激活的正反馈信号。
参考信息:
https://www.cell.com/developmental-cell/fulltext/S1534-5807(25)00121-2

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















题目写错了
3
#黑色素瘤# #LSD1乳酰化#
8