Immunity:MEF2C通过抑制激酶CDK2来限制小胶质细胞的过度活化
2025-03-29 MedSci原创 MedSci原创 发表于陕西省
本研究揭示了转录因子 MEF2C 通过调控特定通路限制小胶质细胞过度活化,维持神经免疫稳态。对 MEF2C 作为免疫检查点在小胶质细胞中作用机制的理解。
小胶质细胞的过度活化与多种神经系统疾病密切相关。在正常生理状态下,小胶质细胞通过不断伸展和回缩其突起,监测 CNS 的组织损伤和感染情况,并通过突触修剪调节突触功能。然而,当受到急性或慢性刺激(如脂多糖 LPS 和神经元损伤)时,小胶质细胞会被过度激活,产生大量有害因子,如促炎细胞因子和活性氧,导致神经炎症。此外,过度活化的小胶质细胞还会过度修剪突触,增加细胞迁移,最终引发和加速神经元损伤,加重神经退行性疾病的发展。
目前,已发现一些内在的免疫检查点可以限制小胶质细胞的过度活化,但对这些保护机制的了解仍不充分,有效的治疗方法也有待探索。MEF2C 是 MADS 盒转录增强因子 2(MEF2)家族的一员,在小胶质细胞中高度表达。研究表明,MEF2C 在控制小胶质细胞对促炎刺激的活化中起着免疫检查点的作用。此外,全基因组关联研究(GWAS)已将 MEF2C 与多种神经系统疾病(如 ASD、精神分裂症和 AD)联系起来,且 MEF2C 的功能缺失突变与 MEF2C 半合子缺乏综合征(MCHS)相关,这是一种罕见的 ASD 形式。因此,研究 MEF2C 缺陷的小胶质细胞有助于揭示 MEF2C 在调节小胶质细胞活化和保护神经系统疾病中的关键作用,并为开发治疗药物提供理论基础。
近日,国际权威期刊Immunity上在线发表了题为“The transcription factor MEF2C restrains microglial overactivation by inhibiting kinase CDK2”的最新研究成果,该研究揭示了转录因子 MEF2C 通过调控特定通路限制小胶质细胞过度活化,维持神经免疫稳态。这一发现不仅深化了对 MEF2C 作为免疫检查点在小胶质细胞中作用机制的理解,还为开发治疗小胶质细胞过度活化相关神经系统疾病的新策略提供了理论依据。

研究者利用 CRISPR-Cas9 技术在人类多能干细胞(hPSCs)中敲除了 MEF2C 基因,生成了 MEF2C 缺陷的 hPSCs。通过分化这些细胞为诱导型小胶质样细胞(iMGLs),发现 MEF2C 缺陷的 iMGLs 在受到 LPS 刺激后表现出过度活化的表型,包括一系列促炎标志物(如 IL-1a、IL-1b、IL-6、TNF-a、CCL2、CXCL10、MitoROS、CD80、CD86 和 MHC II 类)的表达显著升高,且这种升高并非由于细胞数量差异所致。RNA 测序分析显示,与野生型(WT)细胞相比,LPS 刺激的 MEF2C 缺陷 iMGLs 中有 869 个基因上调,且这些基因主要富集于炎症和免疫反应相关通路。此外,这些细胞在迁移、吞噬突触小体和神经毒性等方面的能力也显著增强。
以 MitoROS 作为小胶质细胞活化水平的标志物,研究者进行了高通量筛选,从 2404 种化合物中筛选出 8 种能够降低 LPS 处理的 MEF2C 缺陷 iMGLs 中 MitoROS 水平的化合物。其中,BMS265246(一种 CDK2 抑制剂)能够特异性地降低一系列促炎标志物的表达,将 MEF2C 缺陷 iMGLs 的促炎活性恢复至与 WT 细胞相当的水平。RNA 测序分析表明,BMS265246 处理可使 2121 个基因表达下调,且这些基因主要与促炎反应、免疫和小胶质细胞活化相关通路有关。
BMS265246 是一种 ATP 竞争性 CDK1 和 CDK2 抑制剂。研究者进一步验证了其他 CDK1 和 CDK2 抑制剂在 LPS 刺激下对 MEF2C 缺陷 iMGLs 过度活化的抑制作用,并通过敲低 CDK1 或 CDK2 发现,只有敲低 CDK2 能够模拟 BMS265246 对 IL-1b、IL-6 和 TNF-a 表达的抑制作用。此外,研究发现 LPS 刺激可显著降低 MEF2C 缺陷 iMGLs 中 RB 蛋白水平,而这种降低可被 BMS265246 或蛋白酶体抑制剂 MG132 阻断。进一步分析表明,BMS265246 处理可抑制 RB 的磷酸化和泛素化,从而阻止其降解。
研究发现,LPS 刺激可诱导 WT 和 MEF2C 缺陷 iMGLs 中 p65 的核转位,但在 MEF2C 缺陷细胞中这种转位更为显著。BMS265246 处理或 RB 过表达可显著减弱这种增强的核转位。此外,敲低 RELA(编码 p65 的基因)可显著降低 MEF2C 缺陷 iMGLs 中促炎细胞因子的表达,与 BMS265246 处理或 RB 过表达的效果相似。这些结果表明,抑制 CDK2 活化或阻止 RB 降解可阻断 p65 核转位,从而限制 LPS 刺激下 MEF2C 缺陷 iMGLs 的过度活化。
研究者发现,MEF2C 可能通过其转录因子功能影响 CDK2 活化。通过计算预测,MEF2C 在 CDKN1A(编码 p21,CDK2 的生理抑制剂)基因启动子区域存在多个结合位点。实验结果显示,LPS 刺激可增强 MEF2C 与这些位点的结合,进而促进 p21 的表达。在 MEF2C 缺陷 iMGLs 中,p21 的表达显著降低,且敲低 CDKN1A 可增强 p65 核转位和促炎细胞因子的表达,而 BMS265246 处理可阻断这种效应。相反,过表达 CDKN1A 可有效防止 LPS 刺激下 MEF2C 缺陷 iMGLs 中 p65 核转位和促炎细胞因子的表达增加。因此,MEF2C 通过转录上调 CDKN1A 来抑制 CDK2 活化,从而限制小胶质细胞的过度活化。
为了进一步验证 BMS265246 的治疗潜力,研究者在 Mef2c+/– 小鼠(一种 MCHS 小鼠模型)中进行了体内实验。结果显示,BMS265246 处理可显著降低小胶质细胞的过度活化,减少神经元凋亡和突触小体的吞噬,改善小鼠的社交行为缺陷和空间学习记忆障碍,且未引起明显的体重下降和中性粒细胞减少等副作用。此外,在小胶质细胞特异性 Mef2c 缺陷小鼠中也观察到了类似的效果,进一步证实了 BMS265246 的治疗作用主要通过抑制小胶质细胞的过度活化来实现。
综上所述,本研究通过深入探讨 MEF2C 在小胶质细胞活化中的作用机制,揭示了其通过调节 p21-CDK2-RB-NFkB 通路来限制小胶质细胞过度活化的新机制,并验证了 CDK2 抑制剂 BMS265246 在治疗小胶质细胞相关神经系统疾病中的潜力。这些发现为开发针对小胶质细胞过度活化的治疗策略提供了新的方向,有望为 ASD、AD 等神经退行性疾病的治疗带来新的突破。
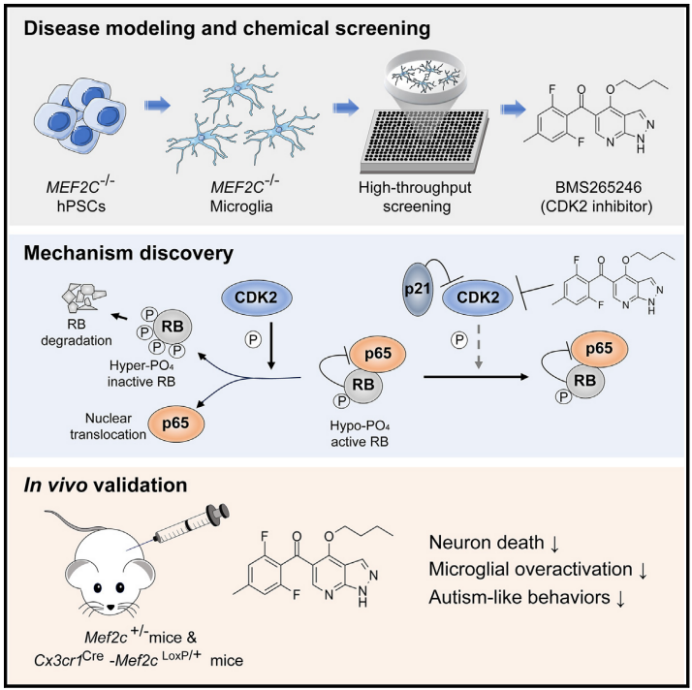
图 研究模式图
原始出处:
The transcription factor MEF2C restrains microglial overactivation by inhibiting kinase CDK2. Immunity. 2025 Mar 21:S1074-7613(25)00093-7. doi: 10.1016/j.immuni.2025.02.026. Epub ahead of print. PMID: 40139186.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#小胶质细胞# #MEF2C# #神经免疫稳态#
10