【AJH】TP53突变髓系肿瘤的诊断、风险分层和治疗(2024更新)
昨天 聊聊血液 聊聊血液 发表于陕西省
TP53 突变在髓系肿瘤中常见,与不良预后相关。其发病与多种因素有关,诊断上 WHO 和 ICC 有差异,治疗效果不佳,未来需明确转化因素、完善标准、开发有效疗法。
TP53突变髓系肿瘤
抑癌基因 TP53 的改变在人类癌症中较为常见,并且与疾病侵袭性有关。在骨髓增生异常综合征(MDS)和急性髓系白血病(AML)中,约有 8%–12% 的患者携带 TP53 突变。这些患者由于存在固有的化疗耐药性和较差的预后,治疗难度极大。此外TP53突变更常见于老年患者以及继发性或治疗相关性髓系肿瘤(MN)患者中。随着人口老龄化和肿瘤幸存者比例的增加,其发病率预计将进一步上升。
用于其他髓系肿瘤的治疗方法(如强化疗、去甲基化药物以及 BCL-2 抑制剂维奈克拉)并未显著改善TP53突变MN 患者的生存率。此外,许多有前景的药物的进一步研发已被终止,从而凸显了治疗该疾病的挑战性。由于这些问题,TP53突变MN 被第五版WHO和国际共识分类(ICC)认定为独立疾病。然而这两种分类系统之间存在关键差异,可能导致对预后风险的低估或高估。
TP53突变MN的发展来自年龄、遗传易感性和抗肿瘤治疗的共同影响,其前驱TP53突变克隆可以在白血病转化前数年被检测到,从而为早期干预提供了可能性。
《American Journal of Hematology》近日发表综述,回顾了 TP53突变MN在生物学、诊断和治疗方面的最新进展,讨论了 TP53突变MN 的已知前驱疾病——克隆性造血(CH)和意义未明的克隆性血细胞减少症(CCUS),以及与白血病转化相关的因素,讨论了WHO和ICC分类系统及其差异对及时和有效管理的影响,也回顾了当前治疗的现状及其局限性。全文两万字,建议点赞收藏。

1 引言
抑癌基因TP53被称为“基因组的守护者”,其改变是人类癌症中最常见的异常情况,并且通常与不良预后相关。在MN中,TP53 改变相对较少见,占骨髓增生异常综合征(MDS)的 8%–10% 和急性髓系白血病(AML)的 10%–12%。尽管如此,TP53 突变髓系肿瘤仍然是一个令人困扰的难题,原因主要有以下几点:首先,这是一种极具侵袭性的白血病,中位生存期不足 1 年。其次,其他MN治疗领域的快速进步未能转化为该亚群生存率的提高。由于其固有的化疗耐药性,针对TP53突变MN的有效治疗方法仍疗效不佳。常用的治疗方法,包括强化疗或去甲基化药物(HMA),几乎没有任何益处。尽管 BH3 模拟物维奈克拉选择性靶向 BCL-2 对其他类型的 AML 产生了革命性的影响,但在TP53突变MN中并未显著改善生存。此外,由于缺乏疗效,许多针对TP53突变 MN 的新药研发已被终止。最后,TP53 突变在老年患者以及继发性和治疗相关性髓系肿瘤(t-MN)患者中高度富集。因此,随着人口老龄化和抗癌治疗的成功,TP53突变MN的发病率预计会上升。总体而言,改善TP53突变MN的预后仍是最亟待解决的挑战之一。
由于广泛认识到这些挑战,WHO第五版(WHO-5)和ICC将携带 TP53 突变的MN认定为独立疾病。这一独立分类的既定目标包括更广泛地认识到其极差的预后,鼓励开展相关研究,并促进临床试验设计,最终推动药物发现。然而,由于两指南之间存在关键差异,广泛采用仍面临挑战。
1.1 TP53的生物学
由位于17号染色体17p13 区域的 TP53 基因编码的肿瘤蛋白 p53 是一种 53千道尔顿的蛋白质,最初在病毒转化的细胞中被发现,并归类为癌基因。然而后续研究证实,野生型 p53 具有抑癌功能,能够抑制细胞生长和癌变。
TP53 属于一个进化上高度保守的转录因子家族,包括TP53、TP63 和TP73。野生型 p53 蛋白由 393个氨基酸组成,包含多个功能域:两个位于N端的转录激活域、一个保守的富含脯氨酸的区域、一个中央的DNA结合域(DBD),以及一个C端,该C端编码其核定位信号和转录活性所需的寡聚化域。
1.1.1 p53:多种细胞过程的主要调节因子
p53参与广泛的生物学过程,包括细胞周期阻滞、衰老、凋亡、自噬、代谢和衰老,其在维持基因组稳定性方面也起着关键作用,通过在基因组应激期间平衡细胞生长和细胞阻滞来发挥作用。在正常情况下,细胞中 p53 的水平通常很低,其短半衰期由翻译后修饰调控,包括泛素化、乙酰化和磷酸化。在非应激条件下,p53 可被小鼠double minute-2 homolog(MDM2)介导的泛素化修饰,导致其通过蛋白酶体途径降解。多种细胞应激因素(包括癌基因激活、缺氧或DNA损伤)都会抑制 MDM2,从而抑制 p53 的泛素化,并使其以四聚体形式稳定存在。四聚体 p53 可诱导一系列基因的转录,激活高度复杂的抗增殖转录程序,调控几乎所有已知的细胞功能(图1A)。“TP53-MDM2轴” 的核心地位在一定程度上解释了为什么 TP53 改变是癌症中最常见的异常。此外,p53 在维持基因组完整性以及调控造血干细胞(HSC)的静止、自我更新和分化方面也发挥着关键作用,从而保护机体免受白血病的发生。
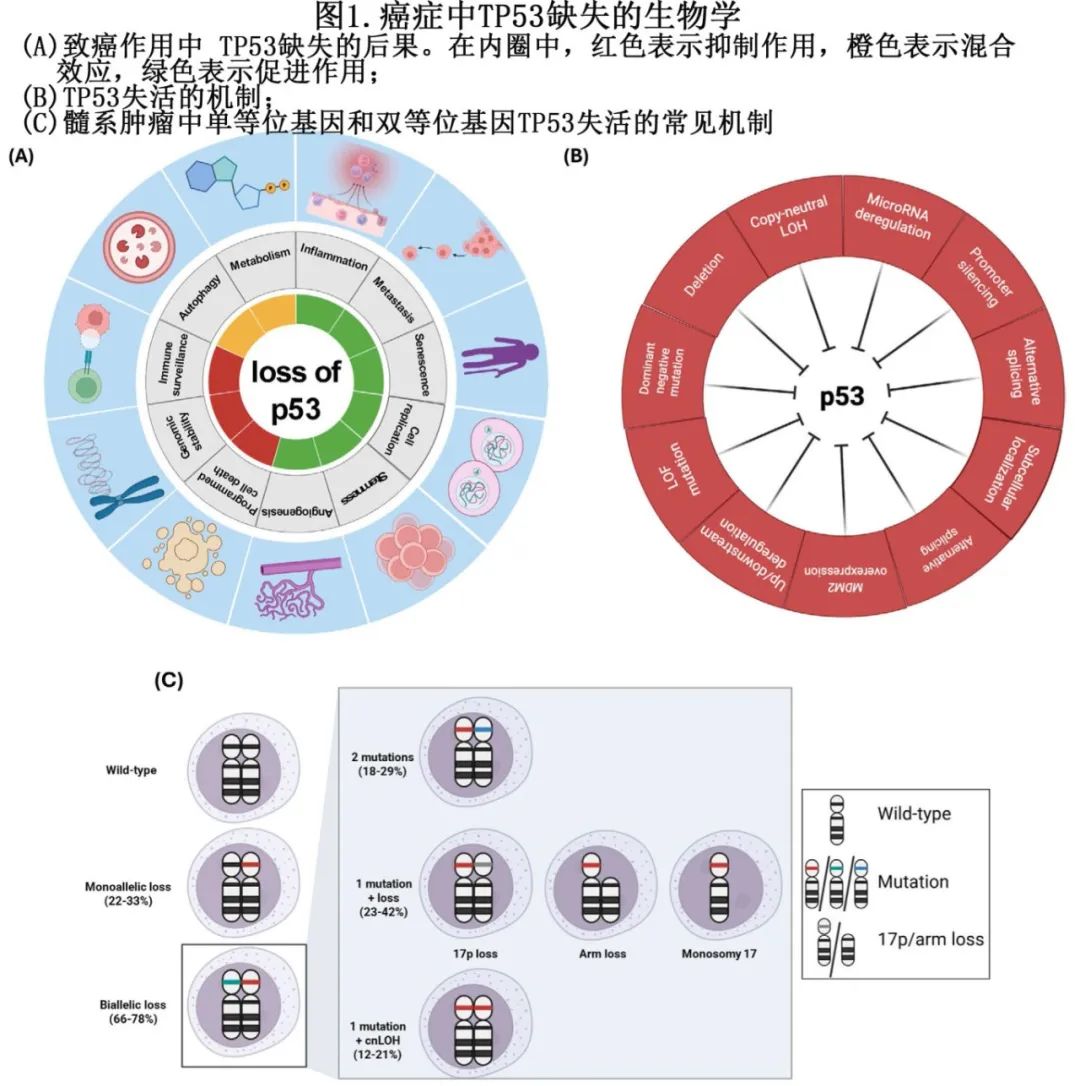
TP53 突变会影响 p53 的四聚体构象,损害其与转录靶点结合的能力。因此,错义突变以及截短突变和/或杂合性缺失/拷贝中性杂合性缺失(LOH/cnLOH)可能导致功能丧失,无法触发 p21,下调与凋亡相关的基因,并上调参与细胞周期进程和DNA损伤修复(DDR)的蛋白质。小鼠研究还通过展示突变 p53 与其他转录因子的异常蛋白-蛋白相互作用,报告了错义突变的功能获得性。此外,还观察到携带DNA结合域(DBD)错义突变的造血干细胞(HSC)比单等位基因 TP53 失活的 HSC 具有相对的竞争优势。最后,错义 TP53 突变还可以通过与野生型 p53 形成四聚体,对野生型蛋白产生显性负效应,从而破坏其转录活性。
1.1.2 TP53失活的机制
尽管 TP53 突变是失活的最常见机制,其他机制还包括 TP53 缺失、选择性剪接、翻译后修饰、微小RNA介导的降解,或者 MDM2/MDM4 上调、ARF 下调(图1B)。三分之二的 TP53 突变导致双等位基因失活,原因可能是双等位基因突变,或者是一个突变伴随野生型等位基因的杂合性缺失/拷贝中性杂合性缺失(LOH/cnLOH)(图1C)。在MN中,双等位基因 TP53 失活的机制包括:≥2个突变(18.4%–28.8%的患者中,中位 22.6%),一个突变伴随反式等位基因缺失(22.5%–42.2%的患者中,中位 33%),以及一个突变伴随同时发生的拷贝中性杂合性缺失(cnLOH)(12.2%–20.6%的患者中,中位 17%)。
2. TP53突变髓系肿瘤的发病机制
t-MN(治疗相关髓系肿瘤)的相对罕见性以及从细胞毒性治疗后的长潜伏期表明,克隆性造血(CH)之外的因素在白血病转化中也可能发挥重要作用。首先,t-MN在接受各种治疗细胞毒性治疗后的发生率为 0.5%–8%。其次,从原发治疗诊断到t-MN诊断的中位潜伏期约为 7年,其中 54% 的患者在原发恶性肿瘤诊断后≥5年诊断为t-MN,29% 的患者在≥10年后诊断。
近年来,测序技术的进步彻底改变了对髓系驱动基因中CH或CCUS的理解。这些前驱疾病的深入研究为白血病的发生提供了关键见解,包括 TP53 突变克隆的起源和白血病转化。
如今认为,TP53 突变是白血病发生(leukemogenic)的早期突变,这一点已得到广泛认可。TP53 突变占所有CH的 4%–5%。在 TP53 突变t-MN和原发恶性肿瘤发生时/之前的配对深度测序显示,在部分病例中,t-MN中的 TP53 突变克隆与原发恶性肿瘤中的克隆相同。一项开创性研究显示,在包含 TP53 的基因组区域中,t-AML和de novo AML的突变负荷相当,表明化疗不太可能直接诱导 TP53 突变。事实上,在更小的亚组中,即使在任何细胞毒性治疗开始之前,最终的 TP53 突变克隆就已经被检测到。这些观察结果强有力地表明,预先存在的克隆在选择性压力下获得适应性优势。
随后,更大规模的研究在多种原发恶性肿瘤和细胞毒性暴露的背景下证实了这些结果。例如,在一项对接受细胞毒性治疗的肿瘤患者的病例对照研究中,36% 的t-MN病例携带 TP53 突变。对原发治疗症诊断时的外周血(PB)/骨髓(BM)样本进行配对测序显示,在所有可评估的病例中,体细胞 TP53 突变的变异等位基因频率(VAF)为 0.92%–22.3%。同样,在接受自体造血干细胞移植(autoHCT)后发展为t-MN的淋巴瘤患者中,所有4例 TP53 突变的MN病例在autoHCT之前都存在低VAF(0.9%–12%)的 TP53 突变克隆。
一项对 5978 例非血液系统肿瘤患者的研究表明,接受细胞毒性治疗的患者中,TP53 突变CH的风险高出 2.8 倍,且风险因治疗类型而异:铂类药物(2.1 倍)、放疗(1.8 倍)和紫杉醇类药物(1.9 倍)。另一项研究也证实了其中部分发现:化疗(尤其是铂类药物和拓扑异构酶 II 抑制剂)倾向于选择性地富集DDR基因突变,包括TP53。放疗与 TP53 突变克隆的选择性生长相关,在发展为 TP53 突变t-MN的患者中,TP53 突变克隆是优势克隆,这表明在强烈的细胞毒性压力下,TP53 突变克隆发生了选择性扩增。
因此,尽管可以明确至少一部分 TP53 突变MN是预先存在的 TP53 突变克隆的最终扩增/进化结果,但 TP53 突变的存在是否是 TP53 突变MN发展的必要且充分条件,目前仍尚不清楚。例如,与上述癌症研究相反,一项基于人群的研究对 438890 名参与者进行调查,结果显示 TP53 突变CH/CCUS并未增加后续MN的风险(HR=0.94,p=0.87)。在小鼠研究中,TP53 突变HSC可促进自我更新,但未能诱导明显的白血病转化,表明单纯存在 TP53 突变克隆可能不足以引发白血病,并且可能需要额外的选择性压力来促进克隆的扩增/进化和转化。因此,上述HSC内在因素(包括 BRCA1/2 致病性变异与 TP53 突变的合作,以及 5号染色体最小缺失区域上基因的单倍体不足)可能在其中发挥作用。此外,一项单细胞多组学研究证明了慢性炎症微环境赋予 TP53 突变克隆适应性优势,促进其进化,同时抑制 TP53 野生型HSC。
综上所述,新出现的证据表明 TP53 突变克隆的白血病转化风险具有多样性,并且HSC内在因素(如遗传易感性)与HSC外在因素(如基因毒性治疗和骨髓微环境)之间的合作可能共同塑造克隆的进化和扩增。前驱疾病(CH和CCUS)的白血病转化相关因素是当前研究的热点领域。
2.1 TP53突变与免疫抑制性微环境有关
除了对白血病细胞本身的巨大影响外,TP53 突变还会调节先天和适应性免疫系统的多个方面,从而进一步促进白血病的发生。一项研究表明,TP53 突变克隆能够重塑有利于其生存、化疗耐药和免疫逃逸的微环境。TP53 突变MN的HSC表达更高水平的程序性死亡配体-1(PD-L1),与 c-Myc 的上调和 miR-34a 的下调有关。此外,TP53 突变MN患者的骨髓中细胞毒性T细胞、辅助T细胞和NK细胞数量减少,但高度免疫抑制性的调节性T细胞(Tregs)和髓系来源的抑制细胞(MDSCs)却出现扩增,这些都表明骨髓微环境处于高度免疫抑制状态。在 TP53 突变AML中,观察到活化的B细胞、效应记忆CD4+ T细胞、中央记忆CD8+ T细胞和两个NK细胞富集簇的数量增加。
综上所述,这些结果表明存在深刻的免疫失调,具有免疫衰老的特征和整体免疫逃逸表型,可能为开发 TP53 突变MN的免疫治疗提供潜在机会。然而免疫检查点抑制剂(ICI)的反应有限,且抗CD47单克隆抗体和针对T细胞免疫球蛋白黏蛋白(TIM)-3的单克隆抗体(sabatolimab)的研究失败,表明克服免疫抑制性微环境是开发成功治疗策略的关键障碍(表1)。
3. TP53突变髓系肿瘤的流行病学
泛癌研究队列证实 TP53 是各种癌症中最常发生改变的基因,且其改变的发生率因癌症类型而异,介于浆液性卵巢癌的~95% 到肾癌的~2%;而MN处于这一谱系的低端,7.5% 的MDS和AML携带 TP53 突变。然而在MN中,三种情况下 TP53 突变更为富集:(1)老年人;(2)携带胚系致病变异(germline pathogenic Variants,PGV)的个体,包括Li-Fraumeni综合征、BRCA1 和 BRCA2 携带者;(3)接受过细胞毒性或免疫抑制治疗的患者。
1.高龄。TP53 突变AML和MDS患者的中位年龄分别为 67岁 和 73岁。与 <60岁 的患者相比,≥60岁患者中 TP53 突变更为常见(7% 2%),并且在 ≥60岁 队列中,TP53 突变AML的发生率随年龄增长而增加:在 61–70岁、71–80岁、81–90岁 和 91–100岁 的患者中,其发生率分别为 16%、19%、17% 和 50%。另一方面,MDS并未观察到类似差异。
2.致病胚系变异携带者。PGV患者可能富集TP53缺陷的肿瘤,尤其是DDR基因中。人们认为 TP53 功能障碍是 BRCA1/2 相关肿瘤发生的核心机制,这或许可以解释为什么在 BRCA1/2 PGV携带者中,TP53 突变t-MN更为富集。这种富集可能因对DDR基因携带者进行细胞毒性治疗而进一步加剧。事实上,在乳腺癌和非乳腺/卵巢癌幸存者中,BRCA1/2 PGV携带者中 TP53 突变t-MN更为常见。与 BRCA1/2 野生型个体相比,携带 BRCA1/2 PGV的卵巢癌患者出现 TP53 突变CH的可能性高出 6.2倍。至少在一部分预先存在的 TP53 突变克隆中,在聚腺苷二磷酸核糖聚合酶抑制剂(PARPi)治疗期间出现扩增,表明存在潜在的机制联系。一项对 53 例t-MN患者的研究(其中12例乳腺癌或卵巢癌病史)发现,约有一半的患者携带DDR基因的PGV。
同样地,通过杂合性缺失(LOH)、拷贝中性杂合性缺失(cnLOH)或拷贝增益杂合性缺失(cgLOH)导致反式等位基因的体细胞失活,在Li–Fraumeni综合征(LFS)患者中是一种常见现象。LFS是一种罕见的常染色体显性遗传性癌症易感综合征,由 TP53 基因的PGV引起。LFS患者患多种癌症的风险增加,其中包括约 4% 的血液系统恶性肿瘤发病率。在LFS个体中发生的肿瘤中,大多数(86%)病例出现 TP53 的LOH/cnLOH,且似乎早在胎儿期就已发生。
3.既往细胞毒性治疗和免疫抑制治疗。癌症幸存者患白血病的风险比普通人群高出 4.7 倍。随着癌症治疗效果的提高和生存期的延长,这些治疗的长期并发症逐渐受到关注。例如,在过去二十年间,t-MN的发病率有所上升:从 2001年至2007年 的 0.04/1万人新发病例增加到 2008年至2014年的 0.20/10万人新发病例。
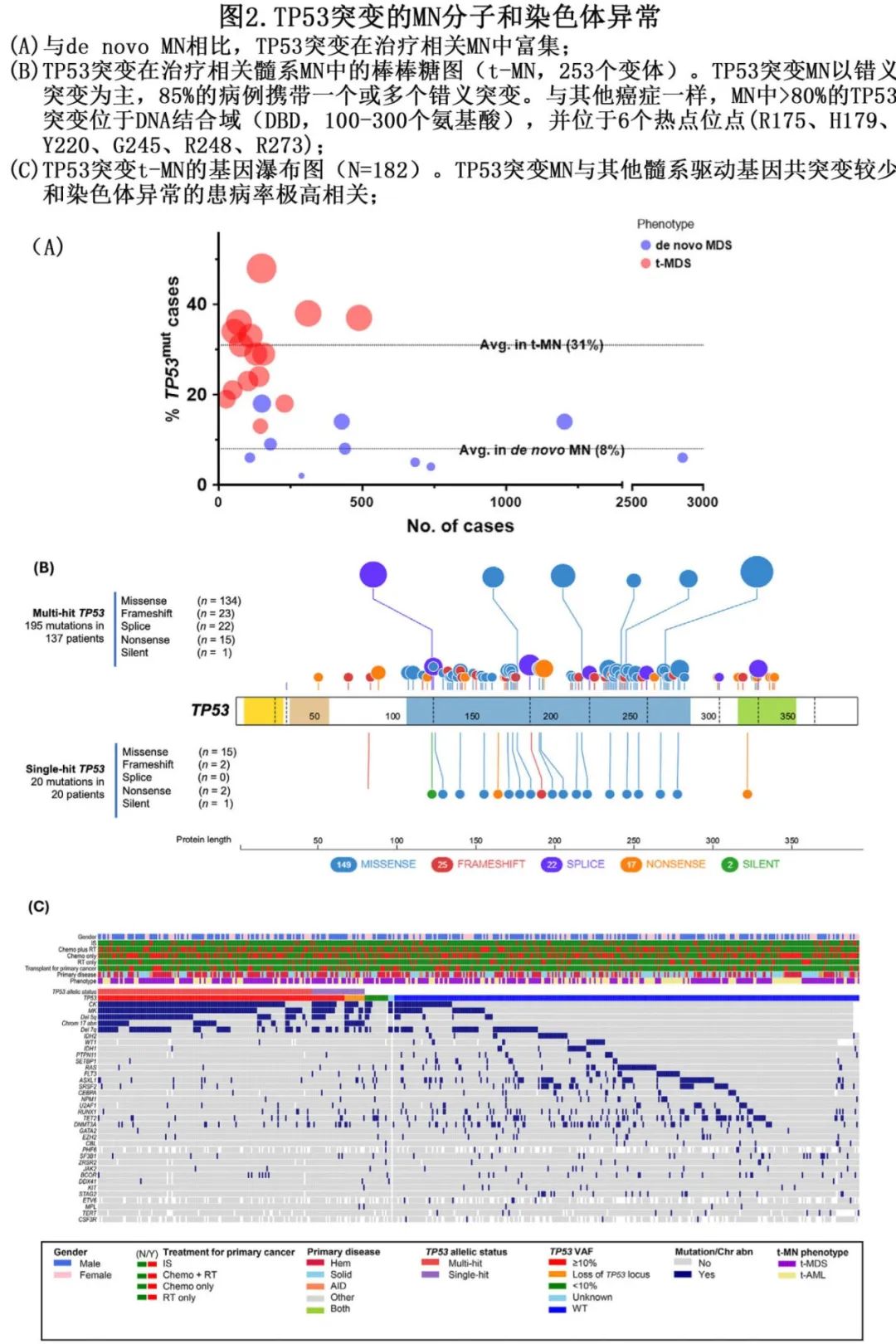
与de novo MN(2%–18%)相比,t-MN中 TP53 突变的富集更为显著(13%–48%)(平均 31% vs 8%,图2A,表1)。在t-MN患者中,约 40% 有实体瘤病史,约 50% 有血液系统恶性肿瘤病史;其余患者则在自身免疫性风湿性疾病(AIRD)治疗或实体器官移植后发病。在多发性骨髓瘤(MM)和卵巢癌患者中,t-MN显著富集 TP53 突变。在治疗方式中,自体造血干细胞移植(autoHCT)和化疗暴露与单纯放疗相比,患TP53 突变t-MN的风险分别高出 2.2倍和2倍。
总体而言,新出现的数据表明,由于衰老或遗传易感性,个体容易发展出 TP53 突变克隆,而这种转化可因遗传缺陷的协同或医源性选择压力而加速。
3.1 新疗法与TP53突变MN风险增加相关
随着靶向治疗和免疫治疗的使用增加,人们原本希望t-MN和TP53突变MN的发病率能够降低。然而新出现的数据表明,许多新型疗法与这两种疾病的发病率增加有关。以下部分探讨了新型抗癌疗法(如肽受体放射性核素治疗[PRRT]、聚腺苷二磷酸核糖聚合酶抑制剂[PARPi]和嵌合抗原受体T细胞疗法[CAR-T])与TP53突变MN之间的联系,以及它们之间的共同点。
研究这些联系至关重要,原因有二:一方面,这些疗法的使用预计将呈指数级增长,无论是在适应症的范围还是在使用量上;另一方面,新型疗法后出现的t-MN具有一些与传统细胞毒疗法相似的特征,包括TP53突变MN的比例、染色体异常和预后,但潜伏期似乎明显更短——这值得进一步研究。
肽受体放射性核素治疗(PRRT),如Lutetium-177- Dotatate (177Lu-Dotatate)和Lu 177 vipivotide (177Lu-PSMA-617)是一种靶向系统性放射性药物疗法,使用与肽类似物结合的β粒子发射放射性核素。177Lu-Dotatate已获得美国食品药品监督管理局(FDA)批准,用于治疗生长抑素胃肠胰神经内分泌肿瘤(GEP-NETs),177Lu-PSMA617已获批用于治疗转移性去势抵抗性前列腺癌(mCRPC)。177Lu-Dotatate治疗的患者中约1.4%~4.8%出现t-MN,中位潜伏期为3~4年。在最近一项描述14例PRRT治疗后t-MN的研究中,2例多打击TP53突变MDS分别在治疗后17个月和18个月出现。此外,2例患者存在蛋白磷酸酶镁依赖(PPM)-1D基因突变,且这些突变是互斥的。
最近一项单中心病例系列研究报道了381例接受177Lu-PSMA治疗的患者中出现5例(1.3%)t-MN,其中3例存在多打击TP53失活,且所有病例均为高危核型。
PARPi是卵巢癌、乳腺癌或转移性前列腺癌的标准治疗方案,这些癌症存在已知或疑似缺陷的DDR机制。PARP参与单链DNA断裂的修复,而DDR基因(如BRCA1和BRCA2)则有助于双链DNA断裂的修复。在一项对298例接受奥拉帕利治疗的BRCA1/2突变治疗患者的研究中,观察到6例(2%)t-MN。一项对28项随机对照试验的荟萃分析显示,与安慰剂治疗的患者(n=3406)相比,接受PARPi治疗的患者(n=5693)发生t-MN的风险高出2.6倍(0.73% vs 0.47%)。值得注意的特征包括PARPi暴露时间较短(中位数为9.8个月),以及在PARPi暴露后发生t-MN的潜伏期极短(中位数为20.3个月)。在PARPi治疗后发生的t-MN中,50%~75%存在TP53突变,其中大多数为多打击或等同于多打击。TP53突变t-MN的富集部分可以归因于PARPi治疗患者中TP53突变CH的负担更高(相对于未接受PARPi的患者,64% vs 14.3%),以及在PARPi治疗期间克隆的扩增。结合上述知识,这些患者中有一部分携带癌症易感性PGV,这或许可以解释该群体中TP53突变t-MN的高发率。
CAR-T细胞疗法彻底改变了复发或难治性B细胞急性淋巴细胞白血病、CD19+淋巴增殖性疾病(LPD)和多发性骨髓瘤(MM)的治疗格局。随着其更广泛的应用和更长期的随访,继发性肿瘤(包括t-MN)的风险也增加,这一问题最近引起了极大关注。
在接受CAR-T治疗的患者(n=312)中,t-MN的累积发病率在治疗后1年、2年和3年分别为4%、6%和9%。值得注意的是,44.4%的t-MN病例存在TP53突变。CAR-T治疗后t-MN的一个显著特征为潜伏期极短(中位数为9.1个月),60%的t-MN在CAR-T治疗后1年内被诊断。这与传统细胞毒治疗(包括autoHCT)后5-6年的更长潜伏期形成了鲜明对比。在使用CD19和BCMA靶向构建物治疗的LPD和MM病例中,CAR-T治疗后TP53突变的高发病率和短潜伏期一致,表明CAR-T治疗与随后的MN之间可能存在潜在的机制联系。在基线时,CH的高发病率(37%-64%)部分解释了TP53突变t-MN的高比例,主要涉及TP53和PPM1D。在部分CAR-T治疗后的t-MN中检测到相同的TP53突变克隆,表明CAR-T治疗可能通过尚未明确的机制导致预先存在的克隆迅速扩增。
总之,研究新型疗法后发生的t-MN是一个极具吸引力的领域。尽管相似的遗传和基因组特征(包括多打击TP53突变的比例)强烈暗示共同的发病机制,但这些新型疗法通常是与细胞毒疗法联合使用或在其后使用。因此,目前尚不清楚这些疗法是诱导突变还是导致预先存在的突变克隆扩增。需要进一步的研究来明确这些疗法对TP53突变MN发展的具体影响及其机制。
4. TP53突变髓系肿瘤的临床和分子特征
4.1 MN中TP53突变的特征
TP53 基因座上整个17号染色体或17p13.1的缺失和截断突变可导致 TP53 功能丧失。然而与大多数其他抑癌基因不同,错义突变在TP53突变MN中占主导地位,其中77%为错义突变,9%为移码突变,6%为剪接突变,6%为无义突变,2%为缺失突变,1%为同义突变(图2B)。与其他癌症类似,超过80%的TP53突变在MN中定位于DNA结合域(DBD,100-300氨基酸),并且集中在热点位点。MN(包括t-MN)与其他癌症相比,具有独特的突变热点谱。对国际癌症研究机构(IARC)TP53数据库的分析显示,在所有癌症中,6种最常见的突变(R175、G245、R248、R249、R273和R282)占所有TP53突变的27.7%。相比之下,所有MN和t-MN的突变谱显示出一致的独特模式,其中R175、Y220、M237、R248、R273和R282是最常见的突变。MN中突变特征(例如,位置、热点与非热点)的生物学基础及其影响目前仍不甚清楚。
4.2 TP53突变MN的共突变模式
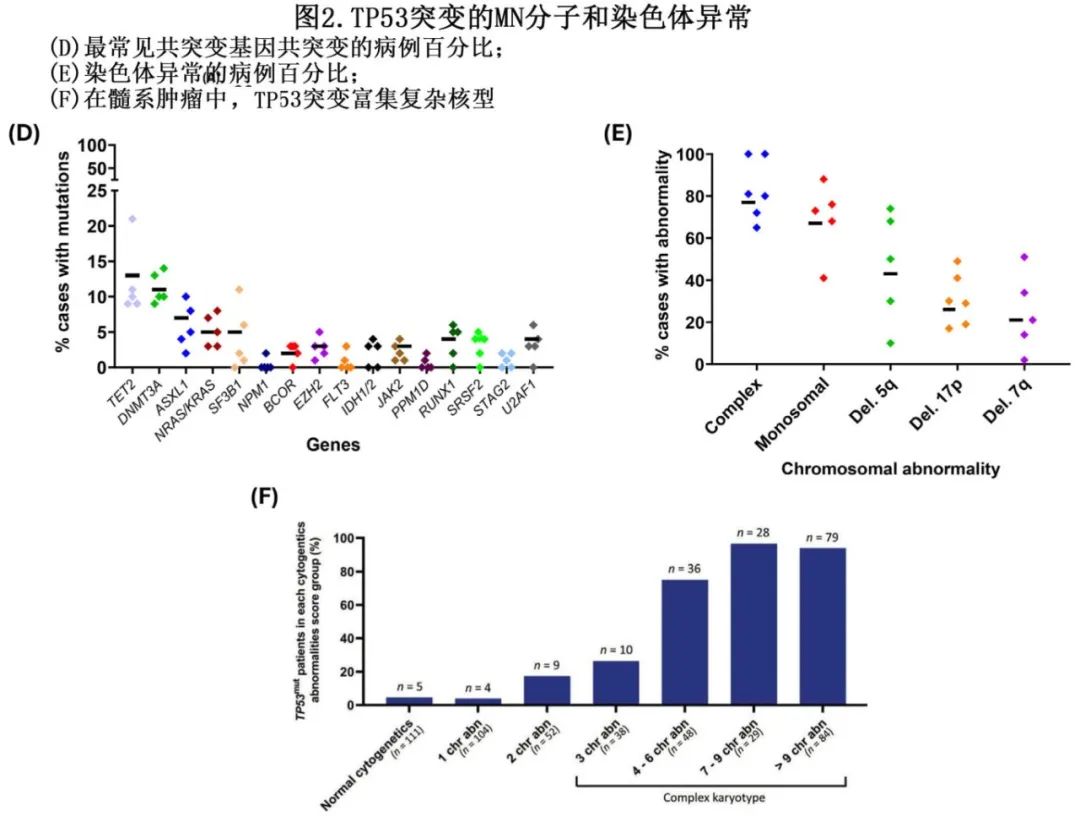
鉴于TP53在DDR中的重要作用,可以推测TP53突变MN的突变负担会更高。然而,TP53突变MN与TP53野生型MN的一个显著特征在于,TP53突变MN中髓系驱动基因的共突变较少。超过半数(52%)TP53突变t-MN中未发现已知的共突变,而TP53野生型t-MN中这一比例为17.3%,且双等位基因TP53突变MN的平均共突变数量低于TP53野生型MN(每例分别为0.8和2.1,图2C、D)。在TP53突变t-MN中,仅有20.3%的病例存在≥2个共突变,而TP53野生型t-MN中这一比例为63.7%。这种共突变的缺乏涉及多种基因/通路,包括信号通路(KIT、FLT3、WT1)、表观遗传修饰因子(DNMT3A、TET2或ASXL1)或剪接体(U2AF1、SF3B1、SRSF2或ZRSR2)。另一方面,ETV6和NF1的改变在TP53突变MN中更为富集。即使在携带TP53突变的MN中,“TP53驱动”的肿瘤(即多打击TP53突变)与单打击TP53突变相比,共突变更少,表明多打击TP53失活是一个与单打击TP53突变和TP53野生型MN不同的生物学实体。
由于TP53突变MN中缺乏与生存相关的明确共突变模式,因此提出了TP53 Evolutionary action(EAp53)和EPI-6评分等评分系统。EAp53是一种最初为头颈部鳞状细胞癌开发的计算方法,已应用于TP53突变MN,但效果参差不齐。Kaur等人最近提出了EPI-6评分,该评分考虑6个基因(CUX1、U2AF1、EZH2、TET2、CBL或KRAS)的改变,这些基因在预测接受维奈克拉和HMA治疗患者的2年生存率较差方面具有重要意义。由于缺乏独立验证,这些评分系统在常规临床实践中的广泛应用受到限制。
4.3 TP53突变MN的染色体异常
与其他癌症相比,MN在基因组上表现出显著的“沉默”特征,仅40%至50%的MN存在染色体异常。鉴于TP53作为“基因组守护者”的作用,其功能丧失与基因组改变存在相关性是合理的。在缺乏功能性p53的情况下,细胞无法有效修复DNA损伤,最终导致广泛的染色体改变。事实上,TP53突变MN的一个显著特征是细胞遗传学异常的普遍性,包括高度复杂的基因组异常和染色体碎裂(chromothripsis)。
中期细胞遗传学研究表明,在TP53突变MN中,复杂核型(CK;定义为在缺乏AML定义性易位和/或倒位的情况下存在≥3种染色体异常)的富集率高达70%至80%,而TP53野生型MN中仅为10%(见图2E)。同样,与TP53野生型t-MN相比,TP53突变t-MN中染色体异常更为常见——50%至60%的TP53野生型t-MN具有正常核型,而仅有12.4%的TP53突变型t-MN具有正常核型。5q缺失、7q缺失和17p丢失等常见的细胞遗传学异常在TP53突变MN中都很常见。与之相反,TP53突变的频率从正常核型病例的4.5%上升到存在两种染色体异常时的17.3%,且在存在复杂核型时上升到76.8%。即使在复杂核型组内,随着细胞遗传学异常数量的增加,TP53突变还会进一步富集:在存在3种染色体异常的病例中为26.3%,而在存在4-6种、7-9种和>9种染色体异常的病例中分别上升到75%、96.6%和94%(图2F)。
最后,CK对TP53突变MN生存的影响是情境依赖的:在一组de novo TP53突变MN中,与非CK TP53突变MN相比,CK的存在与较差的生存率相关。与之相反,在287例具有CK的MN中,83%存在TP53突变,并且是生存不良的独立风险因素。DK的影响似乎仅限于无原始细胞增多的MDS,而对原始细胞增多的病例没有影响。该结果也不适用于TP53突变t-MN:无论是否存在CK,生存率都很差(7.3个月 vs 8.3个月)。
最后,p53可抑制一种称为染色体碎裂的染色体碎裂(shattering)和重排(rearrangement)事件。染色体碎裂的特征是在一次灾难性事件中产生的大量基因组重排,以及在一个或几个染色体中DNA拷贝数水平的振荡模式。因此,p53的丢失促进非整倍体细胞的积累,并允许其存活。全癌种全基因组分析(PCAWG)显示,与TP53野生型相比,TP53突变与染色体碎裂的风险高出1.5倍(38% vs 24%)。在一项对具有CK的AML的研究中,35%的病例中观察到染色体碎裂,其中7号染色体(10%)、3号染色体(9%)和12号染色体(9%)最常受到影响。染色体碎裂与AML死亡风险独立增加2.5倍相关。
4.4 5号染色体长臂分离缺失对MDS患者TP53突变的影响
伴有5号染色体长臂缺失的MDS(MDS-del(5q))是一种具有独特特征的MDS亚型,表现为预后良好、对来那度胺治疗反应良好以及SF3B1突变富集。然而TP53突变在MDS-del(5q)中显著富集(18%-20% vs其他MDS的5%-10%),并且在白血病期进一步富集。此外,治疗相关MDS-del(5q)中TP53突变的富集程度高于de novo MDS-del(5q)(30% vs 19%),但与非del(5q) MDS相比,多打击失活的比例显著较低(25% vs 70%-75%)。
在这一原本预后良好的疾病中,TP53突变与生存率降低和AML进展风险增加相关,因此处于预后谱两端交叉点。研究认为,位于5号染色体5q缺失区域的基因(如酪蛋白激酶1α1 [CSNK1A1]、早期生长反应1 [EGR1]和APC)可能与TP53突变协同作用,赋予HSC生存优势并促进AML进展。抑制CSNK1A1可诱导p53介导的凋亡,而来那度胺通过选择性降解CSNK1A1对正常HSC更具毒性,从而为TP53突变克隆提供竞争优势。
近期研究发现,多打击TP53突变或单等位基因突变伴等位基因突变频率(VAF)≥20%或≥22%是生存不良的亚组。相比之下,单等位基因TP53突变伴VAF<22%的生存率和AML进展风险与TP53野生型MDS-del(5q)相当。尽管来那度胺治疗效果显著,但可能导致TP53突变克隆的选择性扩增,增加白血病转化的可能性。
综上所述,将TP53突变的等位基因状态和VAF阈值纳入诊断、监测和治疗策略,可以更好地对MDS-del(5q)患者进行风险分层并指导治疗决策。
4.5 多靶点TP53突变对骨髓增殖性肿瘤的影响
在当前的WHO-5和ICC中,TP53突变MDS不包括骨髓增殖性肿瘤(MPN)。最近的一项研究评估了TP53突变(变异等位基因频率VAF≥2%)在MPN病例中的影响。结果显示, TP53突变加速期/急变期(AP/BP)MPN的生存期显著短于TP53野生型MPN-BP/AP,无论等位基因状态或VAF如何。另一方面,类似于TP53突变MDS,多打击TP53突变比非多打击TP53突变慢性期骨髓纤维化的生存期更短。
5. TP53突变髓系肿瘤的诊断
TP53突变与所有MN的不良预后均相关,包括MDS、AML、MDS/MPN和MPN。最近发布的WHO第5版分类(WHO-5)和ICC认可TP53突变MDS和AML为独特的实体,这是基于其生物学同质性、不良预后以及与TP53野生型MN在生物学和临床表现上的显著差异。无论原始细胞百分比如何,TP53突变MN在细胞遗传学异常的富集、共突变的稀少以及预后方面表现出显著的相似性。
TP53突变MN的分类可以视为一个两步过程:首先,确定TP53的“打击状态”(即单等位基因或双等位基因突变);其次,将打击状态与原始细胞百分比相结合进行分类。TP53突变通常通过靶向测序分析至少覆盖外显子4-11来确定。能够检测LOH的分子病理学方法包括FISH、单核苷酸多态性(SNP)阵列、专门设计用于检测17p LOH的NGS panel以及全WGS。cnLOH可通过SNP阵列、专门的NGS panel或WGS检测。存在≥2个突变通常靶向两个等位基因,并被认为是双等位基因/多打击事件。同样,存在一个TP53突变且变异等位基因频率(VAF)≥50%被认为是LOH/cnLOH的可能(但非确定性)证据(表2)。

5.1 WHO第五版与ICC中的TP53突变髓系肿瘤
将TP53突变MN单独分类的目标包括更广泛地认识到其极差的预后,鼓励相关研究,并促进临床试验设计,最终推动药物研发。然而在实际应用中,由于分类标准存在差异,这些分类的采用面临挑战。例如,在一项对603例携带TP53突变(VAF≥2%)的MN患者的研究中,分别有64%和20.4%的病例无法根据WHO-5和ICC分类归为TP53突变MDS或MN(图3A)。此外,407例(67.5%)患者的分类存在不一致(见图3B)。另一项研究(n=188)也证实了这些发现,表明64%的病例会因WHO-5和ICC分类而有不同的诊断结果。随着这两种分类体系在临床实践中越来越广泛应用,它们之间的差异可能导致对预后风险的低估或高估,以及治疗决策的不一致性。
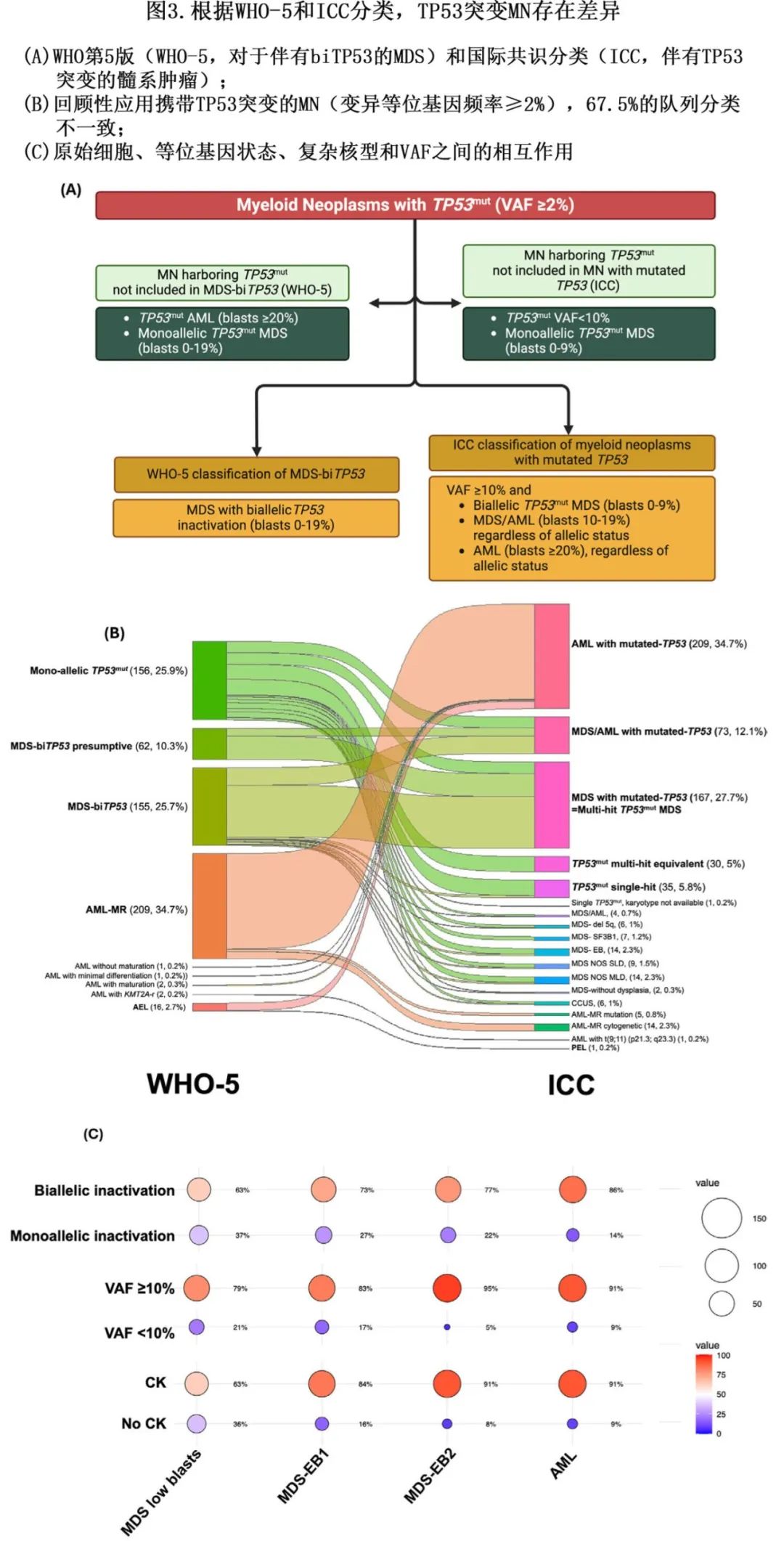
两种分类体系之间的关键差异在于对形态学评估、TP53突变AML、等位基因状态以及MDS、复杂核型、17p13.1缺失(通过中期细胞遗传学检测)和TP53突变VAF阈值的重视程度(表3)。WHO-5分类仅包括双等位基因TP53突变MDS,而ICC分类则将MDS和AML归入一个独立的TP53突变MN类别。

上述差异的核心在于能否明确标识一个完全缺乏野生型TP53功能的肿瘤克隆。理想情况下,应通过证明两个等位基因均被灭活来确定(例如≥2个突变,或≥1个突变伴随同一细胞中反式等位基因的缺失)。由于单细胞技术尚未广泛应用于临床以可靠地确认双等位基因失活,多打击TP53失活被视为一个可接受的替代指标。目前,相关研究正在紧急推进,以提供进一步的澄清,并为未来的指南修订提供依据。
1.TP53突变AML。大约35%~40%的TP53突变MN为AML。由于ICC承认TP53突变且变异等位基因频率(VAF)≥10%的AML,而WHO-5则将大多数此类病例归类为骨髓增生异常相关AML(AML-MR),因此这些病例中有很大一部分(94%)在ICC和WHO-5之间存在诊断差异。然而,TP53突变AML表现出独特的遗传特征和显著更差的总生存率。与野生型TP53的AML-MR相比,TP53突变AML的生存率显著更差(中位生存期分别为4.7个月和18.3个月;p<0.0001)。综合这些结果,支持将TP53突变AML与其他AML区分开来,并纳入TP53突变MN的分类中。
2.变异等位基因频率(VAF)阈值。ICC和WHO-5分类之间的另一个关键差异在于ICC采用了≥10%的VAF阈值,而WHO-5没有。具体来说,ICC要求TP53突变的VAF≥10%,其隐含的逻辑是将其与较小的TP53突变克隆区分开来,这些克隆可能并非病理驱动因素。采用的VAF阈值是一个经验性阈值,用于区分由TP53突变驱动的MN和携带TP53突变的MN。大约10%的TP53突变MDS-EB1、MDS-EB2和AML患者的TP53突变VAF<10%,其中55.6%的病例存在CK。VAF<10%且无CK的MDS-EB1和EB2患者的生存率与无CK的单等位基因MDS-LB患者相当(中位生存期分别为26.2个月和34.8个月;p=0.44),而VAF<10%且有CK的患者生存率与VAF≥10%的患者相当(中位生存期分别为5.6个月和6.3个月)。综合这些结果表明,无论VAF如何(≥10%或<10%),只要存在≥5%原始细胞伴CK,TP53突变MN病例都应纳入TP53突变MN的分类中。
3.原始细胞百分比与等位基因状态的交互。两种分类在原始细胞百分比与等位基因/打击状态的交互解释上存在差异。ICC在风险分层中优先考虑原始细胞百分比,提出了三个亚类:多打击MDS(骨髓/外周血原始细胞0%~9%)、MDS/AML(10%~19%)和AML(≥20%),不考虑等位基因状态。因此,单打击MDS(0%~9%原始细胞)被排除在TP53突变MN的定义之外。另一方面,WHO-5要求在整个MDS谱系(原始细胞0%~19%)中证明双等位基因TP53失活,从而排除单等位基因TP53突变且原始细胞0%~19%的MDS。
研究表明,在低原始细胞MDS(骨髓原始细胞<5% 和外周血原始细胞<2%)中,等位基因状态对预后非常重要;然而对于 MDS-EB1(骨髓原始细胞 5%–9% 和/或外周血原始细胞 2%–4%)、MDS-EB2(骨髓原始细胞 10%–19% 和/或外周血原始细胞 5%–19%)及AML(骨髓/外周血原始细胞 ≥ 20%),无论等位基因状态如何,其预后均较差。这与另一项研究结果一致,即骨髓原始细胞<5% 的 MDS 是一个与其他类别不同的亚组。例如,TP53 突变且骨髓原始细胞<5% 的 MDS 患者中只有 24% 存在多克隆 TP53 失活,而骨髓原始细胞为 5%–9%、10%–19% 和 ≥ 20% 的患者中该比例分别为 67%、91% 和 71%。其次,CK状态在骨髓原始细胞<5% 的 MDS 中可预测较差的生存率(风险比为 5.2,p<0.001),但在高原始细胞类别中则不能。综合来看,采用 WHO-5 和 ICC 标准可能会低估单打击 TP53 突变 MDS(5%–19% 和 10%–19%)患者的生存率。
细胞遗传学异常(包括 CK)在所有 TP53 突变MN中并不均匀分布。与之相反,CK、原始细胞百分比、VAF和等位基因状态之间存在复杂的相互作用(图 3C)。鉴于这种复杂的相互作用,需要一个同时考虑多种因素的分层预后模型。
4.复杂核型是多克隆TP53失活的实用替代指标。在缺乏全面拷贝数变异(CNV)分析的情况下,ICC将CK(TP53突变等位基因频率VAF≥10%)视为多克隆失活的等效指标,但WHO-5标准并不如此认定。TP53突变VAF<50%且伴有CK的MDS患者的生存率与染色体核型显示17p13.1缺失的患者相当(10.4个月vs 11.0个月;p=0.39),但显著低于无17p缺失或CK的单克隆TP53突变患者(10.4个月 vs 33.4个月;p<0.0001),这表明对于单个TP53突变且VAF<50%的MDS患者,CK的存在可以视为双克隆TP53失活的实用替代指标。
5.通过拷贝数变异分析,验证中期核型分析检测到的17p13.1缺失。WHO-5标准要求通过额外的CNV方法验证中期核型分析检测到的17p13.1缺失。在单个TP53突变且VAF<50%的MDS中,仅通过核型分析检测到的17p13.1缺失并不视为双克隆失活的证据,而ICC标准则不要求进行此类验证。
通过拷贝数变异(CNV)分析验证TP53基因位点的缺失是有用的,尤其是在核型分析显示17p13.1存在复杂结构重排的病例中。其次,中期核型分析可能会遗漏隐匿性LOH/cnLOH。
鉴于不同实验室在仪器设备和人员配备方面的差异,高度依赖资源、周转时间和机构实践的算法化方法在实际应用中存在诸多限制:大多数诊断实验室无法可靠地使用常规二代测序(NGS)技术进行CNV分析。通常会在明确TP53突变状态后,再进行SNP阵列和/或FISH。但这些连续检测可能会显著延迟风险分层和治疗决策。
该问题在最近一项包含603例TP53突变MN的国际研究中得到体现,其中约20%的病例进行了CNV分析。在核型分析显示17p13.1缺失的可评估病例中,通过CNV分析确认94%的病例存在TP53位点的LOH。此外,在核型分析未显示17p13.1缺失的病例中,CNV分析检测到22.5%的病例存在TP53位点的LOH/cnLOH。值得注意的是,所有这些病例均伴有CK,而没有CK且核型分析未显示17p13.1缺失的病例中,均未检测到TP53位点的LOH/cnLOH。此外,单个TP53突变且变异等位基因频率(VAF)<50%、核型分析显示17p13.1缺失的MDS患者的生存率与双克隆失活相似。总体而言,这些结果表明,在临床实践中,核型分析显示的17p13.1缺失可视为转录本等位基因丢失的证据。
6.形态学评估。WHO-5要求一个病例必须符合MDS的诊断标准,才能进一步分类为具有双克隆TP53失活的MDS(MDS-biTP53)。另一方面,对于多打击TP53突变且原始细胞<5%的血细胞减少症病例,ICC指南允许在缺乏异常增生(dysplastic)特征的情况下分类为TP53突变MDS。该建议是基于一项研究表明,携带TP53突变但缺乏足够的异常增生以诊断MDS的CCUS病例,与TP53突变MDS在生物学特征、突变模式和生存率方面相似。然而,最近更大规模的基于人群的研究并未证实TP53突变是生存的独立不良风险因素。最后,在一项单中心研究中,29例TP53突变CCUS患者中,只有3例(10.3%)进展为MN,且 TP53突变CCUS患者的无进展生存期(PFS)和总生存期(OS)与TP53野生型CCUS患者相当。因此,需要更多的数据来支持未来的建议。
7.既往细胞毒性治疗的影响。两种分类在是否将既往细胞毒性治疗纳入风险分层的解释上有所不同。ICC删除了“治疗相关髓系肿瘤”的亚类别,用诊断限定词取而代之;WHO-5将t-MN与继发性髓系肿瘤合并,并重新命名为“细胞毒性治疗后的髓系肿瘤”。在这两种情况下,都没有区分de novo和细胞毒性治疗后的TP53突变MN。这些建议是基于一项国际研究,该研究纳入229例t-MDS,其中18%(n=41)携带TP53突变,多打击TP53突变t-MDS的生存率低于单打击TP53突变。相比之下,对更大规模的TP53突变t-MN(n=260,34.2%携带TP53突变)的分析显示,与de novo TP53突变MN不同,单打击和多打击TP53突变t-MN在临床特征、结构染色体异常以及共突变模式方面是相似的。至关重要的是,与de novo MDS不同,单打击TP53突变t-MDS进展为AML的发病率和生存率与多打击TP53突变t-MDS相当。
这些发现挑战了ICC分类的假设,即无论病因如何,TP53突变MN具有相似的基因组特征和预后,以及不要低估单打击TP53突变t-MDS的不良预后。
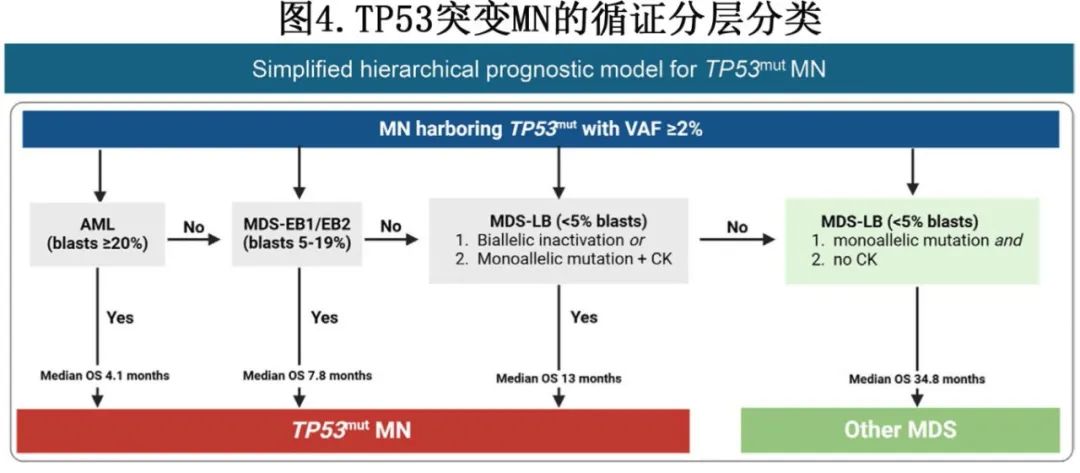
基于上述证据,作者提出了一个分层模型,近日发表于《Blood Adv》(https://doi.org/10.1182/bloodadvances.2024015238)。由于TP53突变骨髓/外周血≥5%且VAF<10%且无CK的情况相对罕见(4.2%),所有TP53突变MN(VAF≥2%)均可视为TP53突变MN。接受这一规定后,提出了一个简化且具有临床实用性的模型(图4;在线网址https://chung-kok.shinyapps.io/tp53mn-risk/),该模型认为91.9%的TP53突变MN生存率较差。
6. TP53突变髓系肿瘤的治疗
TP53突变MDS的有效管理仍然是一个长期存在的挑战,主要是由于其固有的化疗耐药性。因此,尽管TP53突变在癌症中较为常见,但仍然是一个难以靶向(undruggable)的靶点。在其他形式的MN中取得的显著进展并未惠及TP53突变MN,其诊断后的生存期仍不足1年。常用的策略包括HMA、强化疗以及BCL-2抑制剂维奈克拉。维奈克拉的初步研究显示出较高的缓解率,曾让人们寄希望于它能够改善TP53突变AML的预后,然而长期随访表明维奈克拉为基础的方案并未显著改善TP53突变AML患者的生存。
在最近的一项荟萃分析中,强化疗、HMA及HMA联合维奈克拉的中位生存期分别为6.5个月、6.1个月和6.2个月,显示出相似的生存结果。令人担忧的是,由于缺乏疗效,几类药物的进一步开发已被终止。以下是总结的常用管理策略的已发表经验。
1.支持性治疗。鉴于患者的年龄、合并症、同时存在的血细胞减少症以及t-MDS的富集,9.4%至21%的患者未选择疾病修饰(disease-modifying)治疗,仅接受支持性治疗。正如预期,姑息治疗的预后较差,中位生存期为1至4个月。
2.强化疗。细胞毒性化疗的反应高度依赖于完整p53的存在,以诱导细胞凋亡。因此,TP53突变MDS对化疗反应较差。历史上,阿糖胞苷与蒽环类药物联合或以高剂量阿糖胞苷为基础的方案被用作适合接受强化治疗患者的前线疗法。强化疗在TP53突变MDS中的使用率传统上较低(14.6%–22.5%),反映出患者和疾病相关因素的影响:年龄、虚弱程度、疾病侵袭性以及TP53突变的固有化疗耐药性。多个研究小组报告的模型缓解率为20%–40%,中位生存期为5–11个月。有趣的是,与非热点突变相比,TP53热点突变的存在与较低的缓解率相关(17.9% vs. 57.1%;p=0.025)。
在一项单中心研究中,202例TP53突变AML患者中有22%接受中等剂量/高剂量阿糖胞苷为基础的方案。该队列的缓解率和生存期与TP53突变VAF相关:VAF≤40%的患者中位生存期为18.1个月,而VAF>40%的患者为5个月。此外,与接受HMA治疗相比,接受更高强度治疗的益处仅限于VAF≤40%的患者。目前尚不清楚这些发现是否真正代表阿糖胞苷为基础的方案的治疗获益,还是仅仅反映了接受异基因移植的较年轻患者群体。因此,需要进一步独立验证这一观察结果。
CPX-351是一种封装的脂质体柔红霉素和阿糖胞苷制剂,能够将药物以5:1的协同比例优先递送至白血病细胞,同时尽量减少对正常骨髓细胞的非靶向毒性。CPX-351已获美国FDA批准用于继发性AML和治疗相关AML(均富集TP53突变,尽管未进行基于TP53突变的分层)。与其他治疗方式类似,TP53突变AML的复合完全缓解率仅为TP53野生型AML的一半(33% vs. 66%,p=0.035)
3.HMA。阿扎胞苷和地西他滨等HMA是治疗MDS(包括TP53突变MDS)的常用策略之一。在维奈克拉时代之前,HMA是老年或不适合强化治疗患者的首选一线疗法。ASTRAL-1试验的回顾性分析显示,TP53突变是AML的“不良预后因素”。Welch等人的研究发现,10天地西他滨治疗能够改善TP53突变的不良影响,使TP53突变和TP53野生型患者的生存期相当(12.7个月 vs. 15.4个月,p=0.79)。然而另一项研究未能验证该获益,显示10天和5天地西他滨方案的缓解率(40% vs. 43%,p=0.78)和生存期(6个月 vs. 5.5个月)相当。
4.维奈克拉。维奈克拉是一种口服选择性BCL-2抑制剂,彻底改变了老年AML患者或不适合强化诱导治疗患者的治疗模式。关键研究VIALE-A和VIALE-C分别研究了维奈克拉联合阿扎胞苷和低剂量阿糖胞苷(LDAC),结果显示加入维奈克拉后复合缓解率(CR+CRi)显著提高(VIALE-A中55.3% vs. 0%,VIALE-C中18% vs. 0%)。然而很快发现TP53缺失的AML细胞中BAX表达降低是其对BH3模拟物产生固有耐药的原因。此外,单核细胞分化以及HLA-DR和CD34的下调是获得性耐药的潜在机制。
经过更长时间的随访,现在可以明确,维奈克拉为基础的方案并未改善这一特定亚组患者的预后。在一项纳入301例新诊断AML患者的研究中,患者接受维奈克拉联合HMA治疗,多打击TP53突变与单打击TP53突变或TP53野生型AML相比,CR/CRi率较低(38% vs. 63% vs. 67%)。与TP53野生型AML相比,TP53突变还导致无复发生存期较短(7.9个月 vs. 19.3个月)和总生存期较短(5.9个月 vs. 16.6个月)。另一项对279例接受关键性维奈克拉联合阿扎胞苷研究的患者的汇总分析也证实,TP53突变是生存的独立风险因素(中位生存期为5.5个月)。综合这些结果,对于接受非强化治疗的患者,TP53突变已成为欧洲白血病网络(ELN)风险分类中“预后不良”类别的决定性特征。
鉴于FDA的批准,维奈克拉方案的有效性证据大多限于AML。最近,维奈克拉联合方案已在高危MDS中尝试,包括TP53突变MDS。在一项针对初治高危MDS(NCT02942290)的维奈克拉联合阿扎胞苷的1b期研究中,107例患者中有20例(18.7%)携带TP53突变。TP53突变病例的完全缓解率与整个队列相当(25% vs. 29%),但生存期数值上稍差(11.2个月 vs. 26个月)。需要更长时间的随访和更大规模的研究来验证这些发现。
5.alloHCT。对于TP53突变MN患者,alloHCT是唯一具有治愈潜力的治疗方式。一项回顾性分析显示,高危MDS患者(包括TP53突变MDS)根据供者可用性随机分组,接受移植的患者与非移植方法相比,长期生存显著改善(3年总生存率23% vs. 11%,p=0.04)。因此,对于所有适合移植的患者,alloHCT仍然是“金标准”。
另一方面,鉴于alloHCT的资源密集特性以及高发病率和死亡率,关于其在TP53突变MN中的适用性仍存在激烈讨论。历史上,只有7%–18%的TP53突变MN患者接受了alloHCT(图5A)。在缺乏系统性研究的情况下,低利用率的原因尚属推测,包括年龄较大、虚弱、合并症、并发恶性肿瘤、无法达到理想的移植前反应以及移植后高复发风险。
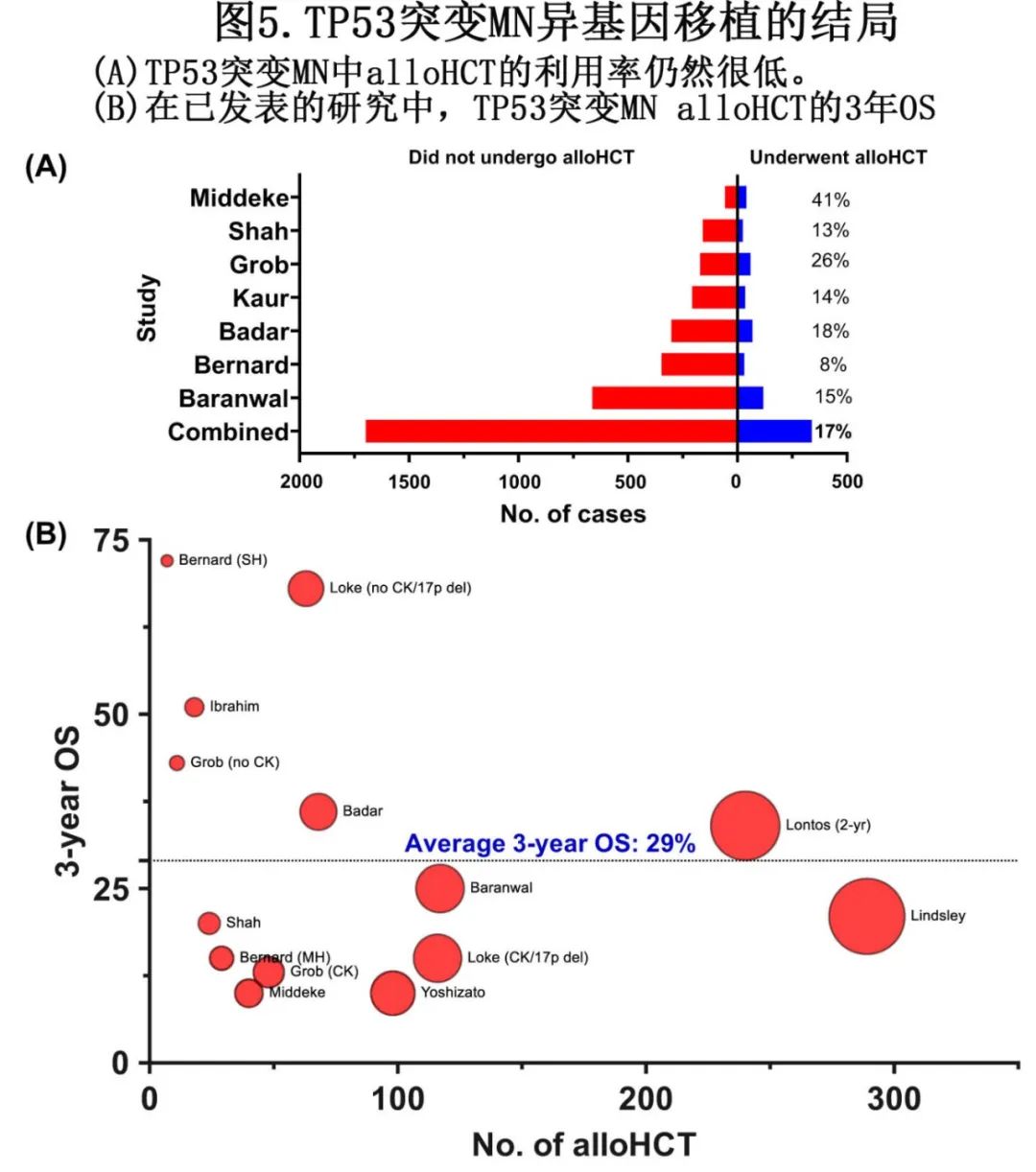
在大多数已发表的研究中,无论MDS或AML表型如何,3年生存率均为10%–15%(图5B)。一项最近的国际多中心研究(美国和澳大利亚的7个移植中心,即将发表)对134例接受alloHCT的TP53突变MN患者进行研究,证实在当代背景下生存率仍较差:移植后中位生存期为1.03年,1年、2年和3年OS分别为51.4%、35.1%和25.1%。多打击TP53失活与非多打击TP53失活相比,3年生存率显著缩短(16.9% vs. 54.9%,p=0.002)。有趣的是,单纯非DBD TP53突变及DNMT3A共突变与3.4倍和2.6倍较低RFS相关。这些结果首次提示了与移植后结局相关的突变和共突变模式,但还需要在独立队列中进行验证。
一项单中心240例MN队列的研究中报告了类似结果。TP53突变MDS和AML的生存率相当,整个队列的2年总生存率为34%。分层分析识别出3个组:生存率最佳的患者为TP53 VAF<50%且未携带CK/5q/7q缺失的患者,其次为TP53突变VAF<50%且携带CK/5q/7q缺失,最差的是TP53突变VAF≥50%且携带CK/5q/7q缺失的患者(2年总生存率分别为60%、22%和3%)。
移植后死亡率和发病率主要由高复发率驱动,因此多项研究试图识别与alloHCT后低复发率相关的因素。遗憾的是,尽管年轻受者年龄、TP53突变VAF<40%、单打击TP53突变、无CK、在首次缓解期接受alloHCT、在移植后第100天达到CR以及中度至重度GVHD的发生与有利生存相关,但尚未形成明确结论。因此,对于alloHCT时的疾病状态和预处理强度的选择是否影响alloHCT后生存,目前仍存在争议。
对于前者,在接受强化疗的TP53突变EB-2/AML患者中,达到MRD阴性与alloHCT后更长生存无关。但在另一项多中心研究中,移植前达到MRD阴性CR也未改善RFS或OS。然而在Hunter等人的研究中,16例接受alloHCT的TP53突变MN患者中,7例在移植前通过NGS证实清除TP53突变,并显示出生存改善的趋势(25.2个月 vs. 11.7个月)。有趣的是,对于移植前清除TP53突变的患者,alloHCT的生存期优于继续使用HMA(25.2个月 vs. 7.7个月);而克隆持续存在的患者的生存期相当(11.7个月 vs. 7.7个月)。如果得到验证,这些研究可能是识别合适候选者的初步步骤。
其次,关于最佳预处理方案的选择仍不确定:尽管部分研究表明使用清髓性预处理(MAC)可降低复发风险,但大多数研究未显示出生存获益。例如,在一项针对TP53突变MDS的CIBMTR研究中,MAC和减低强度预处理(RIC)之间的复发风险和生存率相当;该结论最近被另一项多中心研究所证实。然而其他研究显示,尽管MAC降低复发风险,但增加非复发死亡率,最终生存率仍与RIC方案相当。
最后,两项研究提示以马法兰为基础的预处理方案具有优势。在一项单中心研究中,以马法兰为基础的alloHCT预处理方案用于治疗t-MDS患者,显示出较高的RFS和OS,尽管无法单独评估马法兰的作用。在上述多中心研究中,马法兰的使用与RFS改善相关(风险比0.52,p=0.005)。上述差异可能部分归因于马法兰为基础的预处理方案(几乎仅在RIC背景下使用)的获益仅限于移植前原始细胞比例<5%的病例。
6.1 免疫疗法和新靶点
6.1.1 免疫疗法
免疫疗法在过去十年中已成为肿瘤学领域的焦点。免疫疗法药物依赖于免疫系统固有的能力来检测和清除肿瘤细胞,免疫检查点抑制剂通过阻断T细胞上的抑制性共受体发挥作用,包括程序性细胞死亡(PD)-1、程序性细胞死亡配体(PD-L)1和细胞毒性T淋巴细胞抗原(CTLA)-4抑制剂。这些蛋白是肿瘤细胞免疫逃逸的辅助因子,其受体及其配体的表达在髓系恶性肿瘤中增强,表明可能存在对传统疗法的耐药机制。如上所述,TP53突变MDS具有独特的免疫微环境,从而为在TP53突变AML的治疗中利用免疫疗法提供了可能性。目前正在进行的研究方法包括免疫检查点抑制剂(ICI)、双特异性抗体和双重抗原受体靶向抗体、嵌合抗原受体(CAR)T细胞疗法,以及新的靶点,如T细胞免疫球蛋白和黏蛋白域(TIM)-3抑制剂;干扰素基因刺激因子是该领域的另一种新型治疗方法。
i. ICI。与实体瘤和某些血液系统恶性肿瘤不同,在联合HMA或强化疗时,TP53突变MDS对ICI的敏感性不高。在一项2期研究中,纳武利尤单抗联合阿扎胞苷用于复发/难治性AML患者,其中16例携带TP53突变,TP53突变AML的总缓解率为19%(3/16)。同样,另一项2期试验显示,帕博利珠单抗在37例复发/难治性AML患者中,在高剂量阿糖胞苷后使用是安全的(总缓解率46%,完全缓解率38%,中位OS 11.1个月);在该队列中,5例TP53突变患者中有2例(40%)达到完全缓解。随后,在一项2期试验中,纳武利尤单抗与柔红霉素和阿糖胞苷联合用于44例初治高危MDS/AML患者,包括8例TP53突变MDS患者,CR/CRi率为78%。需要进行前瞻性、随机研究来评估,对于TP53突变AML患者,ICI联合方案是否优于单纯传统化疗。设计这些试验需要更广泛地考虑,因为大多数患者计划接受alloHCT,可能会引发对加重GVHD的担忧。
ii. Sabatolimab是一种针对TIM-3的单克隆抗体。在一项用于AML、高/极高危MDS和慢性髓单核细胞白血病的1b期、多臂、开放标签、多中心研究中,14例可评估的TP53突变患者中,总缓解率为71.4%,4例(28.6%)达到完全缓解,中位缓解持续时间为21.5个月。STIMULUS-MDS1是一项在新诊断高危MDS(包括TP53突变MDS)中进行的多中心、随机、双盲、安慰剂对照、2期研究。在筛选的186例患者中,sabatolimab组36%和安慰剂组33%的患者携带TP53突变。尽管未按TP53突变状态分层报告缓解率或生存率,但主要终点未达到。sabatolimab组和安慰剂组的完全缓解率(22% vs. 18%,p=0.77)和无进展生存期(11.1个月 vs. 8.5个月,p=0.1)相当。最终,3期研究(STIMULUS-MDS2)也未能达到改善OS的主要终点,后终止sabatolimab项目。
iii. CD-47在多种细胞类型中广泛表达,与吞噬细胞上的信号调节蛋白(SIRP)-α相互作用,传递一种抗吞噬的“别吃我(don't-eat-me)”信号。癌细胞中CD47的过表达可以抵消促吞噬信号,从而避免被吞噬。Magrolimab是一种人源化免疫球蛋白G4抗CD47单克隆抗体,通过抑制CD47-SIRPα的相互作用,增强癌细胞的吞噬作用。与阿扎胞苷联合使用时,阿扎胞苷可上调AML细胞上的钙网蛋白,增强“吃我”信号。基于体外和体内临床前数据,magrolimab单药治疗的1期研究(NCT02678338,CAMELLIA研究)在复发/难治性AML中耐受性良好,显示出满意的安全性。随后,针对不适合强化疗的TP53突变AML患者的随机研究中,患者接受magrolimab联合阿扎胞苷(AZA)与研究者选择的方案(ENHANCE-2)进行对比,以及AZA+维奈克拉(VEN)+magrolimab与AZA+VEN进行对比。然而由于计划分析显示无效,magrolimab试验已被终止。同样,其他抗CD47单克隆抗体(如evorpacept,NCT04417517和NCT04755244)的试验也因联合方案“未能显著优于阿扎胞苷单药的历史疗效”而被终止。目前,仍有一项抗CD47抗体联合去甲基化药物的开放性试验正在进行中,用于治疗AML和高危MDS(NCT06008405),显示出对该靶点的持续研究兴趣。
iv. 双特异性抗体、双特异性T细胞衔接器和双重亲和力重定向抗体已用于TP53突变AML的治疗探索。Flotetuzumab是一种靶向CD123和CD3的双重亲和力重定向抗体,通过增强细胞毒性T细胞与AML细胞之间的免疫突触形成(不依赖于主要组织相容性复合体[MHC]通路),在TP53突变AML中显示出良好前景(完全缓解率47%,中位生存期10.3个月)。另一种靶向CD123和CD3的双特异性抗体(APVO436-5001)也在早期临床试验中显示出疗效和安全性。
v. CAR-T细胞疗法:与其他血液系统恶性肿瘤相比,CAR-T疗法在MDS和AML中的发展面临骨髓抑制和CAR-T细胞持久性差等毒性问题。尽管如此,目前仍有多项试验正在探索靶向已知(CD33、CD123)和新型(CLL-1、CD371)靶点以及联合靶点的CAR-T细胞疗法(表4)。
6.1.2新型靶向治疗
i. TP53激活剂:Eprenetapopt(APR-246)是一种新型的、首创的小分子药物,能够恢复TP53突变细胞中野生型p53的功能。在一项1b/2期研究中进行了评估,在55例至少携带一种TP53突变患者(40例MDS,11例AML,4例MDS/MPN)中,总缓解率为71%,其中44%达到CR。在MDS患者中,50%达到CR,58%获得细胞遗传学缓解;AML患者的ORR和CR率分别为64%和36%。有趣的是,缓解者的TP53突变VAF显著降低,其中38%达到分子学完全缓解。中位OS为10.8个月;35%的患者接受了异基因造血干细胞移植,中位OS为14.7个月。基于这些令人振奋的结果,随后开展了一项1期多中心研究,将Eprenetapopt与HMA和维奈克拉联合使用,共纳入49例患者;Eprenetapopt与维奈克拉及阿扎胞苷的联合治疗耐受性良好,ORR为38%。尽管结果令人鼓舞,但由于3期研究显示无效,该药物的进一步开发遗憾地被终止。
ii. 脾酪氨酸激酶抑制剂:脾酪氨酸激酶(Syk)在AML中过表达,其过度活跃与预后不良相关。Entospletinib是一种Syk抑制剂,在BEAT AML研究中与地西他滨联合用于TP53突变或CK AML患者。该方案显示出一定的活性,但由于无效性,研究被终止。
iii. ROS1抑制剂:包括AML在内的多种恶性肿瘤表现出ROS原癌基因1受体酪氨酸激酶的异常表达,使其成为抗癌治疗的可行靶点。TP53缺失的细胞对ROS1抑制剂Entrectinib表现出持续的敏感性。基于这些结果,一项1期研究正在评估Entrectinib联合HMA用于复发/难治性TP53突变AML的治疗。
iv. Nutlin类似物:鉴于MDM2作为TP53的负性调节因子的核心作用,MDM2的小分子抑制剂(如Nutlin类似物)已被探索用于TP53突变MDS和AML。在一项1b期试验中,Idasanutlin联合维奈克拉用于复发/难治性AML患者,10例TP53突变患者中3例出现缓解(无CR),中位DOR和OS分别为2.3个月和3.67个月。在缓解患者中,TP53突变为亚克隆。在停药时,12例患者中检测到25个TP53突变,其中22个为预先存在。MIRROS 3期试验是一项多中心、随机、双盲的3期研究,评估MDM2拮抗剂Idasanutlin联合阿糖胞苷用于复发/难治性AML患者。研究纳入患者时不考虑TP53突变状态,理由是部分TP53突变可能保留野生型TP53功能;约15%的入组患者携带TP53突变。Idasanutlin联合阿糖胞苷与安慰剂联合阿糖胞苷相比,总生存期(中位8.3个月 vs. 9.1个月,p=0.58)、CR率(20.3% vs. 17.1%)和ORR(38.8% vs. 22.0%)均无显著差异。总体而言, MDM2抑制剂可能对TP53突变MDS和AML无效。
上述研究结果突显了TP53突变MDS和AML的治疗挑战,可以得出结论:开发针对TP53突变MDS和AML的有效疗法是当前亟待解决的临床需求。
7.未来方向
科学家和临床医生对TP53突变MDS和AML各方面的持续关注,证明了这一挑战的艰巨性。上述综述突出了在疾病理解方面的进展,但也强调了仍然存在的重大挑战。希望将其作为一个独立的疾病实体加以识别,能够激发研究热情、促进临床试验的入组,并推动药物发现。为此,作者提出以下领域作为优先级最高的方向。
首先,并非所有TP53突变CH都会进展为MDS或AML,其典型的潜伏期通常超过5年。TP53突变克隆在没有白血病转化的情况下可能保持稳定,且TP53突变CH/CCUS与TP53突变MDS/AML之间的预后截然不同,共同突显了对白血病转化相关因素进行特征描述的迫切需求。具体而言,生物标志物的可用性将有助于识别高危患者,并指导监测策略。对于携带TP53突变CH的患者这一点尤为重要,因为他们需要接受非相关恶性肿瘤的细胞毒性治疗,这是需要知情的。最终,在获得双等位基因TP53失活和白血病转化之前,通过早期干预(如抢先性alloHCT)或可改善预后。
其次,未来的TP53突变MDS/AML分类或将纳入新的证据。目前的诊断标准旨在克服自信地分配双等位基因丢失的技术限制,需要使用“假定双等位基因”或“多打击当量”等替代物。在未来,纳入WES/ WGS或优先进行单细胞研究,将有助于定位起源细胞,并在白血病细胞中定位双等位基因TP53改变。尽管这些技术已经可用,但全球采用的分类必须在可行性(可用性、人员需求、周转时间和成本)与准确性之间取得平衡。
第三,随着NGS的普遍使用和灵敏度的逐步提高,临床医生可能会遇到一些意义不明的小TP53突变克隆。目前报告预后的研究中使用不同的TP53突变VAF阈值(范围从1%到20%),需要进一步明确是否有一个最佳的TP53突变VAF,能够可靠地区分CH/CCUS和MDS/AML,以及区分预后不良的患者。
最后,虽然这可能显而易见,但最终的进展将通过提供安全、有效且持久的治疗来衡量。整体方法将包括尽早开始治疗并实现更高的缓解率——这可能增加适合移植的患者数量。
参考文献
Shah, M.V., Arber, D.A. and Hiwase, D.K. (2025), TP53-Mutated Myeloid Neoplasms: 2024 Update on Diagnosis, Risk-Stratification, and Management. Am J Hematol. https://doi.org/10.1002/ajh.27655

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#TP53突变# #髓系肿瘤#
7