NCB:北京协和医学院马艳妮/余佳等表明PABPC1相分离的选择性翻译控制调节慢性髓性白血病的急变和治疗抵抗
2025-03-20 iNature iNature 发表于陕西省
该研究表明PABPC1相分离的选择性翻译控制调节慢性髓性白血病的急变和治疗抵抗。
靶向BCR-ABL1融合酪氨酸激酶的酪氨酸激酶抑制剂(TKIs)彻底改变了慢性髓性白血病(CML)的治疗。然而,TKI耐药性的发展以及随后从慢性期(CP)向急变期(BC)的转变威胁着CML患者。越来越多的证据表明,翻译控制是至关重要的癌症进展。
2025年3月18日,北京协和医学院马艳妮、余佳、Wang Xiaoshuang、中山大学赵萌共同通讯在Nature Cell Biology在线发表题为“Selective translational control by PABPC1 phase separation regulates blast crisis and therapy resistance in chronic myeloid leukaemia”的研究论文,该研究表明PABPC1相分离的选择性翻译控制调节慢性髓性白血病的急变和治疗抵抗。

针对BCR-ABL1(ABL1癌基因和BCR看家基因之间易位的产物)的酪氨酸激酶抑制剂(TKIs)的开发,有效地控制了慢性髓细胞白血病(CML)的慢性期(CP),使约80%的CML患者避免了向急变(BC)的转变,持续了十多年。然而,大约25%的患者对TKI疗法有抵抗或不耐受,导致大量的BC进展。CML-BC患者缺乏有效的治疗使他们的中位生存期减少到不到一年。
慢性粒细胞白血病进展的主要决定因素是BCR-ABL1不受限制的活性,通常是由于TKI耐药或BCR-ABL1表达增加。过度活跃的BCR-ABL1导致基因组不稳定和次级遗传异常的积累,随后促进CML的BC转化。然而,在CML进展过程中控制BCR-ABL1表达和活性的因素仍然难以捉摸。在CML-BC患者中观察到的最常见的继发性遗传事件包括费城染色体扩增、8三体和针对肿瘤抑制基因TP53和发育不全相关转录因子RUNX1基因的突变。尽管这些遗传异常是异质性和个体化的,但是基于多个基因表达的信号可以准确区分CP和BC,这表明这些个体遗传异常的累积可能导致CML转录组的共同扰动。
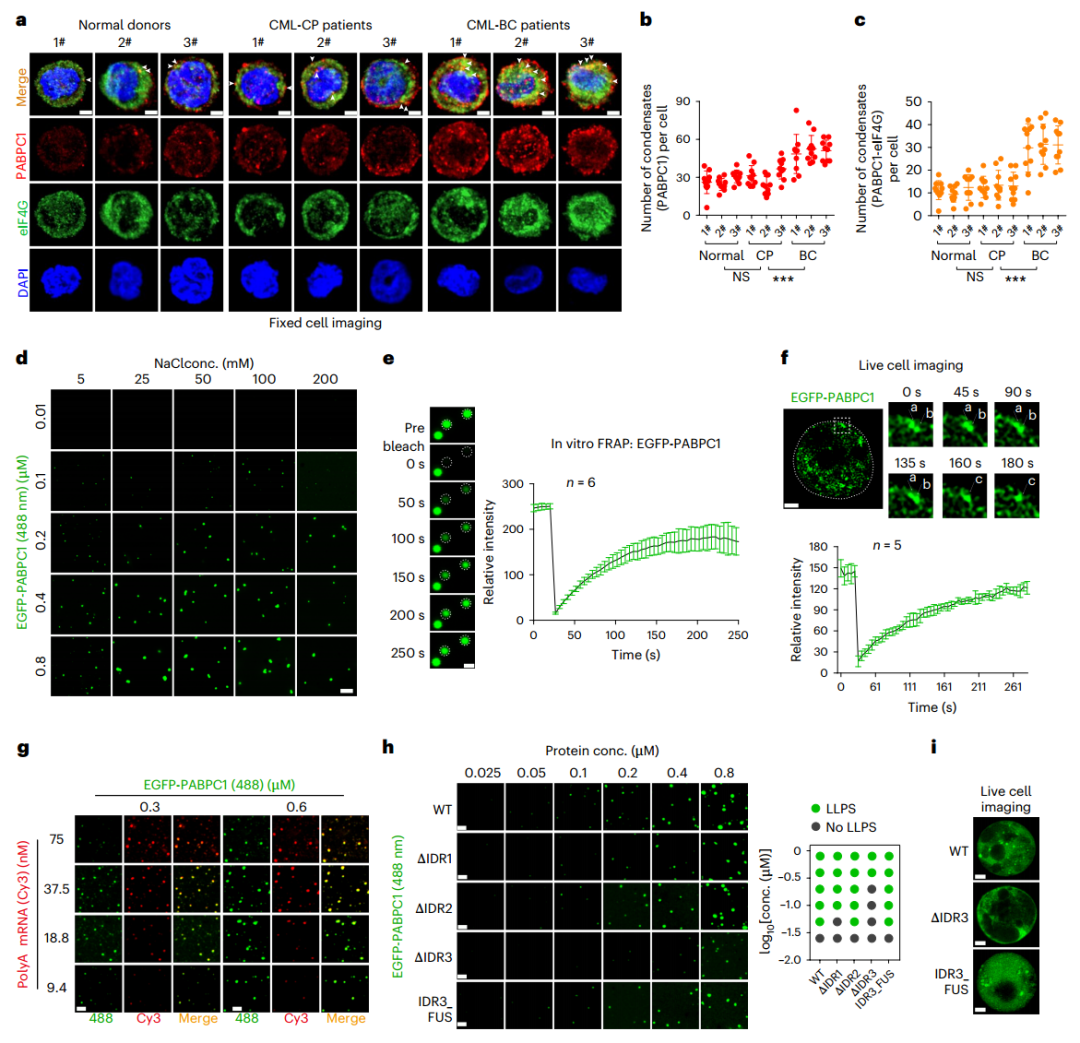
PABPC1经历相分离形成凝聚体,以实现CML-BC中的稳定翻译(图源自Nature Cell Biology )
翻译控制实质上有助于基因表达。例如,在小鼠胚胎成纤维细胞中只有40%的蛋白质的水平差异直接归因于它们的mRNA水平。翻译的起始、延伸和终止受到核糖体及其相关因子(如RNA结合蛋白(RBPs))之间相互作用的严格调控。越来越多的证据表明,翻译控制通过影响一般蛋白质合成和某些mRNA的选择性翻译在癌症发展中起着重要作用,因此翻译的靶向已经用于癌症治疗。然而,它在慢粒进展中的作用却知之甚少。
该研究确定多聚(A)结合蛋白胞质1(PABPC1)是BC期CML进展的驱动因素。PABPC1通过形成生物分子缩合物优先提高具有长且高度结构化的5’非翻译区的多种白血病原性mRNAs的翻译效率。抑制PABPC1可显著抑制CML细胞增殖,减缓疾病进展,对正常造血功能影响极小。此外,还鉴定了两种PABPC1抑制剂,它们抑制小鼠和人类CML中的BC进展并克服TKI耐药性。总的来说,该工作确定PABPC1是CML-BC中的一种选择性翻译增强因子,其遗传或药物抑制作用克服了TKI耐药性并抑制了BC进展。
参考信息:
https://www.nature.com/articles/s41556-024-01607-4#Sec54

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#慢性髓性白血病# #PABPC1#
9