南京大学郭子建/陈韵聪团队《JACS》:非氧依赖型光催化剂诱导细胞铁死亡/焦亡/胀亡协同作用以增强肿瘤免疫治疗
2025-03-23 BioMed科技 BioMed科技 发表于陕西省
该论文将FDA获批的亚甲基蓝(MB)光敏剂进行简单结构改造,构建了一种非氧依赖型生物光催化剂EBSe,团队对该化合物进行了深入的细胞作用机制验证和抗肿瘤免疫研究。
近日,南京大学化学化工学院郭子建/陈韵聪研究团队在J. Am. Chem. Soc. 杂志发表了题为“Photo-induced Synergism of Ferroptosis/Pyroptosis/Oncosis by An O2-Independent Photocatalyst for Enhanced Tumor Immunotherapy”的研究论文,该论文将FDA获批的亚甲基蓝(MB)光敏剂进行简单结构改造,构建了一种非氧依赖型生物光催化剂EBSe,团队对该化合物进行了深入的细胞作用机制验证和抗肿瘤免疫研究。

【文章要点】
传统光动力治疗(PDT)受限于II型光敏剂的氧依赖性(需持续O₂供应生成单线态氧)、乏氧肿瘤细胞凋亡抵抗以及乏氧诱导的免疫抑制微环境,导致对缺氧实体瘤疗效显著降低。本研究通过硒掺杂-乙基修饰的分子工程策略,创新性地开发了一种近红外生物光催化剂EBSe,EBSe对4T1细胞光毒性相对于亚甲基蓝MB显著提升(>2500倍)且具有优异的光毒性指数(PI >32000)。EBSe表现出自适应的光动力过程,即在常氧下产生增强的I型/II型ROS,在乏氧时产生活泼的碳自由基。更重要的是,EBSe显示出更高的细胞摄取并选择性定位于溶酶体。经660 nm光照后从溶酶体向细胞核转移,并激活铁死亡、细胞焦亡和胀亡,这三种非凋亡途径的协同作用增强了荷瘤小鼠的抗肿瘤免疫效应。这项工作为开发强大的光敏剂(PSs)提供了一种可靠的策略,以克服缺氧肿瘤的凋亡抵抗和免疫抑制微环境。

图1.(a) EBSe的设计策略及自适应光催化过程;(b) EBSe的作用机制及免疫激活过程
团队首先对四种光敏剂(MB、EB、MBSe 和 EBSe)的吸收/发射光谱以及光物理/光化学特性进行了测试。在甲醇中,EBSe的吸收和发射光谱(λex = 662 nm,λem = 694 nm)相较于MB(λex = 652 nm,λem = 680 nm)略有红移。此外,EB与EBSe的摩尔消光系数明显高于MB和MBSe,且具有良好的化学稳定性。EB和EBSe的LogP值明显高于甲基取代衍生物MB和MBSe,这与EB和EBSe在PBS溶液中形成更多的H-二聚体的现象相一致。上述结果可能归因于二乙胺基相较于二甲胺基具有更强的给电子能力及更高的亲脂性。MBSe与EBSe的单线态氧量子产率分别达到85%和81%,显著高于MB(52%)和EB(57%)。这些结果主要归因于重原子Se的引入提高了系间窜越(ISC)效率。此外,密度泛函理论(DFT)计算结果进一步显示EBSe相比MB具有明显更大的自旋轨道耦合(SOC)常数及更高的系间窜越速率。本研究还评估了四种光敏剂在PBS(pH = 7.4)溶液中的I型ROS生成能力,结果表明,EBSe在O2•- 和•OH的生成能力上均表现出最优异的性能。随后,采用电子自旋共振(EPR)测量了各化合物光诱导的ROS生成能力。相较于MB、EB和MBSe,EBSe显示出最高的活性氧EPR信号。同时,在常氧条件下,EBSe在PBS溶液中表现出最强的•OH信号,并伴随有明显的碳中心自由基信号,在缺氧条件下(氧浓度<1%,真空手套箱中),水溶液中碳自由基的EPR信号占据主导地位。值得注意的是,在缺氧条件下EBSe产生的碳自由基信号相对稳定,当溶液重新暴露于空气中时,这些碳自由基能够逐渐转化为O2•-和•OH。此外,在近红外(NIR)照射下,四种光敏剂均能够光氧化NADH和四氢蝶呤(BH4),其中EBSe表现出最高的氧化效率。
基于以上研究,作者提出了EBSe(EBSe+)的光催化作用机制:在近红外光激发下,EBSe从基态跃迁至单重激发态(1EBSe+*),1EBSe+*通过系间窜越到三重激发态(3EBSe+*)。在常氧条件下,3EBSe+*可以将能量转移给周围的氧分子生成单线态氧(1O2)。与此同时,由于EBSe比MB具有更高的亲脂性并更易形成H-聚集体,使得3EBSe+*能够与基态分子EBSe+进行电子转移生成EBSe2+•和EBSe•,纳秒和飞秒级瞬态吸收泵浦探测光谱也验证了该类碳自由基的存在。在细胞环境中,3EBSe+*可以从NADH等还原性生物分子中获得电子,从而在无氧条件下产生EBSe•, EBSe•可进一步还原氧分子生成O2•-和•OH。循环伏安法显示EBSe+/EBSe•的还原电位(-0.72 V vs NHE)比O2/O2•-(-0.33 V vs NHE)和O2/•OH(0.31 V vs NHE,pH = 7.0)更负。这些结果表明EBSe具有自适应光催化特性,在常氧和缺氧条件下均能产生具有细胞杀伤作用的ROS和碳自由基。
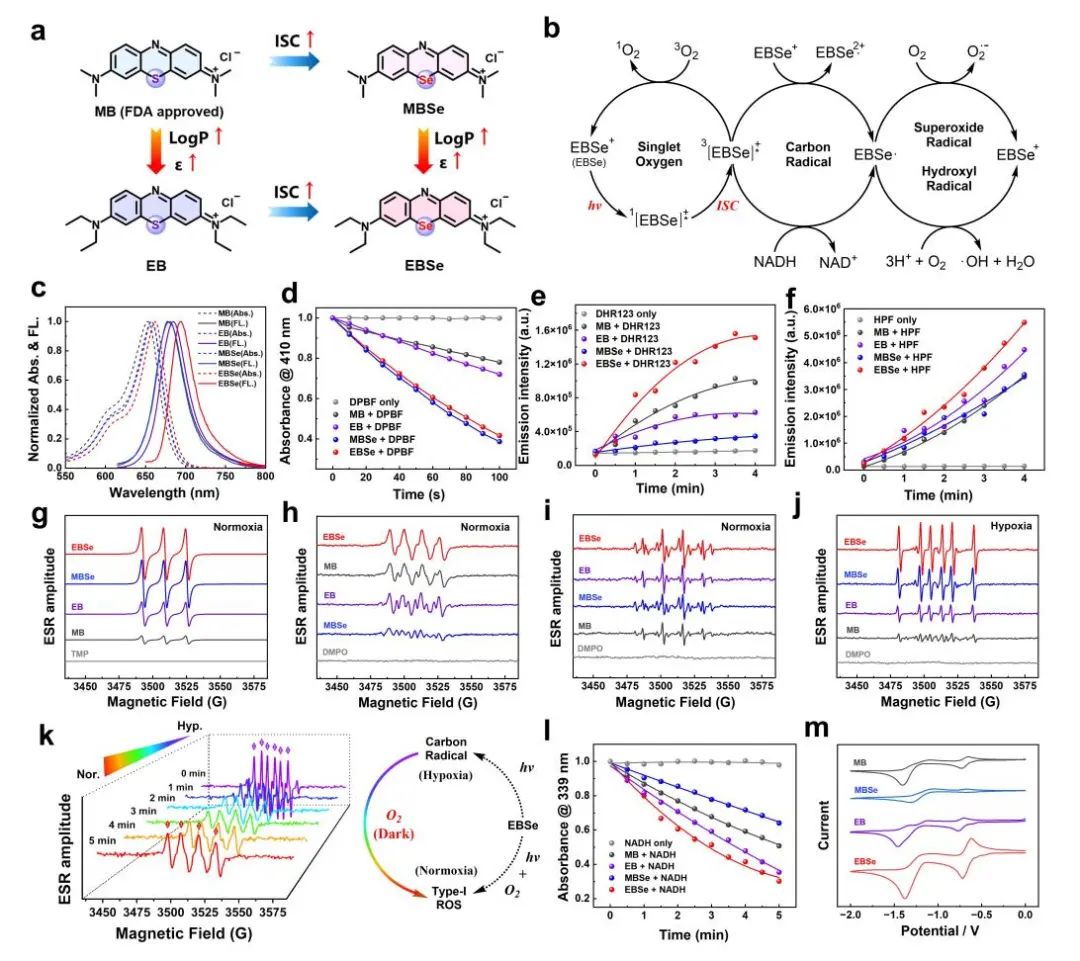
图2. (a) 硒掺杂-乙基修饰的分子工程策略设计EBSe; (b)光催化过程;(c) 吸收/发射光谱;(d-f) 1O2、O2•-与•OH的检测;(g-j)常氧或乏氧下各化合物产生ROS以及碳自由基的EPR图谱;(K) 从乏氧到常氧环境下,碳自由基转换成ROS的时间依赖图;(l) 光催化NADH比较图;(m) 各光敏剂循环伏安图。
四种光敏剂(MB、EB、MBSe 和 EBSe)对4T1细胞均表现出极低的暗毒性(IC50 > 512 μM),说明对MB进行的微小结构修饰保持了优异的生物安全性。在660 nm光照下,MB在常氧条件下表现出中等程度的光毒性(IC50 = 9.2 μM),但在缺氧条件下光毒性显著降低(IC50 = 40.2 μM)。而EBSe在常氧(IC50 = 0.014 μM)和缺氧条件下(IC50 = 0.016 μM)均表现出极其优异的光毒性。与MB相比,EBSe在缺氧条件下对4T1细胞光毒性的提高超过了2500倍,对氧气依赖性极低,且光毒性指数PI(即暗毒性与光毒性之比)在常氧条件下超过36000,在缺氧条件下超过32000。这些结果表明,引入硒原子或乙基这两种修饰所产生的协同效应极大地提高了PDT性能。
为了深入探讨EBSe显著提升PDT性能的机制,团队成员对4T1细胞中的光敏剂摄取情况以及其引起的细胞损伤进行了详细研究。因具有更高的LogP值,乙基取代的EB和EBSe的细胞摄取效率显著高于相应的甲基取代衍生物,且EBSe通过质子泵及胞吞作用进入细胞。通过共聚焦细胞实验可知,EBSe在光照条件下以非氧依赖方式高效杀伤4T1细胞,而MB在缺氧条件下的杀伤效果则明显降低。随后,通过激光共聚焦荧光成像进一步研究了EBSe的亚细胞定位。在未进行光照前,EBSe主要富集在溶酶体(PCC=0.85),在光照处理后,EBSe与LysoTracker染色图像的重叠度显著降低(PCC=0.20),同时与Hoechst 33342细胞核的染色(PCC=0.72)显著增加。这些结果表明,EBSe在光照下能够严重损伤溶酶体,并转移至细胞核,对核酸造成直接损伤。同样地,MBSe、MB和EB在10分钟光照处理后也出现了类似从溶酶体迁移至细胞核的现象。同时,EBSe在无氧条件下可直接有效地造成DNA损伤。综上所述,EBSe在NIR光照下可引起溶酶体及细胞核的级联损伤效应。
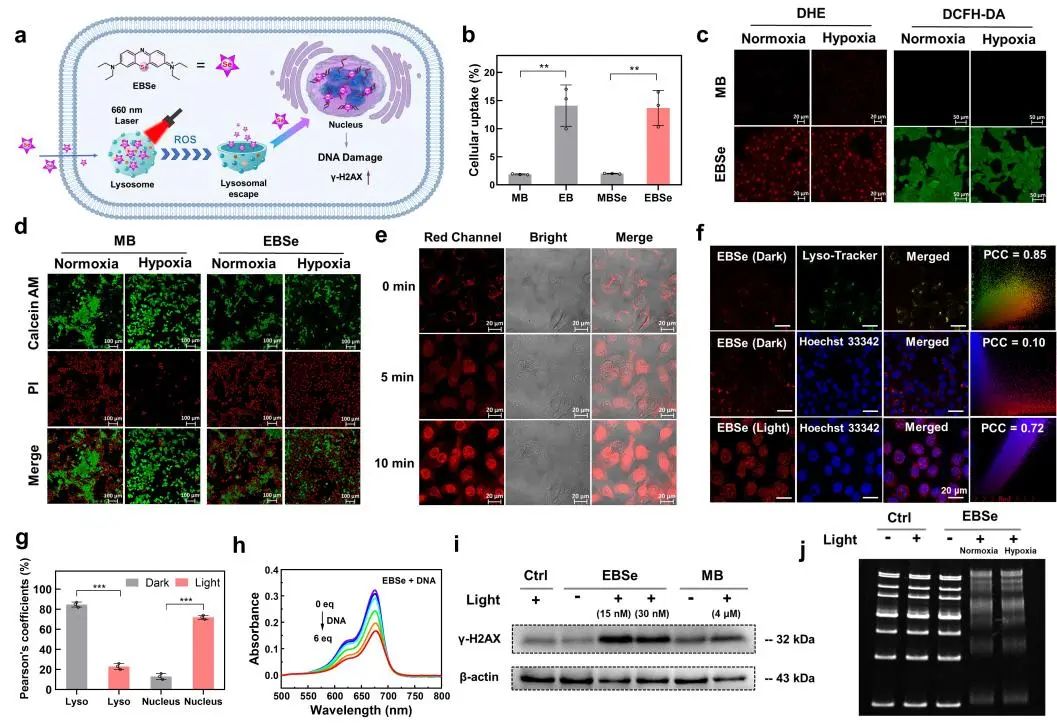
图3. (a) EBSe在近红外光诱导下从溶酶体向细胞核的迁移示意图;(b) 细胞摄取效率;(c) 细胞内O2•-及ROS检测共聚焦图;(d) 活死细胞染色共聚焦图;(e) 光诱导EBSe在细胞内迁移共聚焦图;(f-g) 细胞器共定位图及共定位系数;(h) 添加不同浓度的DNA片段后EBSe的吸收光谱; (i) 细胞中DNA损伤特征蛋白γ-H2AX水平的WB印迹分析;(j) 凝胶电泳检测EBSe在光照射后对DNA的光氧化损伤。
为了进一步探索EBSe从溶酶体向细胞核迁移所引起的一系列效应,本文选择MB作为对照化合物进行了深入探索。研究发现,EBSe以较低浓度即可引起溶酶体膜通透性(LMP)增加,释放H+与Fe2+造成胞内H+与Fe2+显著升高,同时胞内谷胱甘肽过氧化物酶4(GPX4,一种关键的铁死亡抑制蛋白)和谷胱甘肽(GSH,胞内抗氧化剂)水平明显下调。以上结果表明EBSe光诱导了细胞铁死亡。同时,焦亡抑制剂四乙基秋兰姆二硫化物(TETD)也能部分恢复EBSe光照处理的细胞存活率,表明细胞也发生了焦亡途径,即caspase-1及GSDMD表达下降,而GSDMD-N片段表达显著增加。经光照处理孵育了EBSe+的细胞培养基上清液中IL-1β、IL-18细胞因子水平明显升高,ATP和乳酸脱氢酶(LDH)释放也显著增加。此外,TEM及荧光成像发现,经EBSe+光照处理后的细胞表现出典型的肿胀死亡形态特征,包括线粒体及内质网肿胀、染色质异常凝聚和胞质空泡化。受损的内质网释放钙离子导致胞质钙水平升高,光照处理后线粒体膜电位显著下降,胞内ATP水平也显著降低,表明线粒体功能受损、氧化磷酸化受到抑制。Western blot结果显示,经EBSe光照处理后的细胞中,胀亡的标志性跨膜蛋白Porimin表达显著上调,同时线粒体钙蛋白酶1(calpain 1)也明显激活,而促凋亡蛋白Bax则受到显著抑制,导致Bcl-2/Bax比值升高,凋亡途径受抑制。以上结果充分表明,EBSe产生的PDT效应能诱导肿瘤细胞发生铁死亡、焦亡和胀亡多种非凋亡细胞死亡途径,有效克服缺氧肿瘤的凋亡耐受性,并显著激活针对肿瘤细胞的免疫反应。
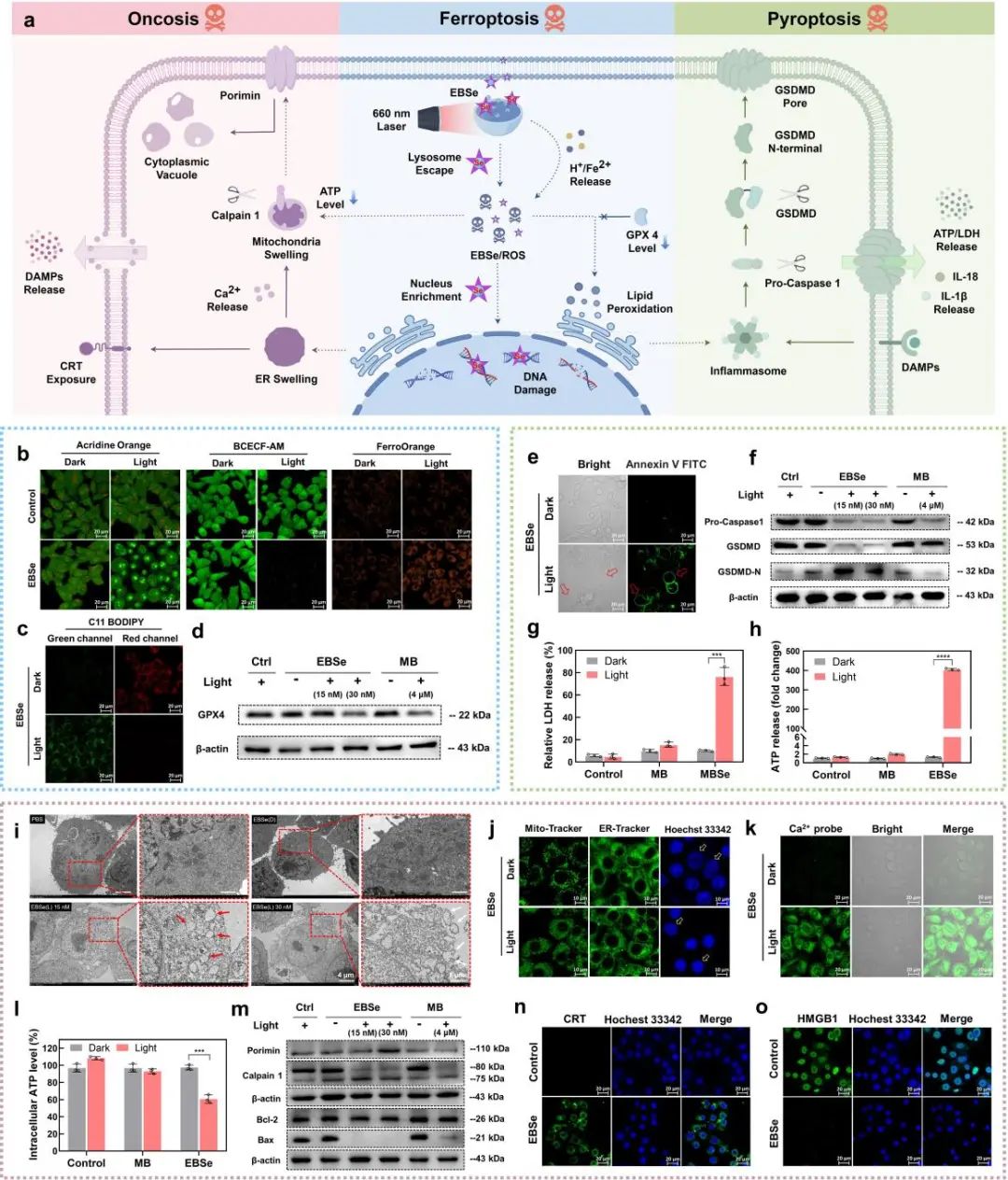
图4. (a) EBSe的PDT过程诱导多种细胞死亡途径示意图;(b-d) EBSe光诱导细胞发生铁死亡相关验证;(e-h) EBSe光诱导细胞发生焦亡相关验证;(i-o) EBSe光诱导细胞发生胀亡相关验证。
基于EBSe在体外PDT实验中优异的抗癌细胞性能,作者进一步在4T1荷瘤小鼠模型中评价了其体内抗肿瘤光疗和协同免疫治疗效果。首先,根据活体成像系统(IVIS)检测了瘤内注射MB和EBSe的荧光信号变化,以确定给药和光照时间。“EBSe+光照”组小鼠肿瘤体积明显小于其他组,肿瘤抑制率(TGI)达到72.4%,而“MB+光照”组的TGI仅为34.0%,证明EBSe介导的PDT对于缺氧肿瘤的生长抑制更为有效。随后,在双侧皮下种植4T1肿瘤的小鼠模型中评价了EBSe和MB的光诱导肿瘤免疫治疗效果。经过两周光照治疗后,EBSe组小鼠肿瘤体积显著减少,其中原发瘤和远端瘤的肿瘤抑制率分别达到68.2%和75.6%。相比之下,MB组对原发瘤和远端瘤的肿瘤抑制率分别仅为38.2%和25.5%。流式细胞术分析显示,EBSe处理组小鼠淋巴结中成熟树突状DCs细胞(CD11c/MHC II)比例达到40.19%,比MB组和PBS组分别提高了3.4倍和3.7倍;EBSe组中毒性T淋巴细胞(CD8+)细胞占比达10.44%,辅助性T细胞(CD4+)占比则从PBS组的7.89%提升至23.14%,MB组为13.17%。此外,小鼠血清炎症因子检测显示,EBSe组促炎因子(TNF-α、IFN-γ和IL-6)表达升高,而抑制性因子IL-10则明显下降。以上结果表明,EBSe可光消融缺氧肿瘤并激活系统免疫反应方面明显优于MB,为缺氧肿瘤的治疗提供了一种强有力的工具。
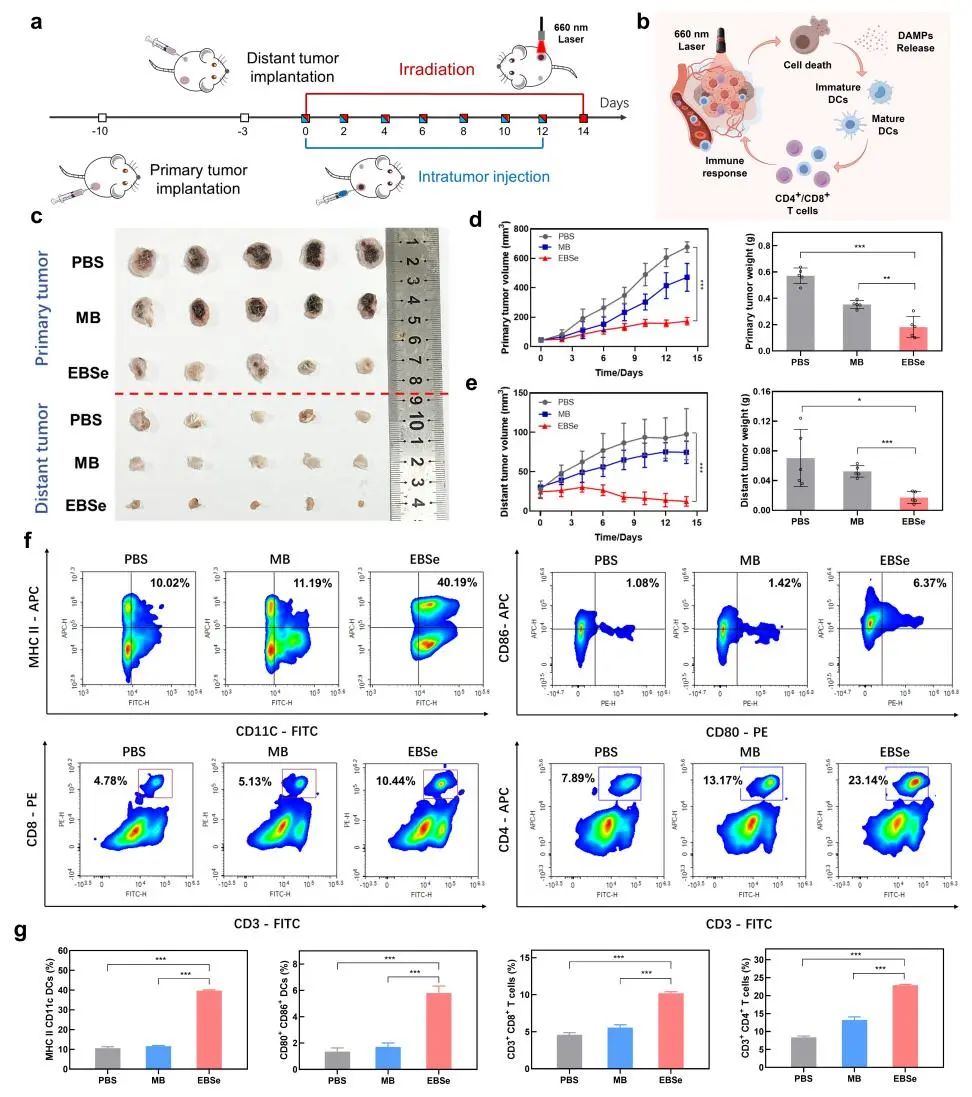
图5. (a-b) 体内抗肿瘤PDT和免疫反应评估示意图;(c) 治疗和手术切除后原发性和远端肿瘤的照片;(d-e) PDT治疗期间和治疗后原发性和远端肿瘤的体积和重量;(f-g) PDT治疗后不同组小鼠肿瘤和淋巴结中免疫指标流式细胞术检测。
【结论与展望】
总之,该研究构建了一种非氧依赖型的光敏剂EBSe,可通过近红外光照射诱导肿瘤细胞同时发生铁死亡、焦亡和胀亡,有效激活针对乏氧肿瘤细胞的免疫反应。对亚甲蓝(MB)进行简单的硒取代和乙基化修饰,使EBSe具备了更高的三重态量子产率和亲脂性,从而在缺氧条件下对4T1细胞表现出显著增强的光毒性(提高>2500倍)以及极高的光毒性指数(PI>32000)。EBSe具有自适应光催化能力,即在常氧条件下能高效地产生Ⅰ型/Ⅱ型ROS,而在缺氧条件下产生碳自由基。此外,EBSe主要富集于溶酶体,并在光照作用下引发溶酶体功能障碍与膜通透性增加,随后迁移至细胞核,造成DNA损伤。这些由PDT诱导的细胞器损伤激活了包括焦亡、铁死亡及胀亡在内的多种非凋亡细胞死亡通路,协同诱发了4T1荷瘤小鼠强烈的抗肿瘤免疫反应。该研究为开发高性能、临床转化潜力的缺氧肿瘤光催化剂提供了可靠的策略,同时也为其他光催化领域的应用提供了重要的参考价值。
南京大学化学化工学院博士后姚善昆与博士研究生徐风梧为论文共同第一作者,指导老师为郭子建院士和陈韵聪教授。作者特别感谢南京林业大学的刘志鹏教授与湖州师范学院的尚积祯教授,以及参与该工作的同学所提供的帮助。
原文链接:
https://pubs.acs.org/doi/full/10.1021/jacs.4c17268

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#肿瘤免疫治疗# #光催化剂#
8