Nat Cancer:中国学者发布小分子ZYS-1靶向ADAR1为前列腺癌治疗带来新希望
2025-02-27 MedSci原创 MedSci原创 发表于陕西省
前列腺癌目前缺乏有效的治疗手段。该研究揭示了腺苷脱氨酶ADAR1在前列腺癌(PCa)中的关键作用,并开发了一种具有显著抗肿瘤效果的小分子抑制剂ZYS-1,为免疫治疗的联合应用提供了新的思路。
前列腺癌(Prostate Cancer, PCa)是全球男性中最常见的恶性肿瘤之一,也是癌症相关死亡的第二大原因。尽管患者对雄激素信号治疗(如雄激素剥夺治疗)有初始反应,但大多数前列腺癌最终会复发并进展为去势抵抗性前列腺癌(CRPC),目前缺乏有效的治疗手段。因此,探索新的治疗靶点和策略对于改善前列腺癌患者的预后至关重要。
近年来,RNA编辑作为一种重要的转录后修饰过程,逐渐成为癌症研究的热点。腺苷脱氨酶(ADAR)家族通过将腺苷(A)转化为肌苷(I),在多种生物学过程中发挥关键作用。ADAR1是该家族的重要成员,其在多种癌症中的作用已被广泛研究,但在前列腺癌中的具体功能尚不清楚。此外,ADAR1在肿瘤免疫微环境中的作用也尚未被充分探索。
近日,中国药科大学杨鹏教授、肖易倍教授、郝海平教授、王晓助理研究员及南京医科大学姜玉章副教授等团队在Nature Cancer杂志上发表重要研究成果,该研究揭示了腺苷脱氨酶ADAR1在前列腺癌(PCa)中的关键作用,并开发了一种具有显著抗肿瘤效果的小分子抑制剂ZYS-1。题目为“Targeting ADAR1 with a small molecule for the treatment of prostate cancer”。该研究不仅为前列腺癌治疗提供了新的靶点,还为免疫治疗的联合应用提供了新的思路。

研究团队首先分析了TCGA数据库中498例前列腺癌样本和51对配对的肿瘤与正常组织样本,发现ADAR1在前列腺癌组织中的表达显著高于正常组织,并与高风险、高Gleason评分和不良生存预后相关。这表明ADAR1可能是一个潜在的前列腺癌预后标志物和治疗靶点。
研究者在DU-145、VCaP和22Rv1等前列腺癌细胞系中敲低(KD)或敲除(KO)ADAR1,发现ADAR1的缺失显著抑制了前列腺癌细胞的增殖、迁移和侵袭能力,并导致细胞周期停滞在G0/G1期,同时增加了细胞凋亡率。这些结果表明ADAR1在前列腺癌细胞的生长和侵袭中发挥着关键作用。
通过全转录组测序(RNA-seq),研究者发现ADAR1缺失的细胞中,I型干扰素(IFN)信号通路相关基因显著上调,而MYC信号通路则被下调。这表明ADAR1可能通过抑制IFN信号通路来促进前列腺癌的发展。进一步的实验表明,ADAR1的缺失能够激活IFNα和IFNγ反应,增强抗肿瘤免疫反应。
研究者通过多组学分析发现,ADAR1能够结合并编辑MTDH mRNA的3'非翻译区(3'UTR),从而影响MTDH蛋白的表达。MTDH(Metadherin)是一种已知的促癌蛋白,与肿瘤的增殖和侵袭密切相关。研究结果表明,ADAR1通过其脱氨酶活性编辑MTDH mRNA的3'UTR,从而促进MTDH蛋白的翻译。ADAR1的缺失导致MTDH蛋白水平显著下降,而MTDH的过表达则能够部分恢复ADAR1缺失引起的细胞增殖和侵袭能力的抑制。这表明MTDH是ADAR1在前列腺癌中的关键下游靶点。
基于ADAR1的结构模型,研究者通过虚拟筛选和结构优化,发现了一种小分子抑制剂ZYS-1。ZYS-1能够直接结合ADAR1,并抑制其脱氨酶活性,其半抑制浓度(IC50)低至0.946 μM。通过表面等离子共振(SPR)和药物亲和力响应靶标稳定性(DARTS)等实验,研究者验证了ZYS-1与ADAR1的直接结合能力,并评估了其对ADAR1脱氨酶活性的抑制效果。
在多种前列腺癌细胞系中,ZYS-1表现出显著的抗增殖活性,同时对正常细胞系的影响较小。ZYS-1处理的细胞显示出明显的细胞周期停滞和凋亡增加,且细胞迁移和侵袭能力显著下降。此外,ZYS-1还能够降低MTDH蛋白水平,同时激活IFN信号通路,表明其通过抑制ADAR1发挥抗肿瘤作用。
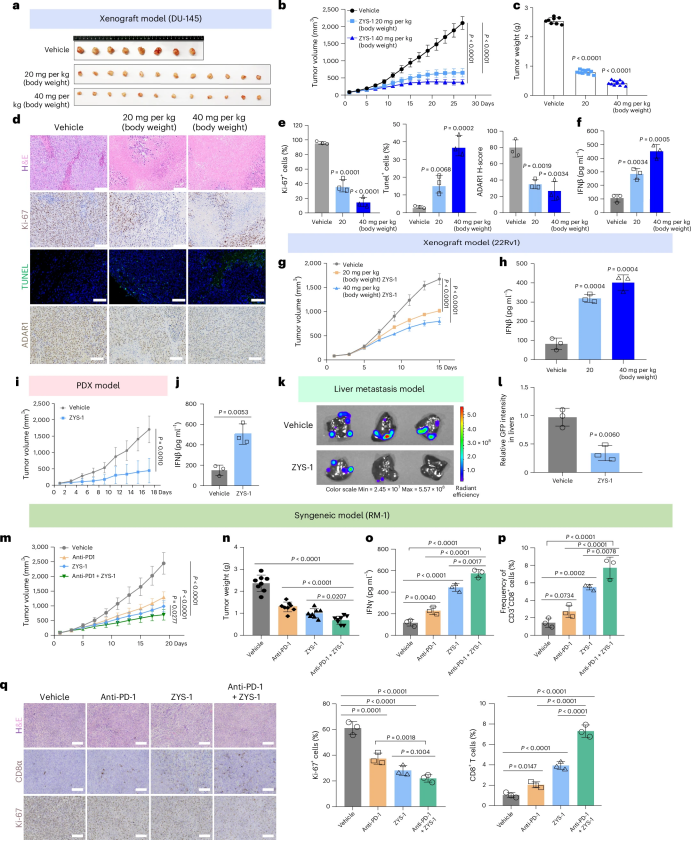
图 ZYS-1具有抗肿瘤功效,在体内激活IFN信号传导
研究者在前列腺癌异种移植瘤小鼠模型和患者来源的异种移植瘤(PDX)模型中评估了ZYS-1的抗肿瘤效果。结果显示,ZYS-1能够显著抑制肿瘤生长,且具有良好的安全性。在DU-145和22Rv1异种移植瘤模型中,ZYS-1处理的小鼠肿瘤生长抑制率(TGI)分别达到66.68%和81.83%。此外,ZYS-1还能够激活肿瘤内的I型干扰素信号通路,增强抗肿瘤免疫反应。
研究进一步发现,ZYS-1与免疫检查点抑制剂(如抗PD-1抗体)联合应用时,能够显著增强抗肿瘤效果。在RM-1前列腺癌小鼠模型中,联合治疗组的肿瘤生长抑制率(TGI)达到71.4%,显著高于ZYS-1单药治疗组(59.7%)和抗PD-1单药治疗组(47.3%)。此外,ZYS-1处理的肿瘤组织中IFNγ分泌和CD8+ T细胞浸润显著增加,表明ZYS-1通过激活免疫反应增强了免疫治疗的效果。
综上所述,这项研究首次揭示了ADAR1在前列腺癌中的促癌机制,并开发了首个针对ADAR1的小分子抑制剂ZYS-1。ZYS-1不仅在体外和体内模型中展现出显著的抗肿瘤效果,还通过激活IFN信号通路增强了抗肿瘤免疫反应。更重要的是,ZYS-1与免疫检查点抑制剂的联合应用展现了强大的协同抗肿瘤潜力,为前列腺癌的精准治疗提供了新的策略。
原始出处:
Targeting ADAR1 with a small molecule for the treatment of prostate cancer. Nat Cancer. 2025 Feb 10. doi: 10.1038/s43018-025-00907-4. Epub ahead of print. PMID: 39930013.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#前列腺癌# #肿瘤免疫治疗# #小分子抑制剂# #ADAR1#
9