Fcγ受体与免疫调节抗体:从机制到临床的全面解析
18小时前 小药说药 小药说药 发表于陕西省
本文介绍 Fcγ 受体结构、与 IgG 亚型关系、免疫调节作用,阐述临床药物中 Fc 工程化策略及各靶点抗体应用情况,指出其为精准免疫治疗提供新维度。
-01-
导读
近年来,肿瘤免疫治疗的突破让“免疫检查点抑制剂”成为公众关注的焦点。但许多人可能不知道,这些抗体药物的疗效不仅取决于其靶向结合能力,还与一个关键结构——Fcγ受体(FcγR)密切相关。
Fc–FcγR相互作用对肿瘤靶向抗体的活性至关重要,如利妥昔单抗、曲妥珠单抗和西妥昔单抗,其中肿瘤细胞的杀伤至少部分是由于这些机制。然而,我们对这些免疫调节抗体的这些相互作用如何增强抗肿瘤免疫的理解仍然知之甚少。因此,进一步了解评估IgG亚类、遗传多态性的影响,以及这些抗体作用机制的临床前和临床研究之间的转化,有助于我们进一步提高这些治疗药物的疗效。
-02-
什么是Fcγ受体?
抗体是免疫球蛋白超家族的成员,在结构上由两个结构域组成:负责抗原识别的结合结构域(Fab)和与Fc受体(FcRs)结合的Fc结构域。Fab包括轻链和重链的互补决定区(CDR),该互补决定区包含六个决定抗原识别的高可变区。Fc区由重链α链、δ链、ε链、γ链或μ链组成,分别存在于IgA、IgD、IgE、IgG和IgM中,定义了抗体同种型。FcRs有三种类型:I型,包括典型的Fcγ受体;II型,其含有C型凝集素受体如CD209和CD23;以及分别负责维持抗体半衰期和降解的细胞内受体新生Fc受体(FcRn)和TRIM-21。
FcγRs是一个结合单体和免疫复合物IgG的受体家族,可引发激活或抑制功能。这些受体参与驱动抗体效应器功能,包括抗体依赖性细胞毒性(ADCC)和/或抗体依赖性胞吞噬作用(ADCP)、抗原呈递以及趋化因子和细胞因子的释放。
在人和小鼠中,有三个受体家族。其中包括FcγRI(CD64)、FcγRII(CD32)和FcγRIII(CD16)。小鼠表达这三种受体,以及独特的高亲和力FcγRIV(CD16-2)。FcγRI、FcγRIII和FcγRIV被认为是激活受体,而FcγRII是抑制性的。
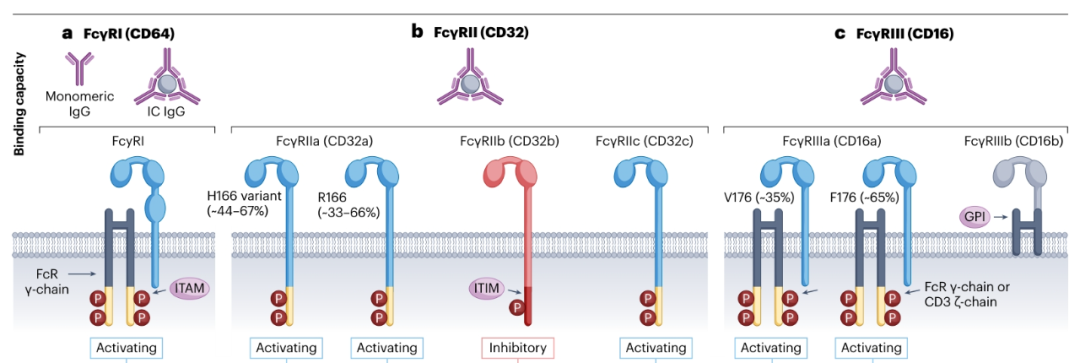
人和小鼠FcγRI、FcγRIII和FcγRIV通过一种含有免疫受体酪氨酸激活基序(ITAM)的衔接蛋白,即Fc受体γ链(FcRγ)发出信号。人FcγRIIa和FcγRIIc是唯一在胞内尾部含有内源性ITAM的FcγRs,不需要衔接蛋白来发出信号。FcγRIIb通过与免疫复合物结合并通过内源性细胞内免疫受体酪氨酸基抑制基序(ITIM)发出信号,抑制通过激活FcγRs介导的抗体效应器功能。
-03-
结构决定命运:FcγR与IgG亚型的选择
FcγRs根据其结合单体或IgG免疫复合物的能力分为高亲和力和低亲和力。亲和力高于107/M-1的FcγRs 可以结合单体和IgG免疫复合物,被认为是高亲和力的;而FcγRs的亲和力低于107/M-1只能与IgG免疫复合物结合,被认为是低亲和力。人hIgG1、hIgG3和hIgG4与所有FcγRs结合,而hIgG2与除FcγRI和FcγRIIIb外的所有FcγRs结合。小鼠mIgG1仅与mFcγRII和mFcγRIII结合,mIgG2a/c和mIgG2b与所有FcγRs结合,而mIgG3仅与mFcγRI结合。但在体内,这些受体的亲和力受到多种变量的影响,如抗体-抗原比率、免疫复合物的大小和受体的位置。
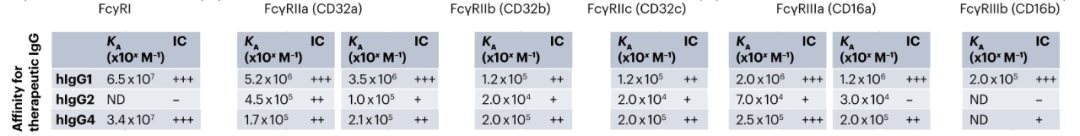
IgG亚类对FcγRs的不同亲和力和每个FcγR的细胞表达水平被用于定义引发“弱”或“强”抗体效应功能的可能性,这被称为激活抑制(A/I)比率。通常,具有hIgG1主链的治疗性抗体用于激活FcγRs并清除靶细胞。相反,hIgG2和hIgG4抗体用于阻断受体-配体相互作用,而不参与激活FcγRs,因为它们对FcγRs的亲和力相对较低。然而,hIgG2和hIgG4仍然具有结合激活的FcγRs的能力,可能在意想不到的情况下驱动效应器功能。由于FcγRIIa和FcγRIIIa主要在NK细胞、粒细胞和巨噬细胞上表达,它们被认为是人类IgG的主要效应细胞。在小鼠中,当需要抗体效应器功能时使用mIgG2a,而当阻断靶的生物活性时使用mIgG1。mIgG2a的治疗性抗体需要与髓系细胞上的高亲和力小鼠FcγRs、mFcγRI和mFcγRIV结合,以清除靶标。
-04-
FcγR的免疫调节作用
1. 调节先天免疫与适应性免疫的桥梁
ADCC与ADCP:NK细胞通过FcγRIIIa识别抗体标记的肿瘤细胞,释放穿孔素/颗粒酶直接杀伤靶细胞;巨噬细胞则通过吞噬作用清除肿瘤。
抗原呈递增强:树突状细胞通过FcγR捕获免疫复合物,促进肿瘤抗原交叉呈递,激活T细胞。
2. 免疫检查点的“间接调控者”
耗竭抑制性T细胞:抗CTLA-4抗体(如伊匹木单抗)通过FcγR介导的ADCC清除调节性T细胞(Treg),解除免疫抑制。
协同增效:LAG-3或TIGIT抗体单药效果有限,但与PD-1抗体联用可通过FcγR依赖的机制增强T细胞活化。
-05-
临床药物的精细博弈:Fc工程化策略
抗体工程是调节FcγR结合的强大工具,影响治疗性抗体的活性、半衰期和生产制造。Fc的点突变和N297糖基化位点的修饰已被广泛用于修饰IgG与补体、FcRn和FcγRs的结合,以影响其作用机制。最常见的突变之一是用于治疗性hIgG4抗体的S228P突变。另一种常见的策略是对Fc的CH2结构域内连接到N297的聚糖进行糖工程改造。
CTLA-4
美国食品药品监督管理局(FDA)已经批准了两种CTLA-4抗体,ipilimumab(hIgG1)和tremelimumab(hIgG2)。尽管hIgG1具有比hIgG2更高的亲和力,hIgG1和hIgG2都可以参与激活FcγRs,潜在地驱动抗体效应器功能并导致表达CTLA-4的细胞的清除。
PD-1
FDA已经批准了几种靶向PD-1的抗体,这些抗体使用S228P突变改造的hIgG4亚型阻断其与PD-L1的相互作用。令人感兴趣的是,tislelizumab与其他FDA批准的PD-1抗体不同,因为它在其恒定区经过一系列突变改造,以降低FcγR的结合,有可能防止Fc–FcγR相互作用的有害影响。
PD-L1
目前有三种FDA批准的PD-L1抗体,atezolizumab、durvalumab和avelumab,具有不同的FcγR-结合特性。与具有Fc突变hIgG1亚型的atezolizumab和durvalumab不同,avelumab是一种野生型hIgG1,具有完整的FcγR结合。Avelumab已被证明在参与hFcγRIIIa后介导同种异体癌症细胞系的ADCC,类似于其他肿瘤靶向hIgG1抗体。然而,由于Teff细胞和APC也在TME中表达PD-L1,Avelumab也可能清除这些群体,导致次优的抗肿瘤活性。因此,抗PD-L1药物的最终体内活性将取决于PD-L1在不同免疫细胞和不同TME中的分布和表达水平。
LAG-3和TIGIT
FDA最近批准了LAG-3抗体relatlimab(hIgG4S228P)与抗PD-1(nivolumab)联合治疗晚期黑色素瘤。与大多数PD-1抗体类似,relatlimab被开发用于阻断LAG-3的抑制活性,而不引发抗体效应器功能。
Tiragolumab,一种抗TIGIT hIgG1抗体,最近的的结果显示接受Tiragolumab治疗的患者的CD4+和CD8+Teff细胞和NK细胞活化、Treg细胞清除以及伴随的髓系细胞活化。
CD28
Theralizumab(TGN-1412)是第一种在临床上测试的CD28抗体,其设计具有野生型hIgG4亚类(缺乏S228P突变),作为靶向人CD28的超级激动性抗体,独立于TCR。在I期临床试验中,健康志愿者服用theralizumab会导致细胞因子释放综合征(CRS),导致严重的炎症反应和慢性器官衰竭。进一步的体外研究表明,theralizumab的hFcγRIIb超交联增强了CD28聚集,并增加了CD4+Teff细胞的细胞因子产生,至少驱动了其部分毒性,这是临床前研究中未观察到的特征。此外,该抗体具有野生型IgG4,没有S228P突变,这表明它可能在体内进行了Fab臂交换,可能会增加其毒性效应。
ICOS
已经在临床上评估了几种具有hIgG1或hIgG4骨架的ICOS抗体。有人赞成开发具有效应器功能hIgG1的抗ICOS抗体(vopratelimab),以促进ICOS高表达Treg细胞的消耗,以及表达较低水平ICOS的Teff细胞的激活(通过受体交联)。另一种种更为保守,用hIgG4开发抗ICOS抗体(feladilimab),激活ICOS并减少消耗活化的ICOS高表达Teff细胞的机会。然而,这两种抗体都没有产生显著的临床影响。
CD40
在已经进入临床试验的许多CD40抗体中,具有增强的FcγRIIb结合的hIgG1和不需要FcγRIIb的hIgG2抗体可能最有希望引发最佳治疗潜力。然而,尽管做出了努力,但大多数使用CD40抗体的临床试验显示出有限的疗效,并导致了与治疗相关的肝毒性和CRS。
OX40
人OX40抗体已经在临床上使用hIgG1或hIgG2亚型进行了测试。Ivuxolimab(PF-04518600)是唯一的hIgG2,在一项I期试验中作为单一疗法进行了测试,发现它能促进血液中CD8+Teff细胞的克隆扩增,在6%的局部晚期或转移性癌症患者中有部分反应。在同一项研究中,ivuxolimab与4-1BB抗体(utomilumab)联合使用,在少数晚期实体癌患者中显示出一定疗效。hIgG1 OX40抗体也已在早期临床试验中进行了测试。尽管缺乏临床活性,Cudarolimab(IBI101)和tavolimab与CD4+和CD8+Teff细胞的扩增有关,在后者的情况下与TME内的Treg细胞清除有关。
4-1BB
目前,两种4-1BB抗体已在临床上进行了评估,即urelumab(hIgG4)和utomilumab(hIgG2)。与ICOS和OX40类似,这些抗体在临床试验中显示出有限的反应。Urelumab和utomilumab在循环NK细胞、CD4+Teff细胞和CD8+Teff以及树突状细胞上显示出激活标记物的表达增加。然而,由于其相当大的肝毒性,urelumab显示出较差的安全性,而utomilumab具有更可接受的安全性。utomilumab更有利的安全性可能部分与这样一个事实有关,即utomilumab的激动性不如urelumab,并且其hIgG2亚型不与FcγRIIb结合。一种潜在的4-1BB抗体开发策略可能是降低utomilumab或urelumab的Fab亲和力,同时工程化hIgG2亚型以驱动不依赖于FcγRs的4-1BB激动剂。
-06-
结语:精准免疫治疗的新维度
Fcγ受体作为抗体效应的“终末执行者”,其复杂调控网络为肿瘤免疫治疗提供了多重干预节点。随着对FcγR生物学和抗体工程的深入研究,未来的免疫治疗将朝着更精准的调控方向发展。从基因多态性到抗体工程,从单药到联合策略,深入理解FcγR生物学将推动更安全、更精准的下一代疗法诞生。
参考文献:
1.Fcγ receptors and immunomodulatory antibodies in cancer. Nat Rev Cancer.2024 Jan;24(1):51-71.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#肿瘤免疫治疗# #Fcγ受体#
7