Nature子刊:朱贵志团队开发出小环状RNA疫苗,实现有效的肿瘤免疫治疗
2025-02-12 iNature iNature 发表于陕西省
该研究表明,在小鼠皮下注射后,加载在脂质纳米粒中的抗原编码小环状RNA(circRNAs)引发有效和持久的T细胞应答,用于强大的肿瘤免疫治疗,特别是当结合免疫检查点抑制时。
信使RNA疫苗对病毒感染显示出很强的预防效果。
2025年2月7日,密歇根大学安娜堡分校朱贵志团队在Nature Biomedical Engineering在线发表题为“Small circular RNAs as vaccines for cancer immunotherapy”的研究论文,该研究表明,在小鼠皮下注射后,加载在脂质纳米粒中的抗原编码小环状RNA(circRNAs)引发有效和持久的T细胞应答,用于强大的肿瘤免疫治疗,特别是当结合免疫检查点抑制时。
小circRNA疫苗高度稳定,表现出低水平的蛋白激酶R激活以及低细胞毒性,能够实现持久的抗原翻译(在细胞中超过1周)。相对于编码大蛋白的未修饰或修饰的mRNAs和circRNA,小circRNA疫苗在小鼠中诱导了高达10倍的抗原特异性T细胞,并在6个月内占外周CD8+ T细胞总数的30-75%。编码肿瘤相关抗原、新抗原和肿瘤病毒或病毒抗原的小环状RNA疫苗在年轻成年小鼠和免疫衰老小鼠中引发了大量CD8+和CD4+ T细胞应答。结合免疫检查点抑制,单价和多价circRNA疫苗减少了肿瘤诱导的免疫抑制,并抑制了免疫原性差的小鼠肿瘤,包括对免疫检查点阻断有抗性的黑色素瘤。

传统的基于病原体的疫苗与毒性逆转、基因组整合、有限的生物稳定性、抗载体免疫、差的药代动力学、弱的免疫原性以及对癌症和慢性或先存感染的有限益处相关。mRNA疫苗绕过了其中的一些顾虑,新冠肺炎mRNA疫苗就是一个例子,它强调了它们在疾病预防和治疗中的多功能应用的潜力。mRNA疫苗通过激活模式识别受体(PRRs)5引发先天免疫,并翻译引发体液应答的真正抗原,或通过主要组织相容性复合体(MHC)进行蛋白水解加工以优化抗原呈递,引发T细胞应答。尽管如此,仍然有改进mRNA疫苗的空间。circRNA是一类新兴的RNA,具有独特的生物学功能,具有巨大的生物医学应用潜力。天然环状RNA通常由pre-mRNA反剪接产生。最近开发合成circRNA疗法和疫苗的尝试依赖于与许多相关的长mRNA。
在这里,研究人员报道了高度稳定的小circRNA疫苗,其持久地产生抗原,从而引发对有效的肿瘤联合免疫疗法具有高度安全性且强而持久的T细胞应答。小circRNA表现出较高的热稳定性(在20°C下溶液储存半衰期约为400天)和生物稳定性,不仅高于相应的小线性化RNA,还高于最先进的修饰mRNA和大circRNA(通常大于1,000个核苷酸);此外,circRNA测序(circRNA-seq)证实了转染到活细胞中的小circRNA的核苷酸真实性。小circRNA的高稳定性使得肽在细胞中持续表达至少一周。小环状RNA疫苗激活了树突状细胞(DCs)中维甲酸诱导基因I (RIG-I)免疫刺激途径。此外,与大核苷修饰的mRNA和大环RNA相比,小环RNA疫苗表现出良好的安全性和低的不期望的PKR激活。
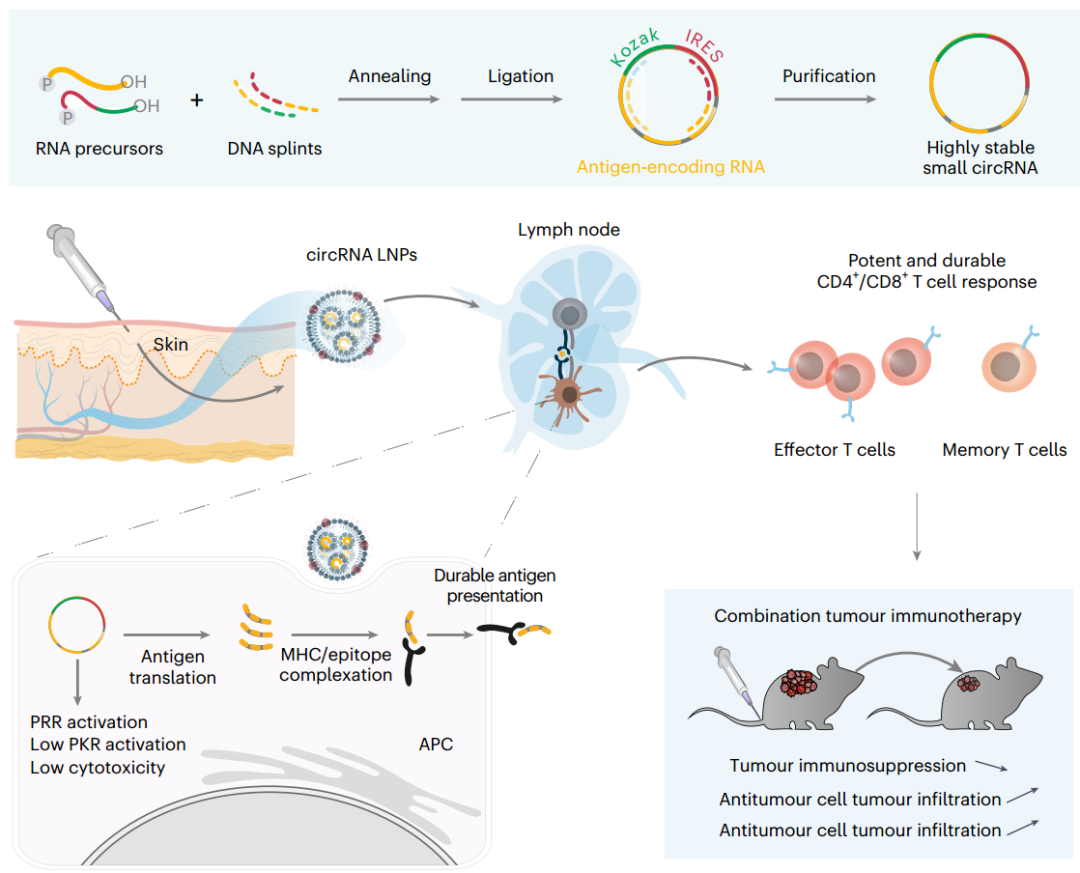
高度稳定的小circRNA疫苗的示意图,其引发用于肿瘤免疫治疗的有效且持久的T细胞应答
(图源自Nature Biomedical Engineering)
小环状RNA被有效地装载到纳米载体中,例如可电离的脂质纳米粒(LNPs),用于有效地递送到引流淋巴结中的抗原呈递细胞(APCs)。与circRNA LNPs的先天免疫刺激相结合,小circRNA在延长的持续时间内的持续抗原翻译能够实现有效和持久的抗原呈递和T细胞引发。因此,编码MHC-II-和MHC-I-限制性抗原的小circRNA疫苗分别引发了有效和持久的(有记忆的)CD4+和CD8+ T细胞应答,这两者对于癌症治疗都是至关重要的。相对于多种类型的编码肽/蛋白质的修饰的mRNA、未修饰的mRNA和大环RNA,无修饰的小环RNA疫苗引发了更强和更持久的T细胞应答,其在免疫后持续至少6个月。这使得小环状RNA疫苗有希望在体内产生治疗上显著剂量的T细胞受体(TCR)-T细胞,而无需任何离体T细胞工程和制造。此外,小circRNA在免疫衰老小鼠中引发了深刻的T细胞反应。
模块化小circRNA易于调节以引发针对各种抗原的T细胞反应,包括肿瘤相关抗原、肿瘤新抗原、肿瘤病毒抗原和病毒抗原。在小鼠中,小circRNA疫苗降低了肿瘤免疫抑制,并增强了抗肿瘤免疫细胞的肿瘤浸润。单价或多价小环状RNA疫苗,单独或与免疫检查点阻断(ICB)组合,显著抑制或根除多种同系肿瘤模型中的肿瘤,包括免疫原性差和ICB抗性的BrafV600E黑素瘤。这些结果证明了小环状RNA疫苗在肿瘤联合免疫治疗中的巨大潜力。
参考消息:
https://www.nature.com/articles/s41551-025-01344-5
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















什么时候能进入临床啊?这是定制疫苗?
6
#肿瘤免疫治疗# #小环状RNA#
7