澳门大学侯嘉杰/中山大学徐瑞华教授《自然·通讯》:从抗肿瘤T细胞的表观程序缺陷中破译联合免疫治疗的最优解
2024-11-09 BioMed科技 BioMed科技 发表于上海
本研究发现 YTHDF2 因细胞内亚定位具新分子免疫学功能,可调控 T 细胞抗肿瘤功能,联合来那度胺可修复 YTHDF2 缺失 T 细胞活性,与肿瘤浸润性 CD8 T 细胞多功能性相关。
在过去的10年里,以T细胞为中心的肿瘤免疫治疗取得了丰硕的研究成果和飞速的临床转化。然而,包括免疫检查点单抗、肿瘤浸润性淋巴细胞(TIL)、CAR-T、TCR-T、肿瘤疫苗等在内的最新免疫疗法均不能达到预期的临床获益。将免疫治疗与化疗、放疗、靶向治疗等进行联合应用(联合免疫治疗)是提高临床有效性的主要手段。此外,从肿瘤细胞内部信号中甄选联合干预靶点虽是常见的研究思路,肿瘤生物学行为的异质性和可变性或可制约这一思路的有效性窗口。
无疑,回到T细胞视角来探寻联合免疫治疗机遇具有天然的优势。作为免疫生物学领域的一个新命题,治疗后T细胞的信号转归可为免疫治疗格局的改善提供全新的思考维度。
2024年11月5日,澳门大学教育部精准肿瘤学前沿科学中心侯嘉杰课题组、华南肿瘤学国家重点实验室-中山大学肿瘤防治中心徐瑞华课题组共同在《自然-通讯》杂志发表了题为“YTHDF2 upregulation and subcellular localization dictate CD8 T cell polyfunctionality in anti-tumor immunity”的学术论文。RNA 甲基化是调节细胞功能状态的重要机制,但其如何影响T 细胞的抗肿瘤活性却未得到具体阐释。在这一研究中,作者为甲基化RNA阅读子YTHDF2 赋予了一项全新的分子免疫学功能——因其不同的细胞内亚定位,YTHDF2 不仅可通过经典RNA甲基化通路减缓T细胞的耗竭进程,亦可直接调控效应性或效应样T细胞的染色质活性,增强其在免疫治疗过程中的抗肿瘤功能。

肿瘤反应性 T 细胞是治疗诱导抗肿瘤免疫的关键。值得注意的是,T 细胞的激活和分化通常与表观分子信号相伴,其中许多关键信号正是抗肿瘤T 细胞发生功能障碍的重要原因。因此,对T 细胞表观程序的调控是一项潜在的分子免疫治疗手段。
主流免疫检查点抑制剂PD-1单抗的有效性直接依赖于从耗竭 T细胞前体分化而来的效应样细胞,其在功能上类似于从初始T细胞分化而来的效应性T细胞。由于分化轨迹使然,许多促进效应性T细胞的表观信号也会加速T细胞耗竭,使T细胞功能无法持久。免疫治疗过程中亦会遭遇这样的难题。那么,能否找到兼顾T细胞效应性和持久性的表观调控方式呢?研究者将目光投向了效应性和效应样T细胞的早期表观调控事件。
m6A介导的 RNA 甲基化是一种高度动态而精细的表观调控程序。经过多种方式的转录组筛查,研究者发现甲基化RNA阅读子YTHDF2在早期效应性和效应样 CD8 T 细胞中高度表达,且呈现出显著的亚群和时相特异性。除外表达水平的增强,研究者还惊讶地发现YTHDF2可在早期效应性和效应样 CD8 T 细胞中发生蛋白核转位。进一步地,研究者运用多种条件性基因敲除小鼠、转基因小鼠及免疫治疗后临床肿瘤标本,观察到T 细胞的 YTHDF2 缺失会显著促进肿瘤的进展,并造成小鼠及肿瘤患者对免疫治疗无应答。随后,研究者通过体内外T细胞生物学实验体系、分子互作实验体系及多维度测序手段等,取得了以下重要发现:
在静息T 细胞中,低表达于细胞质的 YTHDF2 可能通过 m6A 识别限制其同源编码 mRNA 的稳定性,从而在生理条件下自我维持低表达水平。当T细胞有效活化或在免疫治疗下再激活时,一部分YTHDF2 会切换到“非自我调节状态”,进而发生核转位、释放同源 mRNA 的翻译程序,快速上调自身表达。
停留在活化T细胞胞质中的YTHDF2可执行经典的甲基化RNA识别与降解功能,减轻高代谢负荷下的线粒体应激反应,也即YTHDF2通过保护线粒体健康来维持T细胞的持久性。反之,YTHDF2缺失则会造成线粒体翻译元件基因的过度表达,促进线粒体应激与T细胞耗竭。
向细胞核发生转移的YTHDF2可通过与IKZF1、IKZF3的直接结合限制其介导的转录抑制作用,从而保护早期效应性和效应样T细胞的多功能性。反之,YTHDF2缺失将会增强IKZF1/3与其靶基因的结合,并促使其招募核小体元件、抑制染色质活性——T细胞受体信号基因Stat5、Rasgrp1等将无法有效转录。
IKZF1/3抑制剂来那度胺(lenalidomide)是治疗多发性骨髓瘤的初代靶向蛋白质降解类药物。据此,来那度胺协同PD-1单抗可在小鼠模型中有效修复YTHDF2缺失T细胞的抗肿瘤活性。
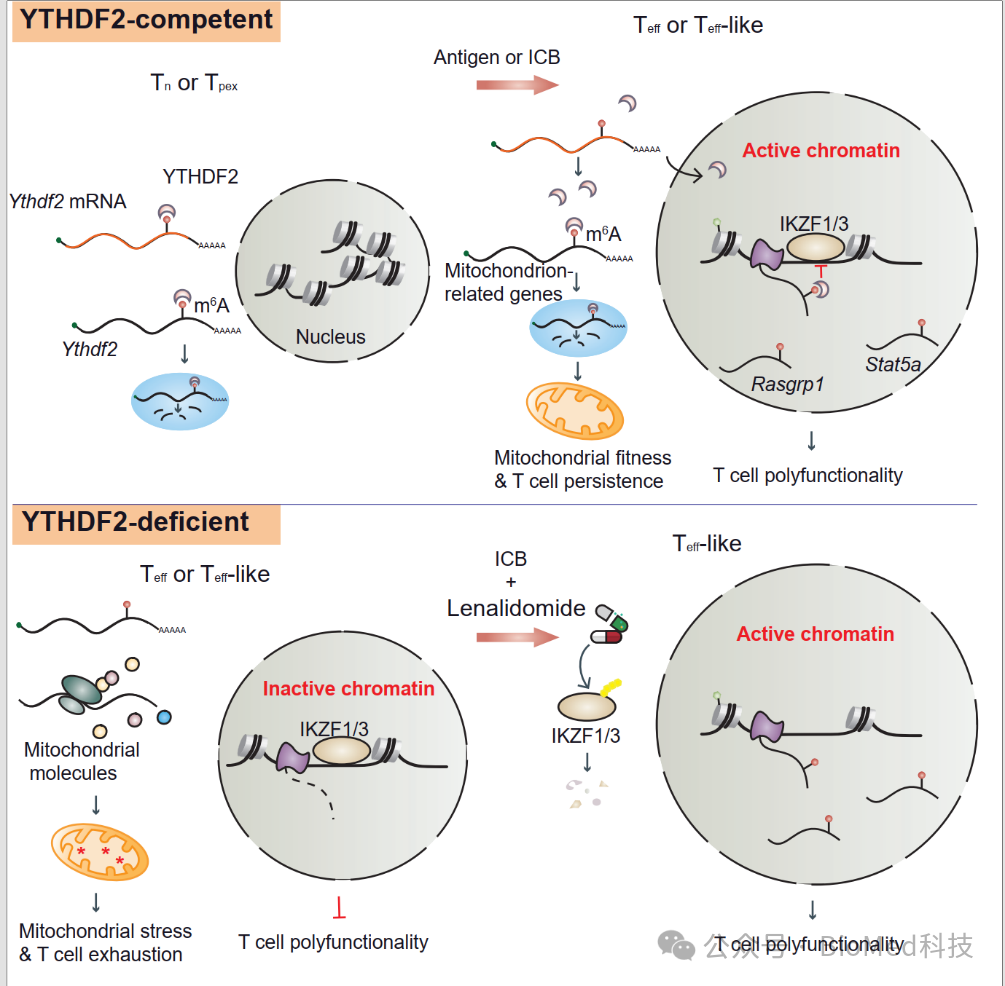
研究者从多个肿瘤类型的临床患者数据中获悉,肿瘤浸润性CD8 T细胞的YTHDF2 表达水平与其多功能性呈正相关;因此,其低表达在未经治疗的肿瘤患者及对免疫治疗无应答的患者中十分常见。基于上述表观分子机理的阐释,YTHDF2 缺失可导致具有IKZF1/3调控偏倚的转录抑制,同时也创造了可供靶向干预的空间与时机。尽管来那度胺等IKZF1/3抑制剂被认为具有一定的不良反应风险,研究者相信通过对患者的选择、剂量的控制以及联合方案与时机的把握,有望为相当一部分的肿瘤人群带来新的曙光。
澳门大学健康科学院张海燕副研究员、中山大学肿瘤防治中心罗小菁博士为该论文共同第一作者,澳门大学精准肿瘤学中心侯嘉杰教授、中山大学肿瘤防治中心徐瑞华教授为该论文共同通讯作者。
原文链接:
https://www.nature.com/articles/s41467-024-53997-6
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#肿瘤免疫治疗# #YTHDF2#
33