【论著】|PD-L1检测指导中国非小细胞肺癌患者免疫治疗的成本效果分析
2025-04-12 中国癌症杂志 中国癌症杂志 发表于陕西省
中国早中期和晚期NSCLC患者在进行免疫单药治疗时,SP263检测方案是具有成本效果的PD-L1检测方案。
[摘要] 背景与目的:根据国家癌症中心最新数据显示,中国肺癌发病率和死亡率均居所有恶性肿瘤首位,且85%为非小细胞肺癌(non-small cell lung cancer,NSCLC)。近年来,以程序性死亡[蛋白]-1(programmed death-1, PD-1)/程序性死亡[蛋白]配体-1(programmed death ligand-1,PD-L1)免疫检查点抑制剂为主的免疫治疗在肺癌的治疗中取得了突破性的进展,为肺癌患者带来了更多的生存获益。本研究旨在评估使用不同PD-L1检测方案指导NSCLC患者免疫治疗的成本和效果,为中国NSCLC患者选择具有成本效果的诊断以及指导免疫单药方案提供科学依据。方法:基于卫生体系视角,构建决策树模型,模拟评估早中期(ⅡA~ⅢB期)、晚期(Ⅳ期)NSCLC患者接受Ventana SP263检测、Dako 22C3即用型及Dako 22C3浓缩液检测的成本,以及获得正确诊断且接受正确治疗的比例(正确诊治率)。通过增量分析比较SP263相对于其他检测方式的经济性。通过单因素敏感性分析和概率敏感性分析检验基础分析结果的稳健性。结果:指导NSCLC早中期患者化疗后辅助阿替利珠单抗治疗时,相比22C3即用型检测方案或22C3浓缩液检测方案,SP263检测方案每正确诊断且接受正确治疗一位患者需要的增量成本为9 449元,SP263检测方案具有成本效果。指导NSCLC晚期患者免疫单药治疗时,与22C3即用型或22C3浓缩液检测方案相比,SP263检测方案可以指导多种免疫单药治疗(阿替利珠单抗单药、帕博利珠单抗单药),同时正确诊治率更高,且成本更低。单因素敏感性分析和概率敏感性分析均证实结果的稳健性。结论:中国早中期和晚期NSCLC患者在进行免疫单药治疗时,SP263检测方案是具有成本效果的PD-L1检测方案。
[关键词] PD-L1检测;非小细胞肺癌;免疫单药治疗;成本效果分析
[Abstract] Background and purpose: According to the latest data from the National Cancer Center, the incidence rate and mortality of lung cancer in China rank first among all malignant tumors, and 85% are non-small cell lung cancer (NSCLC). In recent years, immunotherapy based on programmed cell death protein-1 (PD-1)/programmed death ligand-1 (PD-L1) immune checkpoint inhibitors (ICIs) has made breakthrough progress in lung cancer, bringing more survival benefits to lung cancer patients. This study aimed to evaluate the cost-effectiveness of three major PD-L1 testing assays in guiding immunotherapy for patients with NSCLC, and to provide empirical evidence to guide the selection of cost-effective diagnosis and ICIs monotherapy regimens for NSCLC patients in China. Methods: From a healthcare system perspective, a decision-tree model was constructed to simulate the cost and effectiveness (percentage of the patients who were successfully diagnosed and who were correctly prescribed and underwent correct treatment according to China treatment guidelines) of employing Ventana PD-L1 IHC (SP263) assay, PD-L1 IHC 22C3 pharmDx, and Dako 22C3 antibody concentrate in early to mid-stage and advanced NSCLC patients in China, respectively. The cost-effectiveness of SP263 assay compared to other testing methods was assessed through the incremental analysis. The robustness of the base case analysis results was validated by using one-way sensitivity analysis and probabilistic sensitivity analysis. Results: When considering atezolizumab monotherapy following chemotherapy for early to mid-stage (Ⅱ A-Ⅲ B) NSCLC patients, in comparison to the 22C3 assay or 22C3 antibody concentrate, the SP263 assay incurred an additional cost of 9 449 yuan per successfully diagnosed and treated patient. The SP263 assay, which can guide multiple ICIs monotherapies (e.g., atezolizumab, pembrolizumab) for advanced (Ⅳ) NSCLC patients, was dominant by achieving a higher percentage of successfully diagnosed and treated patients at a lower cost compared to Dako 22C3 assay and Dako 22C3 antibody concentrate. One-way sensitivity analysis and probabilistic sensitivity analysis both confirmed the robustness of the results. Conclusion: The Ventana PD-L1 IHC SP263 assay was cost-effective, compared to Dako PD-L1 IHC 22C3 assay and Dako 22C3 antibody concentrate for the immunotherapy treatment for both stage Ⅱ A-Ⅲ B and stage Ⅳ NSCLC patients in China.
[Keywords] PD-L1 testing; NSCLC; Immunotherapy; Cost-effectiveness analysis
根据国家癌症中心最新数据显示,中国肺癌新发病例约106.06万例,死亡病例约73.33万例,发病率和死亡率均居所有恶性肿瘤首位[1]。肺癌患者中85%为非小细胞肺癌(non-small cell lung cancer,NSCLC)[2]。近年来,以程序性死亡[蛋白]-1(programmed death-1,PD-1)/程序性死亡[蛋白]配体-1(programmed death ligand-1,PD-L1)免疫检查点抑制剂为主的免疫治疗在肺癌中取得了突破性的进展,为肺癌患者带来了更多的生存获益。
截至2024年10月,根据医药魔方数据库统计,国内获批上市的PD-1和(或)PD-L1单克隆抗体类药物中具备NSCLC适应证的药物共11种,包括阿替利珠单抗、帕博利珠单抗、纳武利尤单抗、信迪利单抗、卡瑞利珠单抗等。免疫组织化学检测是评估肿瘤组织PD-L1表达状态的一种有效且最常用的方法。目前国内外已有多种PD-L1免疫组织化学检测试剂获批,随适应证需要作为伴随诊断或补充诊断而用于指导NSCLC患者免疫治疗用药。PD-L1免疫组织化学检测用的22C3 pharmDx (22C3即用型)、22C3抗体试剂(22C3浓缩液)可用于帕博利珠单抗的伴随诊断,Ventana PD-L1免疫组织化学检测试剂SP263可用于指导阿替利珠单抗、帕博利珠单抗、纳武利尤单抗等多种免疫抑制剂的诊断[3]。PD-L1检测不仅对指导患者免疫治疗方案的选择具有重要作用,同时对预测患者预后具有重要的意义,可以帮助识别或辅助预测可能从免疫治疗中获益的患者[4]。
由于染色性能等方面的差异,不同试剂检测的结果会存在一定程度差异[5],体现在检测灵敏度和特异度等性能上的差别。检测性能的差异会影响患者得到正确诊断的概率,并影响患者后续治疗方案的选择,从而产生疗效的差异以及整体治疗成本的变化。卫生经济学评价可以通过测量某种检测方法的成本和健康产出,与参照检测方法进行比较,来判断某种检测方法是否具有经济性。本研究选择了临床常用的Ventana SP263检测方案和Dako 22C3即用型检测方案、Dako 22C3浓缩液检测方案进行比较分析,旨在评估不同PD-L1检测方案的成本效果,为临床在兼顾检测成本、治疗成本与患者临床获益的前提下选择具有成本效果的检测方案提供参考。
1 资料和方法
1.1 基本设置
研究采用中国卫生体系角度,通过决策树模型模拟PD-L1检测指导中国NSCLC患者免疫治疗过程中的医疗成本(包括检测成本、药物治疗成本、检查及检验成本等)和正确诊断且接受正确治疗的比例(以下简称正确诊治率)。NSCLC ⅡA~ⅢB期(早中期)和Ⅳ期(晚期)患者接受免疫治疗的用药选择存在较大差异,本研究分别针对早中期患者和晚期患者进行独立的成本效果分析。增量成本效果比(incremental cost effectiveness ratio,ICER)是卫生经济学常用的评价指标,指每增加一个单位的效果所增加的成本。采用支付意愿阈值(willingness-to-pay threshold,WTP)和ICER值进行比较,参考WHO卫生经济学评价标准,ICER<人均GDP为极具成本效果,人均GDP<ICER<3倍人均GDP为具有成本效果,ICER>3倍人均GDP为不具有成本效果。研究设定以中国2023年1倍人均国内生产总值(gross domestic product,GDP)的89 358元)作为意愿支付阈值。鉴于1年的时间足以体现PD-L1检测的准确性和成本,将研究时限设置为1年。
1.2 专家访谈
访谈NSCLC领域的临床专家及病理科专家,咨询中国NSCLC患者PD-L1检测流程、临床治疗现状、医疗资源利用及临床效果等。研究共访谈了多名来自全国各个地区一线/二线城市的三甲医院的肿瘤内科/外科/病理科副主任医师及以上职称的医师,专家具有丰富的诊疗经验和专业知识,访谈结果具有较好代表性和科学性。
1.3 模型结构
根据中国NSCLC诊疗指南[6-7]和专家访谈构建决策树模型(图1)。模型以SP263检测方案为干预方案,分别以22C3即用型、22C3浓缩液检测方案为对照方案。对于NSCLC早中期患者,根据专家共识的推荐[3],PD-L1表达阳性的判断标准为肿瘤细胞阳性比例评分(tumor proportion score,TPS)/肿瘤细胞(tumor cell,TC)≥1%,这些患者将在化疗后接受阿替利珠单抗单药治疗,或仅接受化疗后最佳支持治疗(best supportive care,BSC);而PD-L1表达阴性(TPS/TC<1%)的患者,接受化疗后BSC治疗。对于NSCLC晚期患者,PD-L1表达阳性的判断标准为TPS/TC≥50%[3],对于SP263检测方案,可选择阿替利珠单抗单药、帕博利珠单抗单药进行治疗,或仅接受化疗;对于22C3即用型或22C3浓缩液检测组,由于22C3即用型/浓缩液仅获批用于指导帕博利珠单抗治疗,可选择使用帕博利珠单抗治疗或仅接受化疗。若PD-L1表达水平TPS/TC<50%,患者接受化疗。在研究时限(1年)节点时,模拟患者的健康状态,将患者分为3种状态:疾病无进展、疾病进展和死亡。模型的构建和运算过程在Excel软件中实现,模拟计算患者在不同健康状态的比例,加总计算患者在对应干预方案下每个健康状态的成本,并结合不同干预方案的正确诊治率进行比较。
1.4 模型参数
模型中的关键参数及数据来源见表1。
1.4.1 诊断效能
本研究中诊断效能由可接受率衡量,即正确诊断的比例,为真阴性和真阳性的比例之和。SP263、22C3即用型、22C3浓缩液的可接受率数据来自北欧免疫组织化学质量控制机构(NordiQC)2017—2019年5项基于肺癌组织样本的PD-L1免疫组织化学检测准确性的研究报告。由于该研究未分别汇报SP263、22C3即用型、22C3浓缩液的假阳性率和假阴性率,仅汇总报告了不区分检测方法的假阳性率和假阴性率,而国内外又暂无公开数据,所以本研究根据NordiQC汇总的假阳性率和假阴性率的比例关系,结合SP263、 22C3即用型、22C3浓缩液各自的可接受率数据,分别推算出3种检测方法各自的假阳性率和假阴 性率。
1.4.2 PD-L1表达阳性患者比例
NSCLC早中期患者PD-L1表达阳性(TPS/TC ≥1%)比例和晚期患者PD-L1表达阳性(TPS/TC≥50%)比例来自一项基于中国的大型多中心真实世界研究,该研究纳入了6 295例NSCLC样本进行分析,具有较好的代表性。
1.4.3 药物治疗比例
NSCLC早中期患者,PD-L1表达阳性接受阿替利珠单抗治疗和接受BSC治疗的患者比例来自临床专家访谈。NSCLC晚期患者PD-L1表达阳性,对于SP263干预组,患者接受化疗、阿替利珠单抗单药治疗或帕博利珠单抗单药治疗的比例来自临床专家访谈。
1.4.4 疾病进展与二线治疗
NSCLC早中期临床疗效数据中位无病生存期(median disease-free survival,mDFS)来自临床试验IMPOWER 010 (Ⅱ~ⅢA期,基于美国癌症联合会(American Joint Committee on Cancer,AJCC)/国际抗癌联盟(Union for International Cancer Control,UICC)分期第7版)。晚期NSCLC患者临床疗效数据中位无进展生存期(median progression-free survival,mPFS)来自临床试验IMPOWER 110 和临床试验 KEYNOTE 024。对于疾病进展的患者,假设患者在mDFS/mPFS节点之前疾病未进展,在mDFS/mPFS节点之后疾病进展,进展后采用二线治疗。早中期NSCLC患者二线用药为BSC,晚期NSCLC患者,若一线采用免疫治疗,二线疾病进展后采用化疗;若一线采用化疗,二线疾病进展后采用BSC。
1.4.5 PD-L1检测费用
由于不同省份的医疗服务项目价格收费标准会有所差异,本研究PD-L1检测费用根据15个省、市、自治区(分别为天津、内蒙古、黑龙江、吉林、江苏、安徽、山东、海南、湖北、广西、新疆、四川、重庆、贵州、云南)医疗服务价格或医院自主定价的价格,汇总计算收费价格中位数,代表PD-L1检测的费用,并通过专家访谈进行验证。
1.4.6 药物治疗费用
研究根据早中期、晚期NSCLC患者各治疗方案的差异分别计算患者的治疗成本。药品价格来自于医药魔方中国中标药品数据库,采用最新中标价格进行计算。由于针对早中期和晚期NSCLC,不同免疫疗法分别有不同的患者援助计划[18-19],本研究将结合患者援助计划计算最终实际的治疗费用。研究假设患者都进行了充分的治疗。
1.4.7 检查检验费用
检查检验项目包括血常规、血生化、胸部CT、MRI、PET/CT、B超、全身骨扫描、肿瘤标志物检测等检查检验项目。各检查检验项目的单位价格来自各省、市、自治区医疗服务价格手册并通过专家访谈进行验证;不同类型患者的检查检验频次来自专家访谈。
1.4.8 不良反应
纳入≥3级且发生率居前的不良反应。早中期NSCLC治疗的不良反应发生率数据来自临床试验IMPOWER010,晚期NSCLC因治疗引起的不良反应发生率数据来自临床试验IMPOWER110、临床试验KEYNOTE-024。不良反应处理费用来自中国相关文献报告。
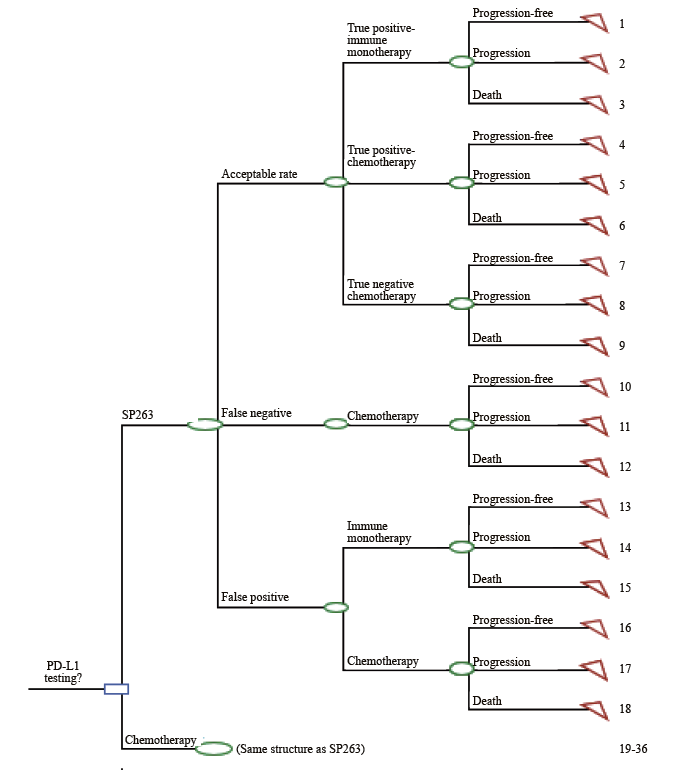
图 1 PD-L1检测指导NSCLC患者免疫单药治疗的决策树模型
Fig. 1 Decision tree model for PD-L1 testing guided immunotherapy in advanced NSCLC patients
Acceptable rate: Including true positive and true negative results, serving as a comprehensive indicator of sensitivity and specificity; Comparator included: 22C3 assay and 22C3 antibody concentrate.
1.5 敏感性分析
研究通过单因素敏感性分析考量单一参数变动对模型结果变动的影响程度,并以飓风图呈现,灵敏度、特异度等参数调高或调低20%。同时,研究还通过概率敏感性分析,进一步检验基础分析结果的稳健性。概率敏感性分析中,成本参数采用gamma分布,效用参数和诊断效能参数采用beta分布,通过1 000次蒙特卡洛模拟分析所有参数同时变化时对模型结果的变化程度。
2 结 果
2.1 基础分析结果
2.1.1 早中期NSCLC患者
对于早中期NSCLC患者,和22C3即用型、 22C3浓缩液检测方案相比,SP263检测方案的灵敏度和特异度更高,可正确诊断出更多的患者,因而患者接受正确治疗的比例更高,分别提高3.80%和11.94%。SP263具有更高的灵敏度,使得更多的PD-L1表达阳性的患者被检测出来,从而有更多的患者可以在化疗后接受阿替利珠单抗单药治疗,所以SP263检测方案的总成本比22C3即用型、22C3浓缩液检测方案的总成本也更高。SP263检测方案相比22C3即用型检测方案,每正确诊断且正确治疗一位患者所增加的成本为9 449元,远低于1倍人均GDP,SP263检测方案具有成本效果(表2、3)。
2.1.2 晚期NSCLC患者
对于晚期NSCLC患者,与22C3即用型、 22C3浓缩液相比,SP263的检测灵敏度和特异度更高,可以正确诊断出更多的患者,因而患者接受正确治疗的比例更高,分别提高4.53%和14.25%。与22C3即用型、22C3浓缩液指导PD-L1高表达患者帕博利珠单抗单药治疗方案相比,SP263可以指导更多的PD-L1高表达患者接受阿替利珠单抗单药治疗、帕博利珠单抗单药治疗等多种免疫治疗药物单药治疗方案,且由于用药选择的多样性,SP263检测组患者的总成本也更低。相比22C3即用型、22C3浓缩液,SP263检测成本更低,正确诊断且正确治疗的比例更高,为绝对优势方案。
2.2 敏感性分析结果
2.2.1 早中期NSCLC患者
SP263检测方案对比22C3即用型检测方案,单因素敏感性分析结果表明,22C3即用型假阴性率、SP263假阴性率等因素对结果影响较大(图2)。SP263对比22C3浓缩液的单因素敏感性分析结果表明,在其他因素不变的情况下,22C3浓缩液假阴性率、PD-L1表达阴性比例等因素对结果影响较大(图3、4)。各参数变化时不改变基础分析结果,SP263检测为有成本效果的方案,每多正确诊断且正确治疗一位患者所增加的成本远低于1倍人均GDP。概率敏感性分析结果显示,在以1倍人均GDP为意愿支付阈值的情况下,SP263检测方案对比22C3即用型检测方案的散点70%落在阈值以下,说明SP263检测方案对比22C3即用型检测方案具有显著的成本效果。SP263检测方案对比22C3浓缩液检测方案的ICER值有约90%落在意愿支付线以下,说明SP263检测方案具有成本效果的概率为约90%,模型结果具有稳健性(图5)。
2.2.2 晚期NSCLC患者
SP263检测方案对比22C3即用型检测方案的单因素敏感性分析结果表明,在其他因素不变的情况下,化疗费用等因素对结果影响较大(图6)。SP263检测方案对比22C3浓缩液检测方案的单因素敏感性分析结果表明,化疗费用等因素对结果影响较大。各参数变化时不改变基础分析结果,SP263检测方案为有成本效果的方案,每多正确诊断且正确治疗一位患者所增加的成本远低于1倍人均GDP。概率敏感性分析结果显示, SP263检测方案对比22C3即用型检测方案和22C3浓缩液检测方案时,ICER值均有超过80%落在意愿支付线以下,说明SP263检测方案具有成本效果的概率超过80%,模型结果具有稳健性(图7~9)。
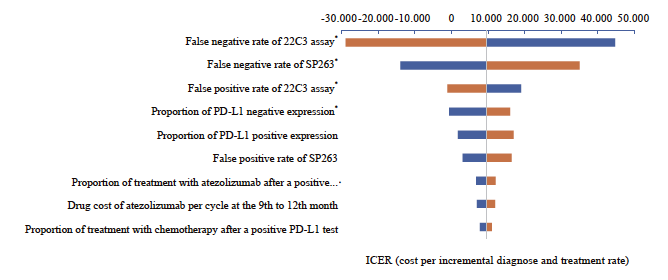
图2 用于早中期NSCLC生物标志物检测的SP263对比22C3即用型的单因素敏感性分析飓风图
Fig. 2 Tornado diagram of one-way sensitivity analysis for early to mid-stage NSCLC: SP263 vs 22C3 assay
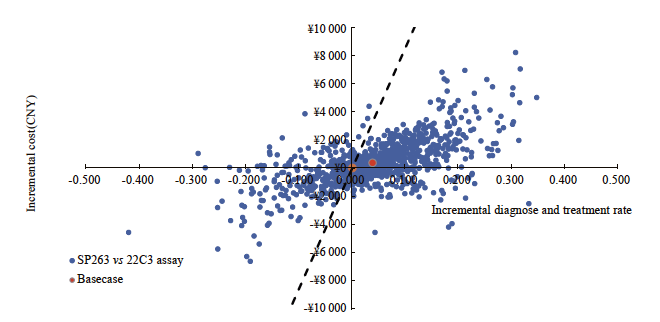
图3 用于早中期NSCLC生物标志物检测的SP263对比22C3即用型的增量成本效果散点图(意愿支付阈值为1倍人均GDP)
Fig. 3 Incremental cost-effectiveness scatter plot for early to mid-stage NSCLC: SP263 vs 22C3 assay (the willingness-to-pay threshold was set at one times the per capita GDP)

图4 用于早中期NSCLC生物标志物检测的SP263对比22C3浓缩液的单因素敏感性分析飓风图
Fig. 4 Tornado diagram of one-way sensitivity analysis for early to mid-stage NSCLC: SP263 vs 22C3 antibody concentrate
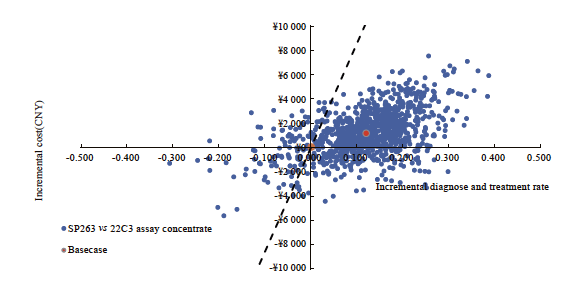
图5 用于早中期NSCLC生物标志物检测的SP263对比22C3浓缩液的增量成本效果散点图(意愿支付阈值为1倍人均GDP)
Fig. 5 Incremental cost-effectiveness scatter plot for early to mid-stage NSCLC: SP263 vs 22C3 antibody concentrate (the willingness-to-pay threshold was set at one times the per capita GDP)
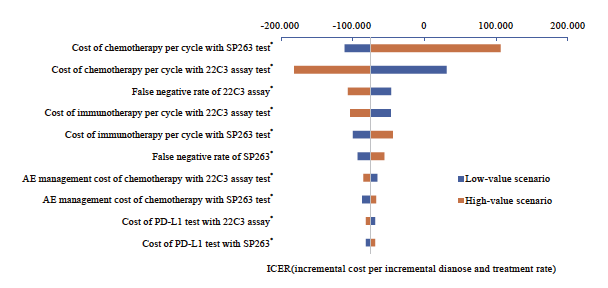
图6 用于晚期NSCLC生物标志物检测的SP263对比22C3即用型的单因素敏感性分析飓风图
Fig. 6 Tornado diagram of one-way sensitivity analysis for advanced NSCLC: SP263 vs 22C3 assay
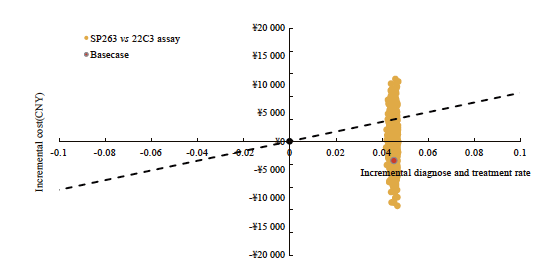
图7 用于晚期NSCLC生物标志物检测的SP263对比22C3即用型的增量成本效果散点图(意愿支付阈值为1倍人均GDP)
Fig. 7 Incremental cost-effectiveness scatter plot for advanced NSCLC: SP263 vs 22C3 assay (the willingness-to-pay threshold was set at one times the per capita GDP)
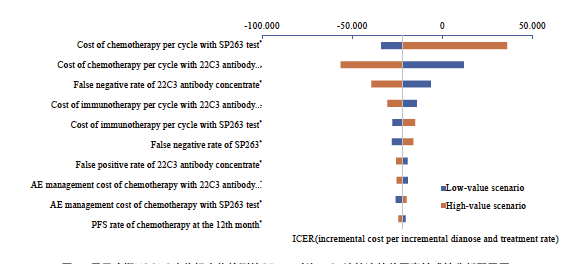
图8 用于晚期NSCLC生物标志物检测的SP263对比22C3浓缩液的单因素敏感性分析飓风图
Fig. 8 Tornado diagram of one-way sensitivity analysis for advanced NSCLC: SP263 vs 22C3 antibody concentrate
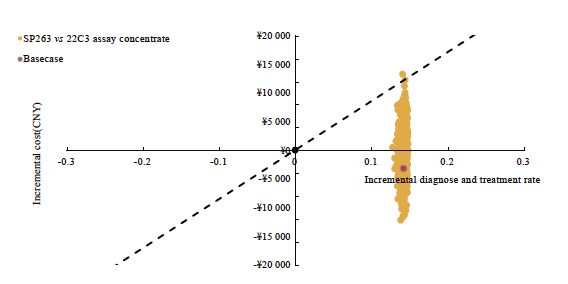
图9 用于晚期NSCLC生物标志物检测的SP263对比22C3浓缩液的增量成本效果散点图(意愿支付阈值为1倍人均GDP)
Fig. 9 Incremental cost-effectiveness scatter plot for advanced NSCLC: SP263 vs 22C3 antibody concentrate (the willingness-to-pay threshold was set at one times the per capita GDP)
3 讨 论
本研究通过决策树模型测算了不同免疫组织化学检测方式用于PD-L1检测并指导NSCLC患者免疫治疗的成本和健康产出,进一步体现了免疫组织化学检测的经济价值。结果显示,对于NSCLC早中期或晚期患者,与22C3即用型检测方案、22C3浓缩液检测方案相比,SP263检测方案均为具有经济性的方案。免疫组织化学检测是评估肿瘤组织PD-L1表达状态的一种有效且最常用方法,可以为PD-1/PD-L1抑制剂治疗的疗效提供预测性信息。Hurwitz等[20]的研究结果已表明基于德国的视角,体外诊断(in vitro diagnostic tests,IVD)检测相比临床实验室自建项目(laboratory-developed test,LDT)检测,虽然轻微提高了整体成本,但却更加有效,对指导PD-L1患者使用免疫治疗具有重要的影响,患者有更大概率得到正确治疗,从而增加患者的健康获益。基于巴西视角的一项研究[21]也比较了SP142对比22C3的经济性,以评估晚期三阴性乳腺癌患者是否适合接受免疫治疗,研究结果表明使用SP142检测指导患者后续治疗,可以改善患者的无进展生存期并节省费用。Wan等[22]的研究同时考虑了PD-L1检测方式和后续治疗方案的影响,但该研究认为在中美两国的情景分析中,与化疗相比,帕博利珠单抗联合化疗治疗NSCLC均不具有成本效果。此外,已有研究[23-24]比较了免疫疗法如帕博利珠单抗或阿替利珠单抗与化疗的成本效果,不同研究间的结果存在一定差异,但没有纳入考虑PD-L1检测对健康结果的影响。与既往研究不同的是,本研究不仅同时纳入了检测与后续治疗的分析,还进一步考虑了不同检测方法对应指导免疫治疗药物临床应用的差异,并综合比较了检测和治疗的成本效果。本研究结果表明,SP263检测相比其他检测方法具有成本效果,主要体现在两方面:首先,SP263可指导多种免疫治疗药物单药治疗,为患者提供了更多的用药选择,从而降低平均成本。其次,SP263可提高PD-L1检测的真阳性率和真阴性率(即可接受率更高),减少漏诊、误诊,从而提高患者的正确诊治率。另外,在全社会视角下,减少误诊、漏诊可以进一步缓解患者及家属的心理负担,节省不必要的医疗费用,减轻患者及全社会的相关负担。PD-L1检测作为应用PD-L1单抗类药物必不可少的伴随诊断产品,可以帮助识别或辅助预测可能从免疫治疗中获益的患者,尽早进行正确诊断及治疗,实现患者获益的最大化。
本研究也存在如下局限性:首先,由于SP263检测、22C3即用型检测、22C3浓缩液检测的准确率数据国内尚无具有代表性的统计数据可使用,本研究引用NordiQC的研报告结果,但是3种检测方法尚无分别发表的假阳性、假阴性数据,其数据通过NordiQC的报告中汇总的假阳性率、假阴性率的比例关系,结合3种检测方法各自的可接受率,分别推算得到,但本研究通过多位专家访谈验证在一定程度上可减少数据推算带来的不确定性。其次,晚期NSCLC的PD-L1检测假阳性患者,模型中后续治疗使用阿替利珠单抗单药或帕博利珠单抗单药,SP263检测可同时指导两种治疗方式的选择,但目前缺乏晚期NSCLC患者PD-L1检测阳性后使用阿替利珠单抗和使用帕博利珠单抗比例的中国的文献发表或真实世界研究数据,本研究经专家访谈获取,并通过敏感性分析表明药物使用比例对结果的影响较小。最后,本研究以1年时间作为研究时限,由于采用正确诊治率这一指标作为健康结局指标,虽在短期内可以较好地体现患者的健康获益,但缺乏长期经济性结果也是研究的局限性所在,未来仍可进一步探索基于QALY等指标进行衡量的短期及长期成本效果。最后,本研究基于模型法开展成本及效果的测算,为临床上的诊治决策提供基于卫生经学视角的证据,未来临床医师也可进一步通过真实世界的研究进行补充验证。
有效检测生物标志物从而正确选择获益人群是精准治疗的关键环节。PD-L1作为预测免疫检查点抑制剂用于NSCLC治疗的疗效预测生物标志物,已经被广泛应用于临床[25]。SP263作为具有成本效果的PD-L1检测方案,可用以筛选免疫治疗的获益群体,并且有助于判断患者的预后。期望本研究可以对中国NSCLC患者选择具有成本效果的PD-L1检测以及指导免疫治疗单药方案提供科学依据,助力中国NSCLC精准诊疗的发展。
第一作者及通信作者:
李 媛,主任医师,教授,复旦大学附属肿瘤医院病理科副主任。
作者贡献声明:
李媛负责研究设计、研究方法、数据解释、论文撰写、提供医学咨询。郭凌川、袁勇、郑强和金燕为本研究的设计、分析和解释提供了关键意见。明坚负责研究执行、文献综述、数据采集和分析。所有作者阅读并批准了提交的最终手稿。
[参考文献]
[1] ZHENG R S, CHEN R, HAN B F, et al. Cancer incidence and mortality in China, 2022[J]. J Natl Cancer Cent, 2024, 4(1): 47-53.
[2] LIU G B, PEI F, YANG F Q, et al. Role of autophagy and apoptosis in non-small cell lung cancer[J]. Int J Mol Sci, 2017, 18(2): 367.
[3] 中国抗癌协会肿瘤病理专业委员会肺癌协作组、分子病理协作组, 中国抗癌协会肺癌专业委员会, 中国临床肿瘤学会非小细胞肺癌专业委员会. 非小细胞肺癌PD-L1表达临床检测中国专家共识(2023版)[J]. 中华病理学杂志, 2024, 53(2): 121-129.
The Lung Cancer Collaboration Group and Molecular Pathology Collaboration Group of the Tumor Pathology Professional Committee of the China Anti-Cancer Association, the Lung Cancer Professional Committee of the Chinese Anti Cancer Association, and the Non-Small Cell Lung Cancer Professional Committee of the Chinese Society of Clinical Oncology. Chinese expert consensus on clinical testing standards of PD-L1 expression for non-small cell lung cancer (2023 version)[J]. Chin J Pathol, 2024, 53(2): 121-129.
[4] 中国抗癌协会肿瘤病理专业委员会肺癌学组, 中国抗癌协会肺癌专业委员会, PD-L检测共识专家组. 非小细胞肺癌PD-L1免疫组织化学检测规范中国专家共识[J]. 中国肺癌杂志, 2020, 23(9): 733-740.
Chinese Anti-Cancer Association, Lung Cancer Study Group of Committee of Oncopathology; Chinese Society of Lung Cancer; Expert Group on PD-L1 Testing Consensus. Chinese expert consensus on standards of PD-L1 immunohistochemistry testing for non-small cell lung cancer[J]. Chin J Lung Cancer, 2020, 23(9): 733-740.
[5] 中国抗癌协会肿瘤病理专业委员会, 中国临床肿瘤学会肿瘤病理专家委员会, 中国临床肿瘤学会非小细胞肺癌专家委员会. 中国非小细胞肺癌PD-L1表达检测临床病理专家共识[J]. 中华肿瘤杂志, 2020, 42(7): 513-521.
China Anti-Cancer Association Tumor Pathology Professional Committee, Chinese Society of Clinical Oncology Tumor Pathology Expert Committee, Chinese Society of Clinical Oncology Non-Small Cell Lung Cancer Expert Committee. Expert consensus on PD-L1 expression testing in non-smallcell lung cancer in China[J]. Chin J Oncol, 2020, 42(7): 513-521.
[6] 中国临床肿瘤学会(CSCO). 非小细胞肺癌诊疗指南2023[M]. 北京:人民卫生出版社.
Chinese Society of Clinical Oncology (CSCO). Diagnosis and treatment guidelines for non-small cell lung cancer 2023[M]. Beijing: People's Health Publishing House.
[7] 中华医学会肿瘤学分会, 中华医学会杂志社. 中华医学会肺癌临床诊疗指南(2023版)[J]. 中华医学杂志, 2023, 103(27): 2037-2074.
Chinese Medical Association Oncology Branch, Journal of Chinese Medical Association. Chinese Medical Association guideline for clinical diagnosis and treatment of lung cancer (2023 edition)[J]. Natl Med J China, 2023, 103(27): 2037-2074.
[8] NordiQC, PD-L1(lung) assessment run C1-C5(2017-2019)[EB/OL]. https://www.nordiqc.org/epitope.php?id=107.
[9] ZHENG Q, HUANG Y, ZENG X, et al. Clinicopathological and molecular characteristics associated with PD-L1 expression in non-small cell lung cancer: a large-scale, multi-center, realworld study in China[J]. J Cancer Res Clin Oncol, 2021, 147(5): 1547-1556.
[10] FELIP E, ALTORKI N, ZHOU C, et al. Overall survival with adjuvant atezolizumab after chemotherapy in resected stage Ⅱ-ⅢA non-small cell lung cancer (IMpower010): a randomised, multicentre, open-label, phase 3 trial[J]. Ann Oncol, 2023, 34(10): 907-919.
[11] HERBST R S, GIACCONE G, DE MARINIS F, et al. Atezolizumab for first-line treatment of PD-L1-selected patients with NSCLC[J]. N Engl J Med, 2020, 383(14): 1328-1339.
[12] RECK M, RODRÍGUEZ-ABREU D, ROBINSON A G, et al. Pembrolizumab versus chemotherapy for PD-L1-positive nonsmall-cell lung cancer[J]. N Engl J Med, 2016, 375(19): 1823-1833.
[13] CHEN P, YANG Q, LI Y F, et al. Cost-effectiveness analysis of adjuvant therapy with atezolizumab in Chinese patients with stage ⅠB-ⅢA resectable NSCLC after adjuvant chemotherapy[J]. Front Oncol, 2022, 12: 894656.
[14] GU X H, ZHANG Q, CHU Y B, et al. Cost-effectiveness of afatinib, gefitinib, erlotinib and pemetrexed-based chemotherapy as first-line treatments for advanced non-small cell lung cancer in China[J]. Lung Cancer, 2019, 127: 84-89.
[15] WU B, DONG B J, XU Y J, et al. Economic evaluation of firstline treatments for metastatic renal cell carcinoma: a costeffectiveness analysis in a health resource-limited setting[J]. PLoS One, 2012, 7(3): e32530.
[16] 汤雅倩, 赵明烨, 唐文熙. 信迪利单抗对比卡瑞利珠单抗一线治疗晚期非鳞状非小细胞肺癌的经济学评价[J]. 卫生经济研究, 2023, 40(2): 34-40.
TANG Y Q, ZHAO M Y, TANG W X. Pharmacoeconomic evaluation of sintilimab versus camrelizumab in the first-line treatment of patients with non-squamous advanced non-small cell lung cancer in China[J]. Health Econ Res, 2023, 40(2): 34-40.
[17] 石丰豪, 金 敏, 王子婧, 等. 卡瑞利珠单抗对比化疗方案二线治疗晚期或转移性食管鳞状细胞癌的成本效用分析[J]. 中国卫生经济, 2021, 40(12): 73-77.
SHI F H, JIN M, WANG Z J, et al. Cost-utility analysis of camrelizumab versus chemotherapy regimens for second-line treatment of advanced or met-astatic esophageal squamous cell carcinoma[J]. Chin Health Econ, 2021, 40(12): 73-77.
[18] 中华慈善总会泰圣奇慈善援助项目[EB/OL]. https://tpap.yao2000.com.cn/flow.html. China Charity Federation Tai Shengqi Charity assistance project[EB/OL]. https://tpap.yao2000.com.cn/flow.html.
[19] 中国初级卫生保健基金会生命之钥-肿瘤免疫治疗患者援助项目. https://smzy.ilvzhou.com/index.php?m=content&c=index&a=lists&catid=31.
China Primary Health Care Foundation's key to life-tumor immunotherapy patient assistance project [EB/OL]. https://smzy.ilvzhou.com/index.php?m=content&c=index&a=lists&cat id=31.
[20] HURWITZ J T, VAFFIS S, GRIZZLE A J, et al. Costeffectiveness of PD-L1 testing in non-small cell lung cancer (NSCLC) using in vitro diagnostic (IVD) versus laboratorydeveloped test (LDT)[J]. Oncol Ther, 2022, 10(2): 391-409.
[21] SHIMABUKURO HO R, MIOTI SEBASTIÃO M, VENEZIAN DE CARVALHO J P, et al. Cost-effectiveness analysis of the SP142 versus 22C3 PD-L1 assays in the treatment of atezolizumab plus nab-paclitaxel for patients with advanced triple negative breast cancer in the Brazilian private healthcare system[J]. J Med Econ, 2020, 23(11): 1340-1344.
[22] WAN N, ZHANG T T, HUA S H, et al. Cost-effectiveness analysis of pembrolizumab plus chemotherapy with PD-L1 test for the first-line treatment of NSCLC[J]. Cancer Med, 2020, 9(5): 1683-1693.
[23] HUANG M, LOU Y Y, PELLISSIER J, et al. Cost effectiveness of pembrolizumab vs standard-of-care chemotherapy as firstline treatment for metastatic NSCLC that expresses high levels of PD-L1 in the United States[J]. PharmacoEconomics, 2017, 35(8): 831-844.
[24] DING D, HU H B, LIAO M T, et al. Cost-effectiveness analysis of atezolizumab plus chemotherapy in the first-line treatment of metastatic non-squamous non-small cell lung cancer[J]. Adv Ther, 2020, 37(5): 2116-2126.
[25] 郭雪晶, 曹 赫, 周建娅, 等. PD-L1检测方法在非小细胞肺癌的研究进展[J]. 中国肺癌杂志, 2019, 22(1): 40-44.
GUO X J, CAO H, ZHOU J Y, et al. Progress on the study of PD-L1 detection methods in non-small cell lung cancer[J]. Chin J Lung Cancer, 2019, 22(1): 40-44.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#非小细胞肺癌# #PD-L1检测#
12