Developmental Cell 田进伟/李水洁/张健/季勇/于波合作团队揭示晚期动脉粥样硬化新机制,优化心血管事件防控
2024-12-28 论道心血管 论道心血管 发表于陕西省
本研究发现TREM2low泡沫状巨噬细胞在晚期动脉粥样硬化进程发挥重要作用,其具有低氧化磷酸化(OXPHOS)和高铁死亡敏感性的独特代谢特征。
心血管疾病已成为全球范围内的主要死亡原因之一,其导致的死亡占非传染性疾病死亡的50%以上,预计到2030年将导致超过2220万人死亡。晚期动脉粥样硬化斑块是首发或复发急性心血管缺血事件的核心病理生理基础。尽管抗栓和抗动脉粥样硬化等干预措施取得了一定成效,但即使在血脂达标的患者中,心血管事件复发风险依然较高。尤其在冠心病多支病变患者中,除了支架相关远期事件外,大多数复发的不良临床事件来源于残余晚期斑块。相比早期斑块的缓慢进展、可逆性及对干预的良好响应,晚期动脉粥样硬化斑块进展迅速,干预效果有限,且部分斑块存在药物抵抗。因此,深入揭示晚期动脉粥样硬化斑块的进展机制,制定精准化干预策略,对于降低急性心血管缺血事件的发生和复发至关重要。本研究旨在通过分子机制解析、精准医学技术与个性化治疗策略,探索有效干预晚期斑块的创新手段,实现心血管事件的精准防控。
铁死亡(ferroptosis)是一种通过铁依赖性脂质过氧化介导的程序性细胞死亡形式。在动脉粥样硬化进展过程中,有研究显示铁的大量累积以及关键铁代谢基因(如血红素加氧酶1 [HMOX1])的显著上调。因此,靶向铁死亡为晚期动脉粥样硬化治疗提供了可能性。然而,由于不同动脉粥样硬化阶段中巨噬细胞的复杂性,铁死亡对泡沫状巨噬细胞的影响仍不清楚。
2024年12月27日,哈尔滨医科大学田进伟/李水洁/季勇/于波研究团队,联合华东理工大学张健研究团队在晚期动脉粥样硬化治疗方面取得重要进展,在Cell子刊Developmental Cell杂志发表了题为“HMOX1-LDHB interaction promotes ferroptosis by inducing mitochondrial dysfunction in foamy macrophages during advanced atherosclerosis”的研究论文。该研究通过多组学和scRNA-seq分析,发现在晚期动脉粥样硬化中,大量的铁累积促进了泡沫状巨噬细胞的铁死亡,尤其是在TREM2low泡沫状巨噬细胞中。该细胞群表现出低氧化磷酸化(OXPHOS)的代谢特征,从而增加了对铁死亡的敏感性。在机制上,上调的HMOX1-乳酸脱氢酶B (LDHB)相互作用,促进Lon蛋白酶1 (LONP1)降解线粒体转录因子A (TFAM),导致线粒体功能障碍和铁死亡。通过使用靶向线粒体的活性氧(ROS)清除剂MitoTEMPO或LONP1抑制剂硼替佐米(bortezomib),可以恢复泡沫状巨噬细胞中的线粒体稳态并减轻动脉粥样硬化。总体而言,本研究阐明了晚期动脉粥样硬化中泡沫状巨噬细胞铁死亡的细胞特征和分子机制,并为其提供了潜在的治疗策略。
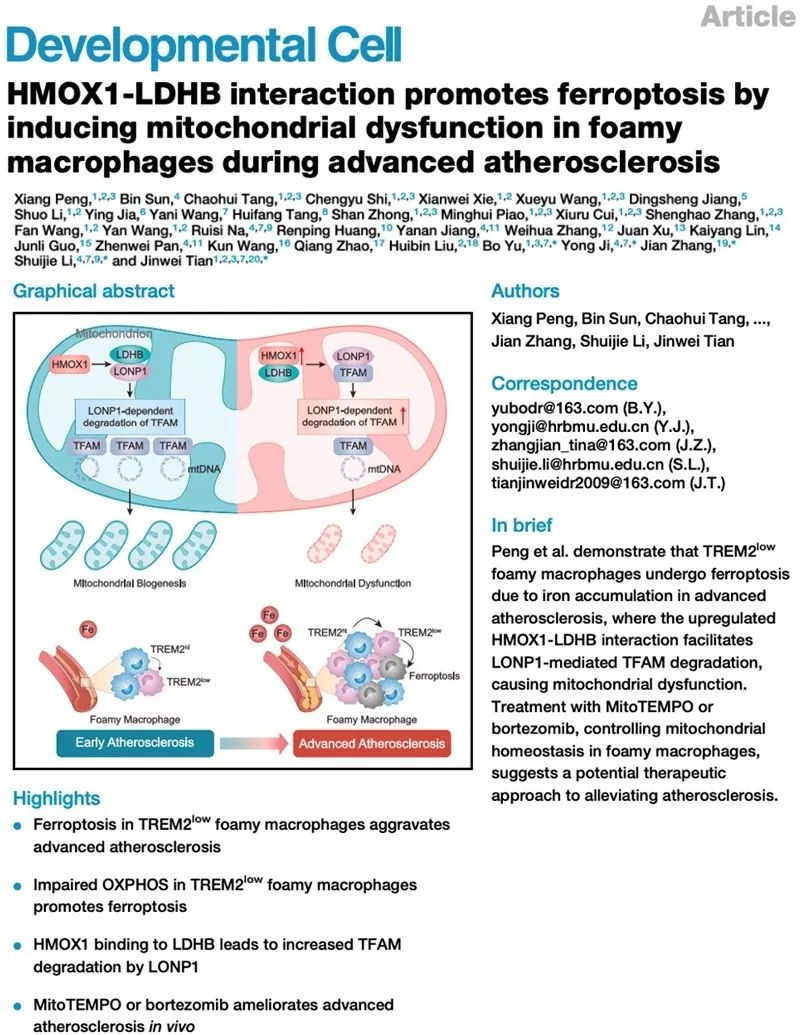
图1. HMOX1-LDHB直接相互作用阻碍了LDHB-LONP1结合,导致TFAM降解和线粒体功能受损,进而促进铁死亡和晚期动脉粥样硬化进展
研究者首先对人颈动脉斑块的bulk RNA-seq数据进行了KEGG富集分析,发现无论是晚期与早期斑块(GSE43292)还是不稳定与稳定斑块(GSE120521)相比较,结果均显示铁死亡显著富集。Perls’染色和4-HNE染色也进一步验证了人晚期斑块中的铁死亡水平显著高于早期斑块。为了识别与铁死亡相关的细胞群,本研究分析了人颈动脉斑块scRNA-seq数据(GSE159677),发现TREM2low泡沫巨噬细胞对铁死亡最为易感,并在所有髓系亚群中表现出最低的干性,处于巨噬细胞分化轨迹的末端。
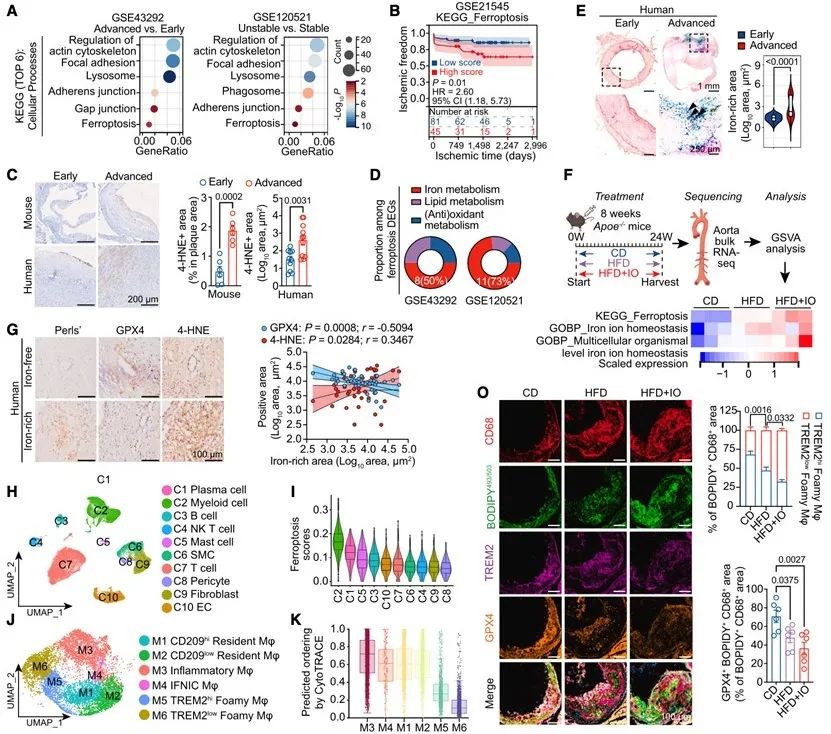
图2. 晚期动脉粥样硬化中TREM2low泡沫巨噬细胞铁死亡
为识别促进晚期动脉粥样硬化进展的关键因素,在四个数据集的14个交集DEGs中,HMOX1上调最为显著。HMOX1主要在巨噬细胞群中表达,特别是TREM2low泡沫巨噬细胞,这一点通过免疫荧光进一步验证。接着,本研究对OEHMOX1与OECtrl的TMT蛋白组学数据进行富集分析,发现在OEHMOX1中大量线粒体相关通路下调。
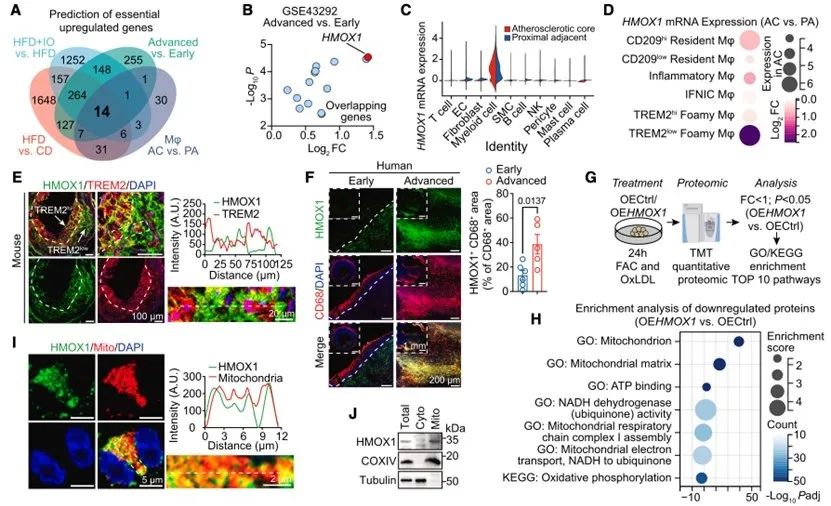
图3. HMOX1通过损伤线粒体功能诱导TREM2low泡沫巨噬细胞铁死亡
为确定HMOX1在线粒体功能调控中的下游靶标,本研究对HMOX1免疫沉淀的蛋白组学数据进行分析,确定了LDHB。通过免疫荧光、PLA、CoIP、GST-pull down等实验,进一步验证HMOX1与LDHB之间的结合。此外,蛋白-蛋白对接和分子动力学(MD)模拟揭示了LDHB与HMOX1之间存在特别稳定的结合模式。
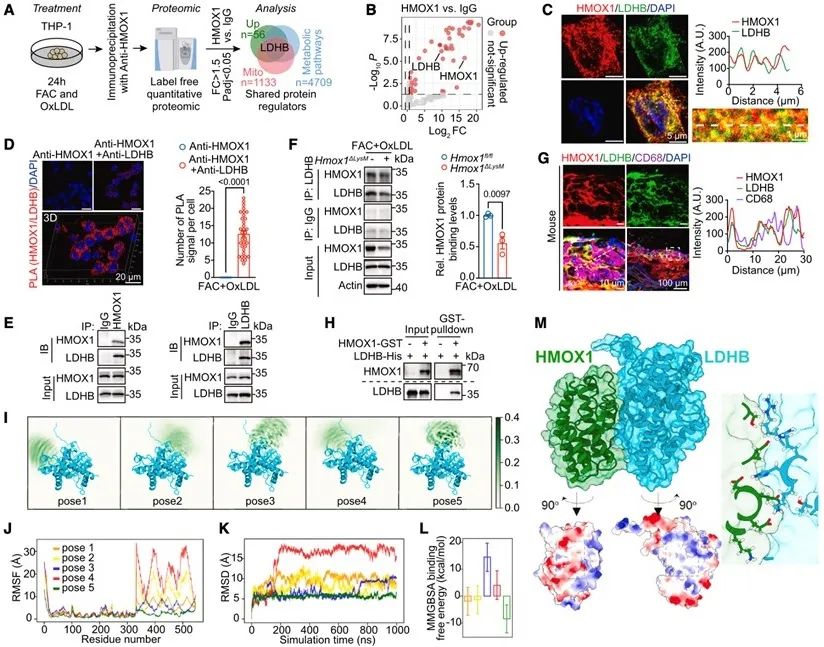
图4. HMOX1与LDHB在线粒体直接结合
为进一步确定LDHB在线粒体功能调控中的下游靶标,本研究对LDHB免疫沉淀的蛋白组学数据进行富集分析,鉴定出多条与线粒体相关的通路,并最终锁定LONP1,一个特异性AAA+ ATP依赖的TFAM降解蛋白酶。并通过免疫荧光、PLA、CoIP等实验,进一步验证LDHB与LONP1之间的结合。接着,在Hmox1∆LysM小鼠的BMDMs中,PLA实验证明线粒体中的LDHB-LONP1相互作用增加。蛋白-蛋白对接也显示LONP1-LDHB结合构象是一种保守的结合模式,重要的是,LONP1和HMOX1在LDHB上的结合表面存在重叠,提供了HMOX1和LONP1竞争性结合LDHB的结构基础。
为评估靶向LONP1治疗动脉粥样硬化的潜在应用价值,Apoe-/-小鼠在接受16周高脂饮食(HFD)和铁过载治疗期间给予LONP1抑制剂硼替佐米,组织病理染色显示,硼替佐米减轻泡沫巨噬细胞的线粒体功能障碍,并显著减少斑块和坏死核心面积。
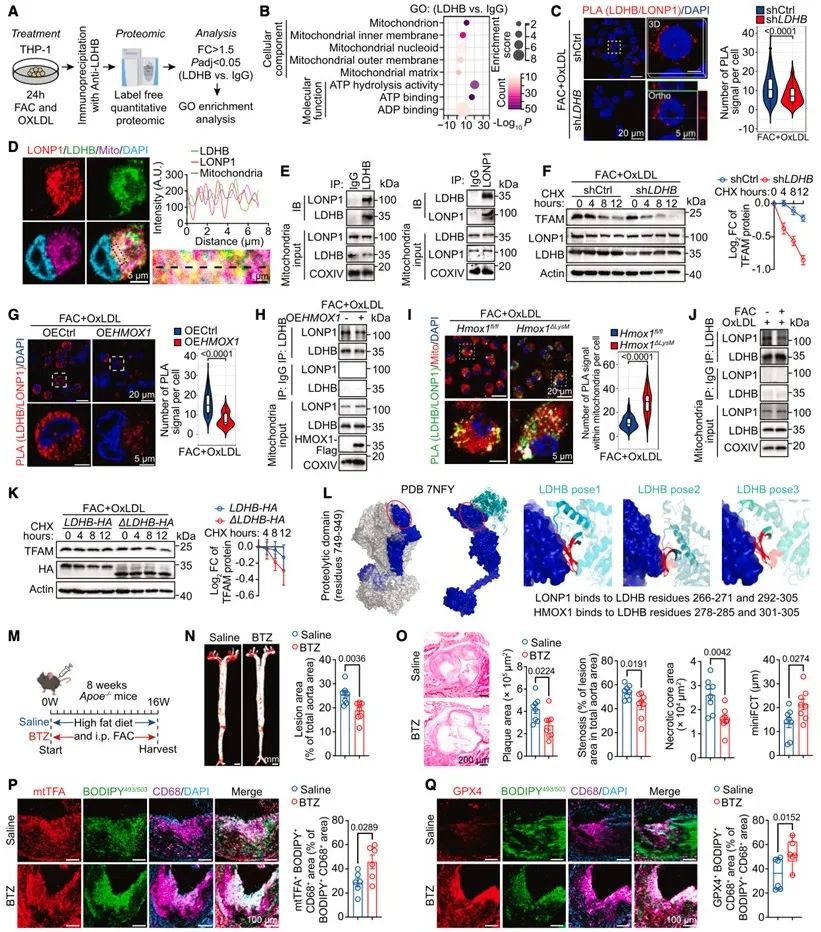
图5. HMOX1与LDHB相互作用促进LONP1降解TFAM
总结而言,本研究发现TREM2low泡沫状巨噬细胞在晚期动脉粥样硬化进程发挥重要作用,其具有低氧化磷酸化(OXPHOS)和高铁死亡敏感性的独特代谢特征。这一过程受到动脉粥样硬化中逐渐铁累积的推动。本研究建立了HMOX1/LDHB控制的线粒体功能障碍与TREM2low泡沫状巨噬细胞铁死亡之间的直接联系,为晚期动脉粥样硬化提供了潜在治疗策略。
原文链接:
https://www.cell.com/developmental-cell/abstract/S1534-5807(24)00733-0
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















#动脉粥样硬化# #铁死亡#
24