重庆医科大学附属第二医院任建丽教授团队研发AS诊疗一体化新策略
2024-12-25 论道心血管 论道心血管 发表于陕西省
重庆医科大学任建丽团队开发 PTna - 1 和 LyP - 1Lip@HS,分别通过靶向阻断、气酶联合治疗动脉粥样硬化,为诊疗提供新策略,成果发于两权威期刊。
动脉粥样硬化(Atherosclerosis, AS)是一种免疫介导的慢性炎症过程,以内皮下动脉粥样硬化斑块的形成为特征,其导致的急性心血管事件已成为导致人类死亡的主要病因。如何在急性心脑血管事件发生前准确地识别出含易损斑块且破裂风险高的患者并对其进行有效干预,已成为目前亟待解决的问题。目前,临床上通过药物对AS进行治疗的主流选择主要集中在降血脂、抗炎、抗血栓等方面。然而,上述单一一类药物仅能针对AS的某一项病理特征进行单方面地调控,难以实现同一时空下的协同效应;此外,这些药物均不具备成像、传感等检测功能,无法在治疗过程中同时实时监控AS的发展进程。因此,急需探索动脉粥样硬化斑块病理新机制,并开发能从源头高效调控AS致病因素的新策略。
针对AS复杂的病生特点和发病机制,重庆医科大学附属第二医院任建丽教授团队在Advanced Functional Materials发表了题为“Enhanced Macrophages Engulfment by Peptide-Templated Nanoassemblies Targeting SIRPα and Suppressing Oxidative Stress for Atherosclerosis Pro-Efferocytotic Therapy”的研究论文,开发了一种靶向阻断SIRPα恢复AS胞葬效应的多功能分子药物(PTna-1),清除斑块内凋亡细胞同时改善斑块炎性、氧化应激内环境,构建新型的AS诊疗一体化策略。

在研究中,团队通过固相肽合成法制备了多功能肽Peptide-1,并成功将其与四羧基苯基锰卟啉(MnTCPP)结合形成稳定的PTna-1纳米粒子。透射电镜及圆二色谱分析显示,PTna-1具备二级结构,且呈现纳米尺度的球形结构,并具有良好的生物相容性。
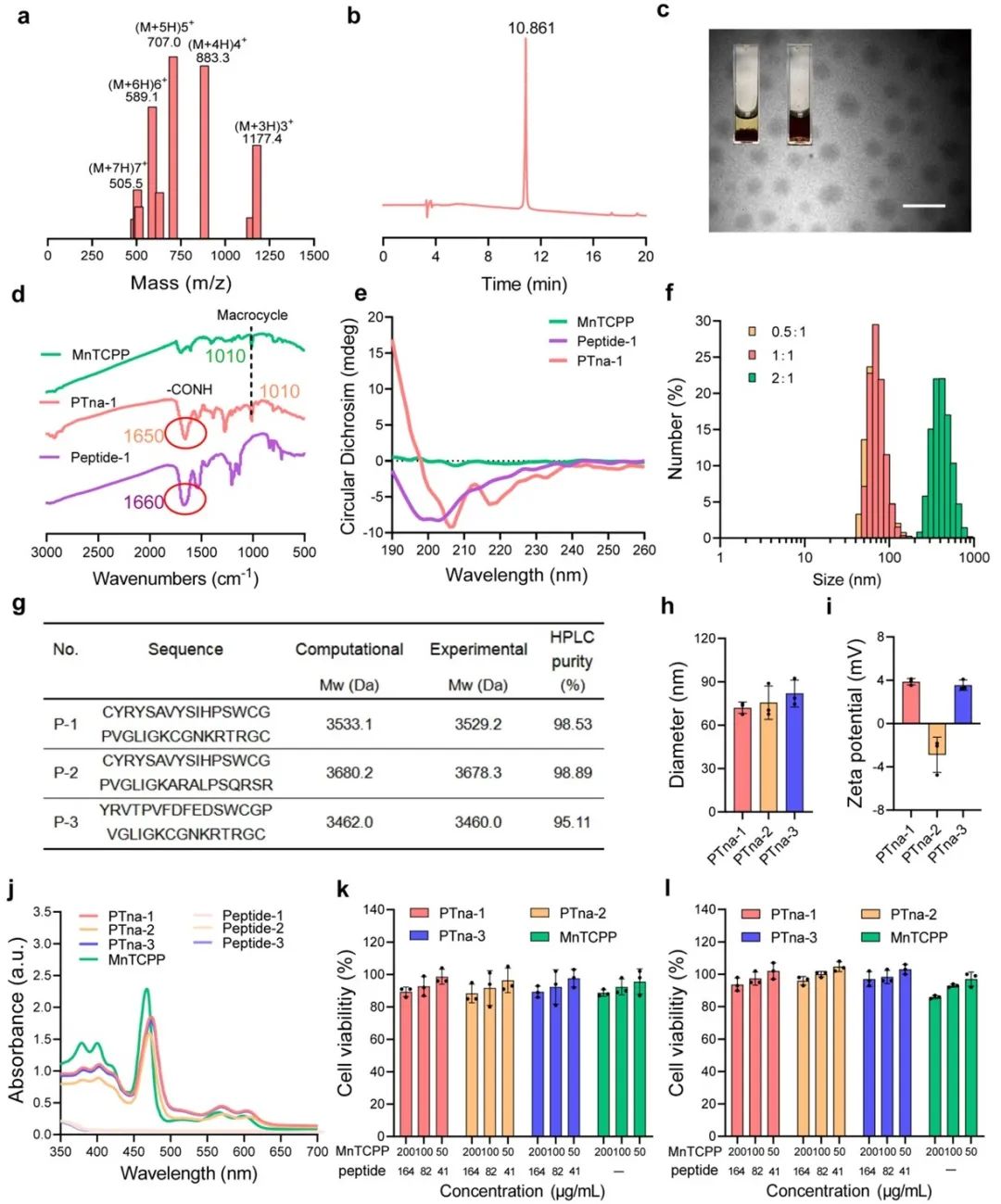
图1. 肽模板自组装体PTna-1的制备及关键性能评价
斑块内巨噬细胞内化了PTna-1后,在金属基质蛋白酶-9 (MMP-9)的刺激下迅速解离并释放出D4-2和MnTCPP。D4-2肽然后与表达在巨噬细胞表面的SIRPα结合,阻断CD47-SIRPα相互作用,从而恢复斑块内的吞噬缺陷,防止继发性坏死和凋亡细胞分泌炎症细胞因子。此外,释放的MnTCPP清除了病变部位的过量活性氧,通过抑制RhoA/ROCK1途径协同增强巨噬细胞的吞噬作用。
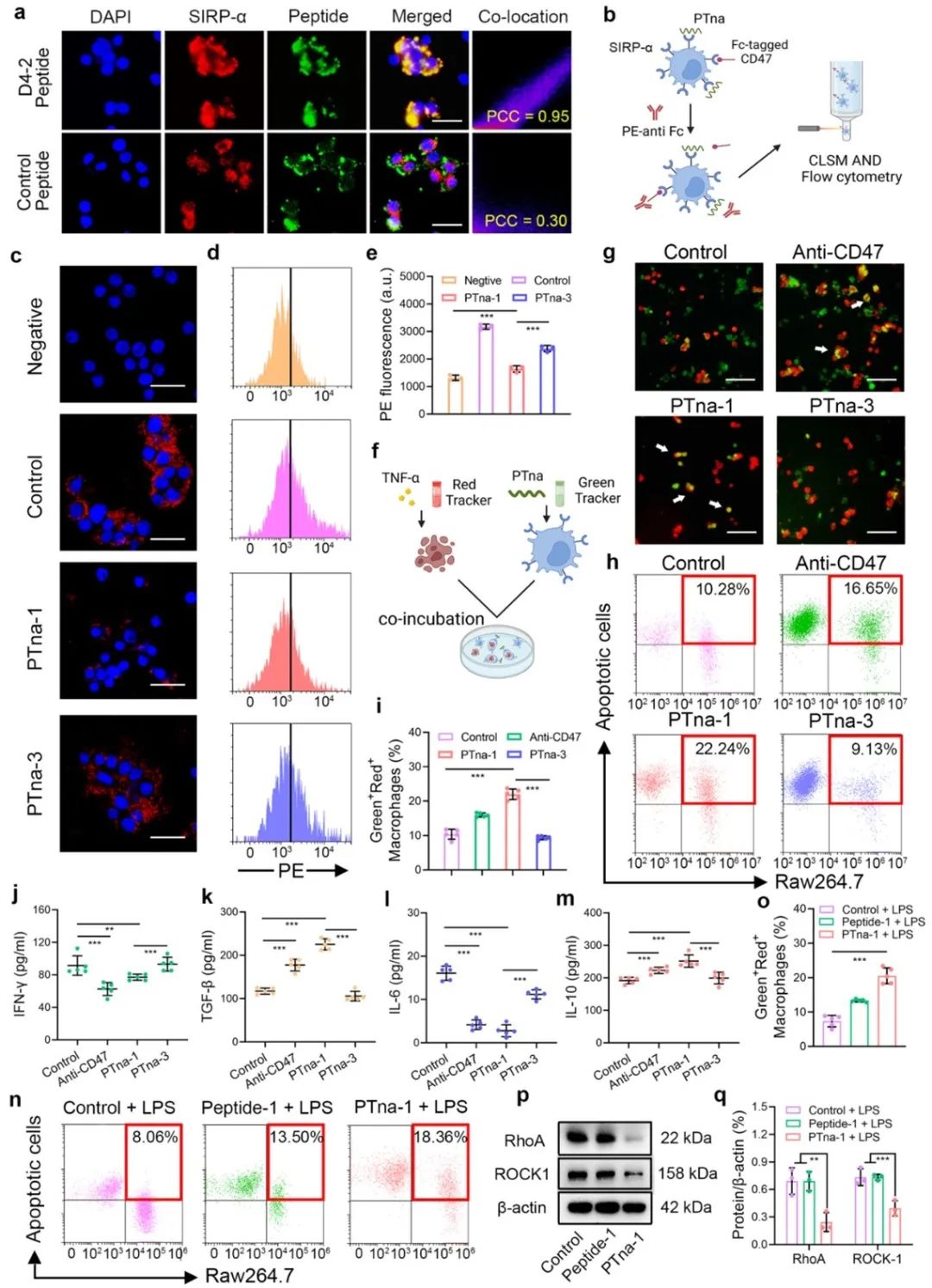
图2. PTna-1用于阻断CD47-SIRPα及增强体外胞葬效应的评估
综上,团队成功构建一种以加强斑块内胞葬效应为主要方式的抗AS纳米药物平台,阐明联合治疗在清除斑块内凋亡坏死细胞,抑制坏死核心扩张,改善炎性、氧化应激等多方面的作用机制,并评估了该纳米平台治疗AS的效能。
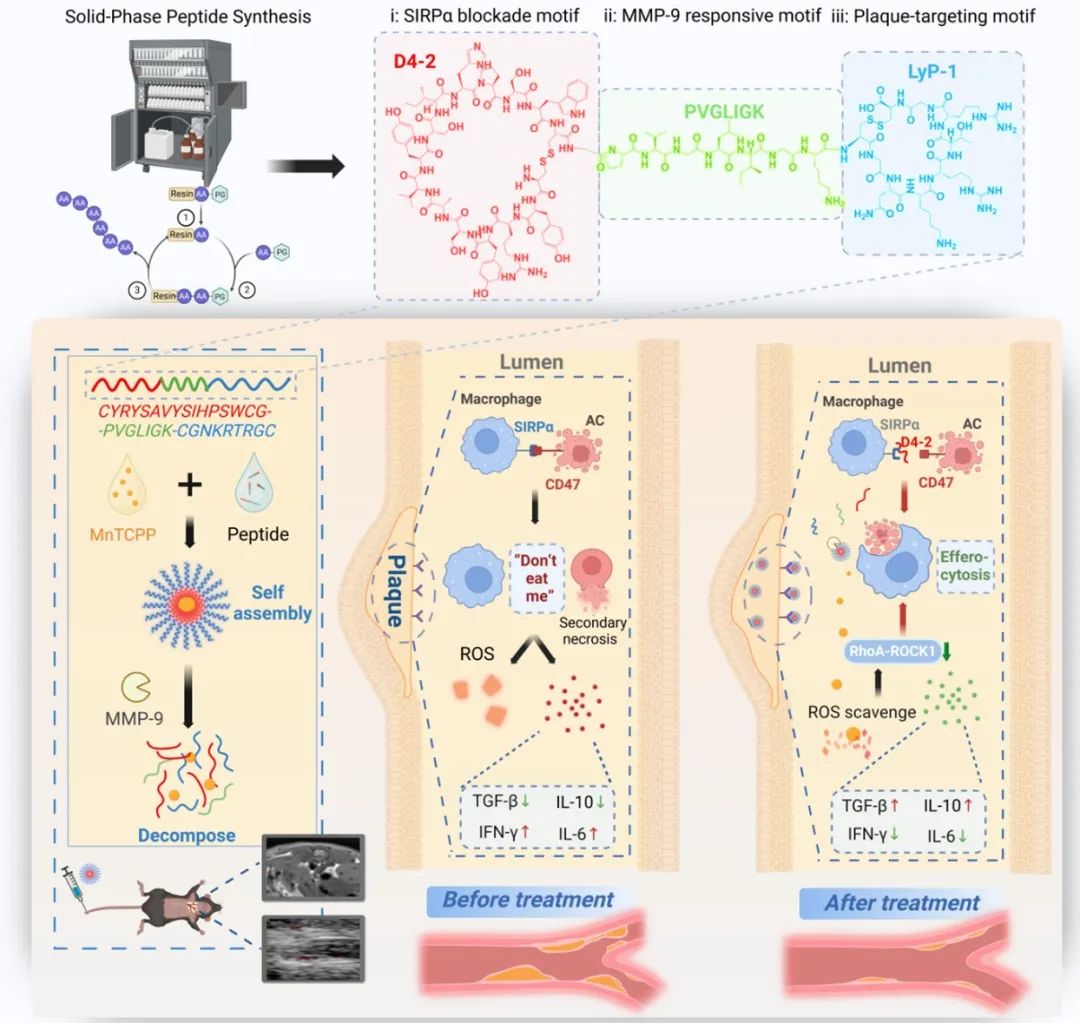
图3. 肽模板纳米组装体SIRPα特异性阻断和抑制氧化应激治疗动脉粥样硬化的示意图
论文链接:
https://onlinelibrary.wiley.com/doi/abs/10.1002/adfm.202414017
硫化氢(Hydrogen sulfide, H2S)被认为是继一氧化氮和一氧化碳后发现的第三种气体信号分子。近期有研究发现,H2S对心血管疾病具有明显的调控作用。基于此发现,任建丽教授团队通过整合多酶样纳米酶和内源性H2S气体疗法来治疗AS,构建了一种名为LyP−1Lip@HS的多功能纳米平台。研究成果以论著形式在Biomaterials 上在线发表题为“LIFU-unlocked endogenous H2S generation for enhancing atherosclerosis-specific gas-enzymatic therapy”的研究论文。

团队设计了一种基于内源性硫化氢供体S-烯丙基-L-半胱氨酸(SAC)和中空介孔普鲁士蓝(HMPB)纳米酶的肽功能化脂质纳米平台。硫化氢供体SAC装载在HMPB中并通过肽功能化脂质膜进行封装,不仅有效防止了气体泄露,还赋予了其主动靶向能力,克服了气体治疗的局限性。
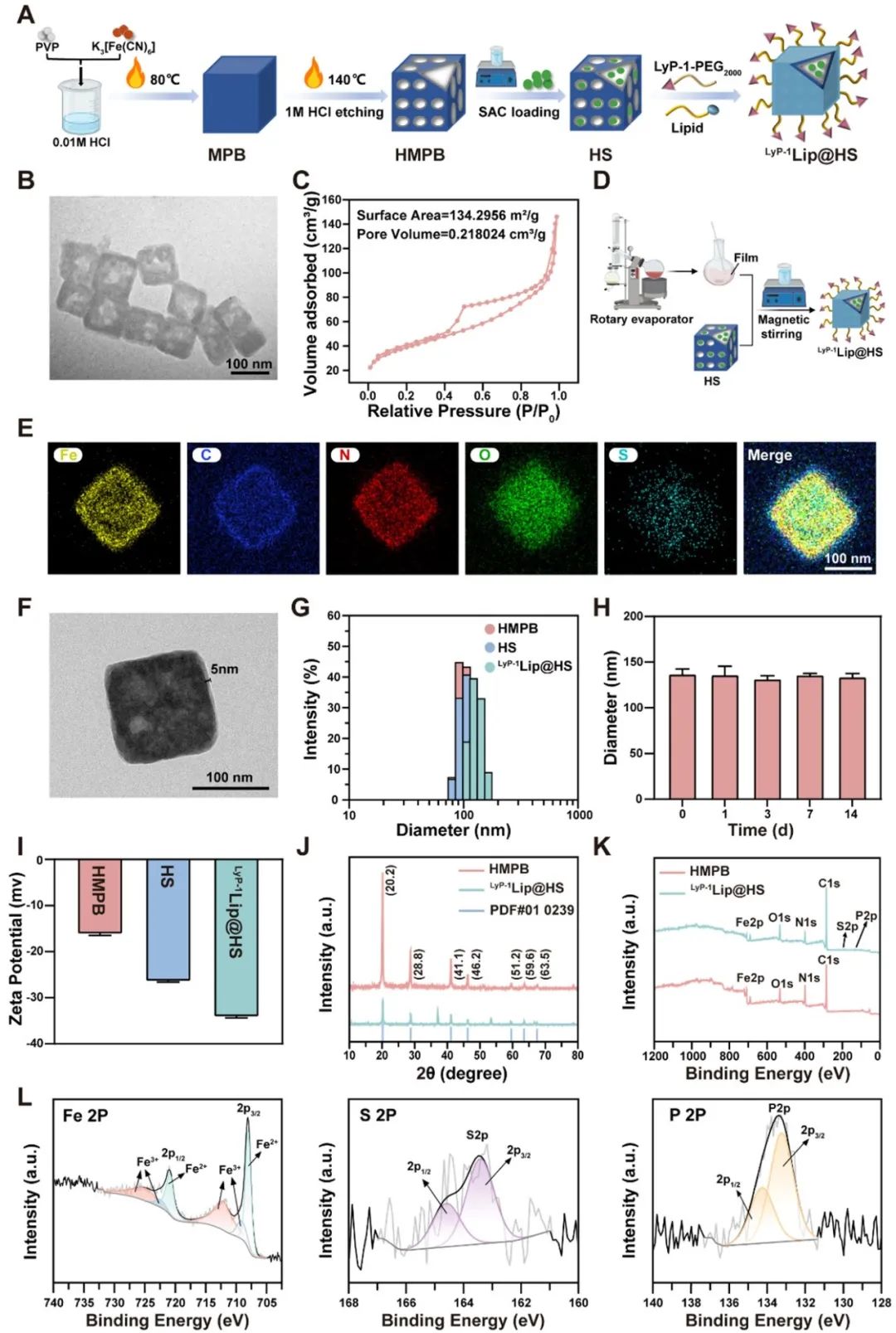
图4. 气酶联合治疗纳米平台LyP-1Lip@HS的制备与表征
在LyP-1介导LyP- 1Lip@HS递送到斑块后,低强度聚焦超声(LIFU)诱导的空化促进了脂质膜的分解,从而在动脉粥样硬化斑块内可控地释放HMPB和SAC。胱硫醚-β-合酶(CBS)和胱硫醚-γ-裂解酶(CSE)将SAC转化为H2S,增加泡沫细胞氧化型低密度脂蛋白外泄,促进巨噬细胞由促炎表型(M1表型)向抗炎表型(M2表型)分化,抑制炎症。此外,HMPB可通过与H2S协同作用,有效清除过量ROS,进一步缓解炎症紊乱。
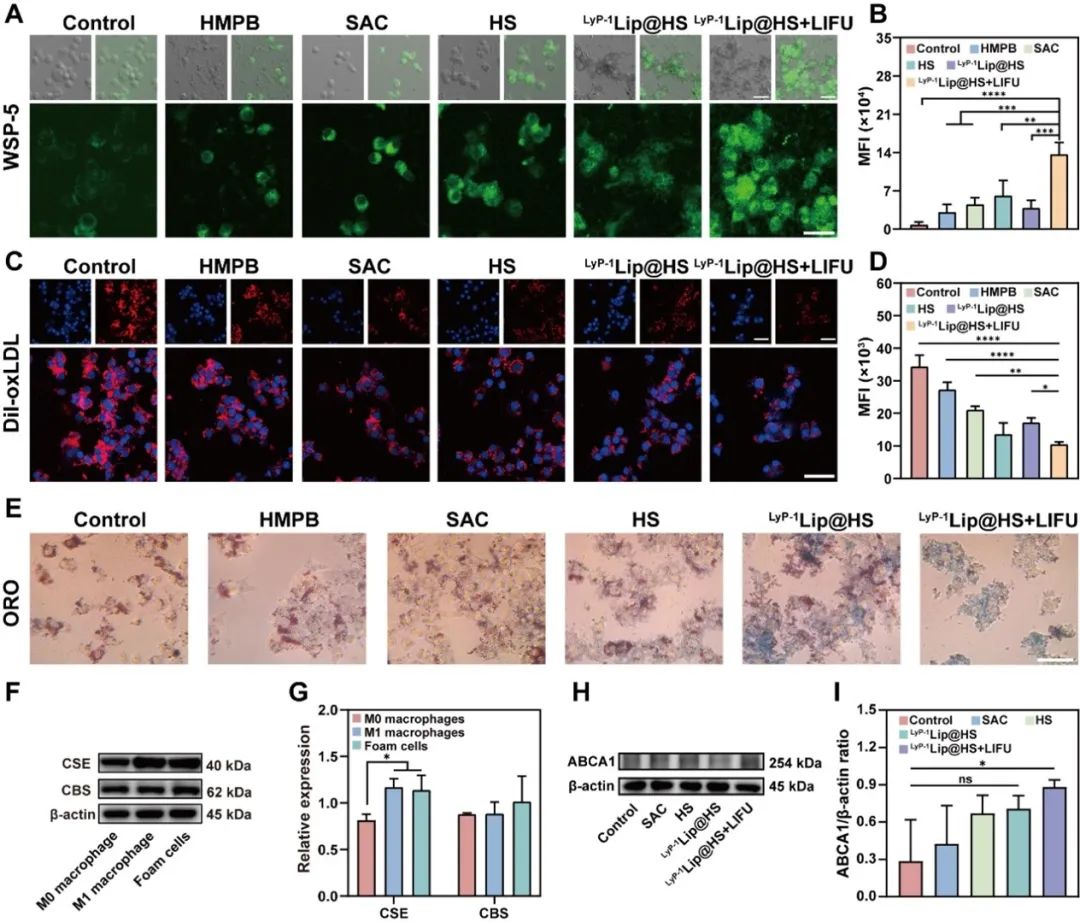
图5. 体外H2S生成检测及对氧化型低密度脂蛋白外排作用评价
总之,团队开发了一种具有多酶模拟活性和生成内源性硫化氢的AS靶向纳米平台,阐明了气酶联合治疗在改善斑块内炎性、氧化应激及脂代谢紊乱的相关机制,表现出较好的临床应用前景。
论文链接:
https://www.sciencedirect.com/science/article/abs/pii/S0142961224005076
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















#动脉粥样硬化# #诊疗一体化#
0