动脉粥样硬化不止是胆固醇的错!Cell Metabolism 最新研究揭秘反式脂肪酸也是“罪魁祸首”之一
2024-12-17 梅斯学术 MedSci原创 发表于陕西省
这项研究为理解反式脂肪酸如何危害心血管提供了更深入的理解,也指出了潜在的治疗靶点:SPT可能作为减轻TFA诱导的ASCVD的潜在治疗靶点。
已知过量的胆固醇会形成动脉阻塞斑块,导致中风、动脉疾病、心脏病发作等,使其成为许多心脏健康运动的焦点。而他汀类药物便是专门针对胆固醇的,加上饮食和锻炼等生活方式干预的发展,为心血管健康保驾护航。但胆固醇是唯一的“罪魁祸首”吗?还有其他因素吗?
近日,美国索尔克研究所等单位的研究人员在Cell Metabolism上发表了研究成果,研究发现通过饮食摄入的反式不饱和脂肪酸会通过特定的酶促进另一种脂质——鞘脂的合成,进而驱动动脉斑块形成以及动脉粥样硬化性心血管疾病(ASCVD)进展,揭示了反式脂肪酸通过影响鞘脂生物合成和脂蛋白影响心血管健康,为预防和治疗动脉粥样硬化性心血管疾病提供了新的思路。

研究内容与思路
一、反式脂肪优先被SPT代谢,而不是顺式不饱和脂肪酸(CFA)
鞘脂合成的限速酶SPT催化长链碱基(LCBs)的合成,之前已有研究表明饱和酰基辅酶A主要被作为SPT的替代底物进行研究,但是单不饱和脂肪酸(MUFAs)在饮食和组织中却非常丰富。对此,研究人员探讨了MUFAs掺入LCBs及其后续代谢的程度。研究人员使用与白蛋白结合的100 mM脂肪酸培养Huh7细胞48小时,并通过定量水解鞘脂测量SPT活性,以检测油酸或反式油酸衍生出的LCBs。结果表明,反式油酸掺入鞘氨醇d20:1(SA d20:1)和鞘氨醇d20:2(SO d20:2)的LCBs的水平分别是油酸的8倍和15倍。这证明反式不饱和脂肪酸(TFA)优先被SPT掺入到鞘脂代谢中,而不是顺式不饱和脂肪酸(CFA)。
接着,研究人员使用特定的多反应监测(MRMs)方法评估了MUFAs掺入完整的细胞鞘脂中的情况,发现双键构型会影响不同阶段鞘脂生物合成的通量,其中,TFA在结构上与典型的饱和SPT底物相似,所以更倾向于被掺入LCBs中。随后,研究人员进一步探讨了这些CFA和TFA处理对整体脂质组的影响,结果显示,油酸优先用于磷脂酰胆碱(PC)和磷脂酰乙醇胺(PE)合成,而反式油酸则更多地富集于溶血磷脂中。
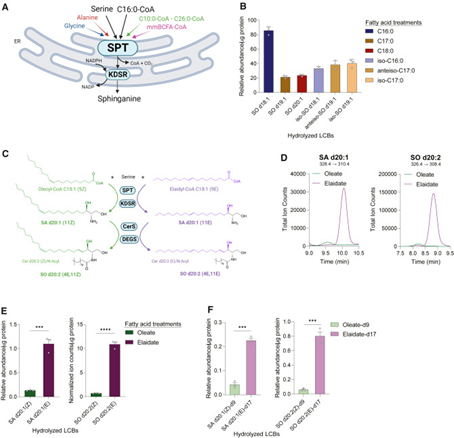
研究思路:鞘脂是一类多样的生物活性脂质,它们在生理过程中起着关键作用。鞘脂也与包括ASCVD、非酒精性脂肪肝、肥胖、糖尿病甚至是神经退行性疾病等多种疾病相关,有望成为多种疾病的生物标志物。不过,饮食如何影响鞘脂合成,又如何形成动脉粥样硬化斑块仍是未知数。对此,研究人员从鞘脂的生物合成出发,SPT是鞘脂生物合成的限速酶,调节脂肪酸和氨基酸合成鞘脂的过程。在这个过程中,研究人员发现,同样是不饱和脂肪酸,与顺式脂肪酸相比,SPT更加青睐反式不饱和脂肪酸。
二、TFA驱动鞘磷脂分泌
鞘磷脂(SM)是血液中最丰富的鞘脂,主要存在于脂蛋白中,其在血浆中的含量与ASCVD呈正相关。因此,研究人员定量检测了不同脂肪酸(包括油酸-d9和反油酸-d17)处理下Huh7细胞向培养基中分泌的SM。结果表明,与顺式异构体油酸或饱和棕榈酸和硬脂酸相比,反式油酸诱导Huh7细胞的SM总分泌通量最高。这种选择性分泌反式油酸衍生的SM进一步强调了TFA在鞘脂生物合成途径中的独特代谢特征。
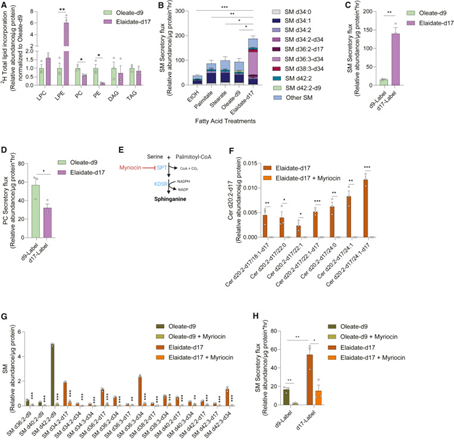
研究思路:反过来,研究人员给予了细胞不同脂肪酸来评估鞘脂合成情况,从而说明SPT限速酶更青睐于反式油酸,促进下游鞘脂分泌,进而导致斑块形成。
三、SPT抑制剂可减轻反式脂肪驱动的肝脏脂质代谢失调
研究人员使用Ldlr-/-小鼠来模拟高脂血症和动脉粥样硬化模型,给予不同饮食喂养,结果发现与顺式高脂饮食(Cis HFD)喂养的小鼠相比,反式高脂饮食(Trans HFD)喂养的小鼠表现出更严重的肝脂肪变性且肝脏重量和纤维化标志物Col1a1表达增加。
进一步对肝脏进行了脂质组学检测,结果发现,相比于Cis HFD,Trans HFD可导致甘油二酯(DGs)和总脂肪酸水平升高,而这些物质以及中性脂质甘油三酯(TGs)和胆固醇酯(CEs)可被myriocin(SPT抑制剂)降低;PC、PE、溶血磷脂酰胆碱(LPC)和溶血磷脂酰乙醇胺(LPE)水平在Trans HFD组中上升,但在myriocin作用下进一步增加。这表明myriocin是通过将脂肪酸从鞘脂池转向磷脂,而不是整体减少脂质摄取来重塑脂质代谢。
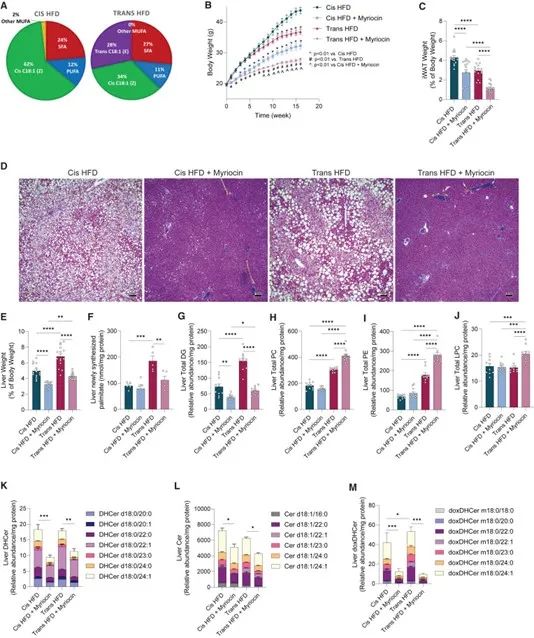
研究思路:体外验证结束后,研究人员开展了体内实验,给予相应小鼠不同饮食后评估小鼠的动脉粥样硬化情况。研究发现反式高脂饮食会导致小鼠出现更明显的脂肪肝及肝纤维化,而采用SPT抑制剂则可以抑制这种情况的出现。此外,脂质组学发现SPT抑制剂是通过将脂肪酸从鞘脂池转向磷脂来抑制脂肪肝出现或加重。
四、膳食反式脂肪诱导肝脏中鞘脂和极低密度脂蛋白(VLDL)分泌
接下来,为了评估每种饮食对肝脏鞘脂的影响,研究人员对循环中的鞘脂进行定量,观察到Trans HFD组血浆中的二氢神经酰胺(DHCer)和脱氧二氢神经酰胺(doxDHCer)总体水平显著增加,1-磷酸-鞘氨醇(S1P d18:1)水平略有降低。
此外,研究人员在喂食不同饮食的Ldlr-/-小鼠中测量了肝脏VLDLs的分泌情况。通过给小鼠注射tyloxapol(脂蛋白酶抑制因子)并随时间量化循环中的TGs水平(代表了分泌的VLDL)。结果表明,与Cis HFD相比,Trans HFD显著加速了肝脏VLDL的分泌。因此研究人员进一步假设SPT活性支持由肝脏组装和分泌到血液中。将myriocin掺入饮食中显著降低了Trans HFD诱导的VLDL分泌,突出了膳食TFA、鞘脂生物合成和导致动脉粥样硬化的VLDL之间的功能联系。
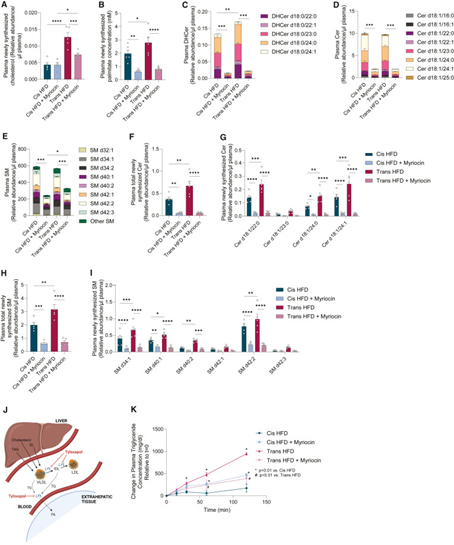
研究思路:发现了SPT抑制剂发挥作用的方式后,研究人员从鞘脂入手,探讨饮食对于鞘脂的影响,证实了反式高脂饮食的确会导致鞘脂分泌增多,与体外实验所得结果相一致。进一步,研究人员评估了小鼠动脉粥样硬化情况,发现反式高脂饮食同样会导致VLDL分泌增加,而SPT抑制剂可以减少这种情况的发生。
五、鞘脂可促进动脉粥样硬化
研究人员通过测量主动脉根部瓣膜上的动脉粥样硬化病变,来探究SPT活性和TFA如何影响ASCVD的进展。结果与预期一致:与Cis HFD发现的脂肪条纹相比,Trans HFD显著增加了主动脉根部内的动脉粥样硬化病变面积。同样地,喂食Trans HFD的小鼠的血浆VLDL-胆固醇(VLDL-C)、VLDL-TG和VLDL-SM增加,这些现象都在myriocin作用下得到了减轻。此外,血浆脂质组检测和体外稳定同位素示踪均表明TFA驱动的SPT通量促进了Ldlr-/-小鼠的肝脏脂蛋白分泌和动脉粥样硬化的发展。最后,人类肝脏的转录分析揭示了SPTLC2与SPTLC3亚基的表达存在明显不同的调控,这与ASCVD中的人类遗传相关性一致,进一步确立了在特定膳食脂肪的影响下,鞘脂代谢是介导ASCVD进展的关键节点。
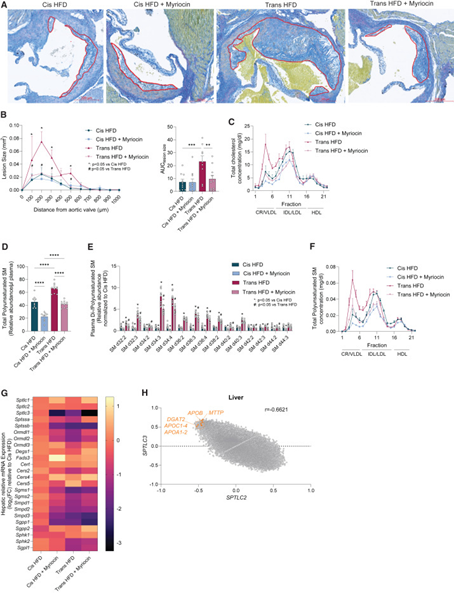
研究思路:VLDL是评估动脉粥样硬化主要指标之一,表明了反式高脂饮食可能会导致动脉粥样硬化。对小鼠的主动脉进行病理检查,肯定了反式高脂饮食的确导致小鼠出现动脉粥样硬化,对小鼠进行进一步脂质组学检测,肯定了反式高脂饮食会导致SM分泌增加,从而出现动脉粥样硬化,而SPT抑制剂可以挽救这一现象。最终,研究人员还获得了人类样本,进行了转录组检测,肯定了SPT这一基因的重要性,变相证明了鞘脂的作用。
小结
综上所述,TFA模仿SFA来驱动SPT的通量,并与肝脏脂蛋白分泌协同作用,将致动脉粥样硬化的鞘脂和胆固醇输送到循环中。这项研究为理解反式脂肪酸如何危害心血管提供了更深入的理解,也指出了潜在的治疗靶点:SPT可能作为减轻TFA诱导的ASCVD的潜在治疗靶点。
之前研究已经表明反式脂肪酸的坏处,我们或多或少也了解过反式脂肪酸,但是没想到它竟然这么坏!
参考资料:
[1]Gengatharan JM, Handzlik MK, Chih ZY, et al. Altered sphingolipid biosynthetic flux and lipoprotein trafficking contribute to trans-fat-induced atherosclerosis.Cell Metab. Published online November 13, 2024. doi:10.1016/j.cmet.2024.10.016
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#动脉粥样硬化# #反式不饱和脂肪酸#
5