喻翠云/魏华教授团队《ACS Nano》:基于二甲双胍的多功能纳米平台作为DNA损伤放大器,用于最大化放射免疫治疗以克服放疗耐受
2025-04-13 BioMed科技 BioMed科技
湖南中医药研究院和南华大学团队构建基于二甲双胍的纳米复合物 CSMT,可放大 DNA 损伤信号,增强放疗诱导的抗肿瘤免疫,抑制肿瘤生长,为克服放疗抵抗提供新方案。
在临床癌症治疗中,近半数的患者会接受放射治疗(RT)或RT与其他治疗方式相结合的治疗方式。放射治疗(RT)已经被视为是一种通过引起直接DNA损伤来激活抗肿瘤免疫的有效策略,但由于环状GMPAMP合酶(cGAS)对胞质DNA(cDNA)的识别受损,其通常具有较低的反应率。因此,如何克服放疗抵抗,实现最大化的放射免疫治疗,对于临床上肿瘤的放射治疗方案改善具有重要的意义。

近日,湖南中医药研究院喻翠云教授和南华大学魏华教授团队在《ACS Nano》杂志(IF=15.8)在线发表了题为“A Metformin-Based Multifunctional Nanoplatform as a DNA Damage Amplifier for Maximized Radio-Immunotherapy to Overcome Radiotherapy Resistance”的工作。该研究报道了一种基于二甲双胍(MET)的多功能纳米复合物CS-MET/ siTREX1 (CSMT)用于放大初始DNA损伤信号,最终增强放射治疗(RT)诱导的抗肿瘤免疫。这项研究的独特性在于CSMT作为一种特异性DNA损伤放大因子,它可以促进cDNA的积累,从而使放射免疫疗法最大化,并避免RT的耐受。
尽管RT在肿瘤治疗中的地位日益突出,但其治疗效果并不理想。RT抵抗可能导致局部治疗失败,甚至癌症复发。一般来说,RT的效果取决于细胞DNA损伤的程度及其累积效应。肿瘤部位存在多种因素诱导放疗抵抗,主要包括DNA损伤修复,胞浆DNA清除,肿瘤微环境免疫抑制等。如,高剂量的辐射会诱导核酸外切酶TREX1的表达上调,加速清除胞浆DNA,抑制抗肿瘤免疫。因此,在肿瘤部位积累足够多的RT诱导的cDNA可能使cGAS-STING途径激活的抗肿瘤免疫实现最大化。
本研究使用双胍修饰的壳聚糖(CS-MET)作为载体和3'-5'DNA核酸外切酶TREX1 siRNA(siTREX1)作为治疗基因,构建多功能纳米复合物CS-MET/siTREX1(CSMT)用于特异性放大DNA损伤,促进cDNA积累,最终增强RT诱导的抗肿瘤免疫。
CSMT纳米复合物不仅通过MET修饰提高了基因转染效率,而且还显示出协同治疗效果,包括MET对DNA修复的抑制作用和siTREX1对cDNA清除的衰减作用。CSMT纳米复合物在Hepa1-6近端/远端肿瘤模型中显示出显著的抗肿瘤作用,对原发肿瘤的肿瘤生长抑制(TGI)值为99.1%,并通过诱导免疫原性细胞死亡(ICD)显著损害远端肿瘤生长,促进肿瘤相关中性粒细胞(TAN)极化,并刺激肿瘤特异性记忆T细胞生成(图1)。

图1. CSMT纳米复合物的抗肿瘤机制示意图(a:放疗抵抗的一般机制;b:CSMT的抗肿瘤作用机制)
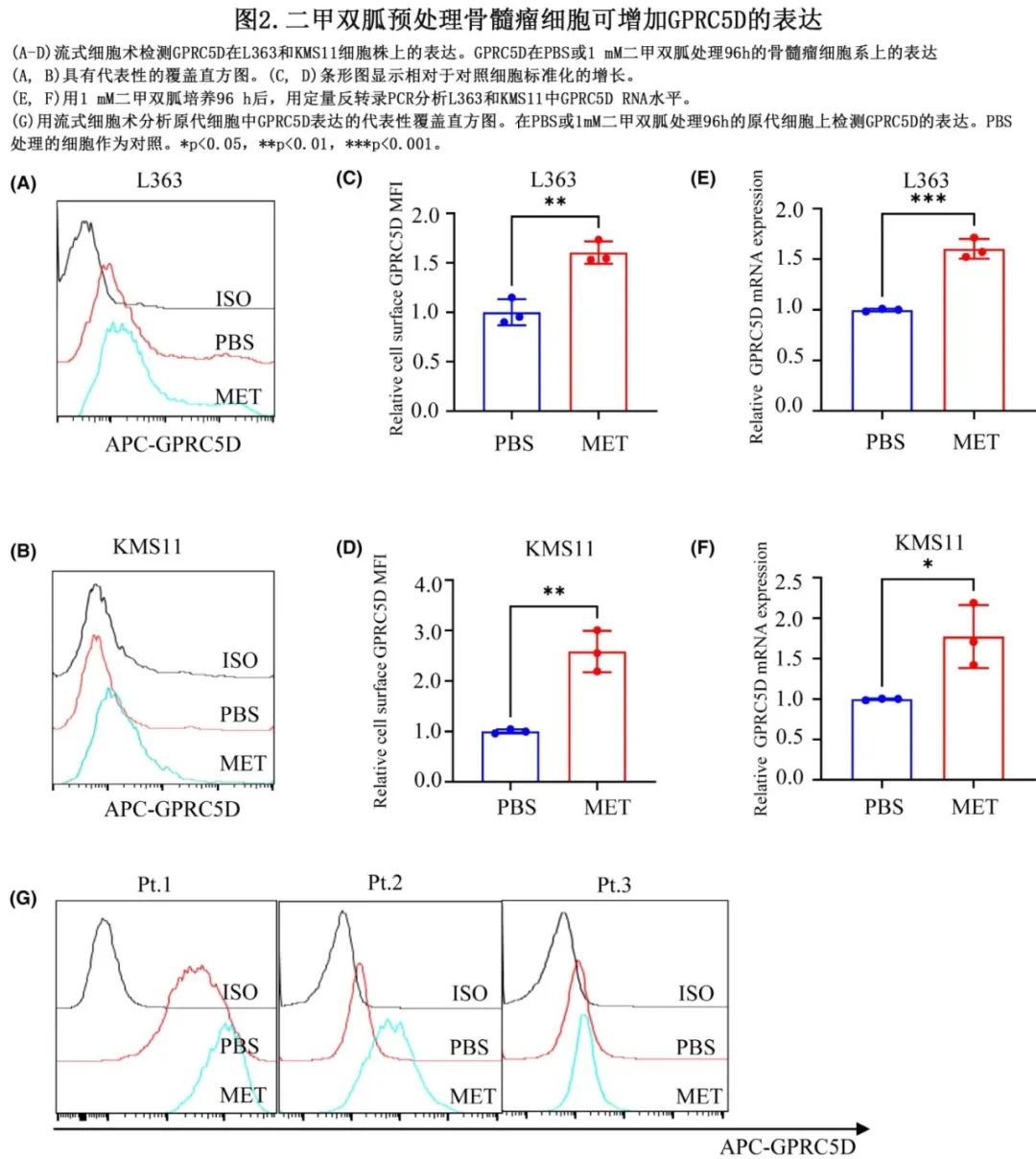
在本研究中,研究团队首先通过各种手段表征了CSMT纳米粒的成功合成,并证实其具有较高的稳定性(图2)。为了探讨CSMT能否顺利在细胞内产生预期效果,研究团队分别从细胞摄取水平,蛋白表达水平以及纳米复合物与溶酶体共定位情况等方面考察了CSMT纳米复合物的胞内行为,结果表明,该纳米复合物显著增加siTREX1的溶酶体逃逸水平,增加其转染效率(图3)。

图2. CSMT纳米粒的合成路线及表征

图3. CSMT纳米复合物的胞内行为研究
为了探究CSMT纳米复合物能否在联合放射治疗时起到促进胞浆DNA累积,激活STING通路的效果,研究团队检测了CSMT联合放射治疗(CSMT + R)处理后细胞增殖与周期的变化,并检测了相关蛋白水平以及胞浆中DNA水平的变化情况,结果表明,CSMT + R能显著抑制肿瘤细胞的增殖,阻断细胞周期至G2/M期,增加细胞DNA损伤,抑制DNA损伤修复蛋白酶RAD51的表达,最终增加胞浆中DNA的累积,激活cGAS-STING通路(图4)。

图4. CSMT纳米复合物的体外抗肿瘤效果分析
此外,研究团队还检测了CSMT + R治疗诱导肿瘤细胞发生免疫原性细胞死亡的情况以及诱导DC细胞成熟的情况。结果表明,CSMT + R能够显著诱导CRT暴露,HMGB1的外排以及ATP的释放,并显著诱导DC的成熟(图5)。

图5. CSMT的抗肿瘤免疫效果研究
接下来,研究团队首先验证了CSMT + R治疗方案具有显著的抗肿瘤效果,对原发肿瘤的肿瘤生长抑制(TGI)值为99.1%,并通过诱导免疫原性细胞死亡(ICD)显著损害远端肿瘤生长(图6)。通过对肿瘤部位蛋白水平及细胞因子分析,发现CSMT + R能显著激活STING通路,释放IFN-β(图7)。

图6. CSMT纳米复合物的体内抗肿瘤效果验证

图7. CSMT + R激活STING通路情况分析
研究团队通过流式细胞术分析肿瘤组织、淋巴以及脾脏部位的免疫细胞分布情况,实验结果表明CSMT + R能最大程度的激活抗肿瘤免疫,诱导DC细胞成熟,促进CD8+T细胞表达增加以及肿瘤相关中性粒细胞(TAN)极化,并刺激肿瘤特异性记忆T细胞生成。值得注意的是,实验结果表明CSMT + R“治愈”后的小鼠能够免受同源肿瘤细胞的再激发(图8)。

图8. CSMT + R治疗小鼠的免疫效果分析
最后,研究团队通过体内抗体中和实验再次验证了CSMT + R联合治疗发挥抗肿瘤作用的机制。结果表明,在CSMT + R治疗通过激活STING通路,诱导抗肿瘤中性粒细胞的极化以及CD8+T细胞活化来发挥抗肿瘤作用(图9)。

图9. CSMT + R治疗的抗肿瘤作用机制探究
湖南中医药研究院喻翠云教授,南华大学魏华教授为该论文的通讯作者,何双燕研究生,黄蕴博士生和刘佳研究生为该论文的共同第一作者。该研究得到了国家自然科学基金项目、湖南省自然科学基金项目、湖南省科技创新领军人才计划项目、湖南省科技重点发展计划项目等项目的支助。
原文链接:

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#二甲双胍# #放射治疗#
11