Adv Sci:双管齐下!王玮/尚靖/李盛亮合作使用近红外响应纳米夹心双重激活减脂,用于有针对性的抗肥胖治疗
2024-10-01 iNature iNature 发表于上海
该研究通过将聚二甲双胍(PolyMet)附着到光热剂黑磷纳米片(BP)上制成抗肥胖纳米三明治。
脂肪过度堆积和慢性炎症是肥胖的两个典型特征。AMP活化蛋白激酶(AMPK)是能量代谢的主要调节剂,参与脂肪组织(AT)中的脂肪生成、脂肪生成和炎症调节。因此,通过AMPK调节有效降低脂质和抗炎在治疗肥胖症中起着至关重要的作用。
2024年9月26日,中国药科大学王玮、尚靖、苏州大学李盛亮共同通讯在Advanced Science 在线发表题为“Two-Pronged Attack: Dual Activation of Fat Reduction Using Near-Infrared-Responsive Nanosandwich for Targeted Anti-Obesity Treatment”的研究论文。该研究通过将聚二甲双胍(PolyMet)附着到光热剂黑磷纳米片(BP)上制成抗肥胖纳米三明治。
PolyMet通过减少巨噬细胞浸润、复极化巨噬细胞表型和下调促炎细胞因子来激活AMPK以抑制脂肪生成、促进褐变并减轻AT炎症。此外,BP通过光热效应诱导脂肪细胞和巨噬细胞的脂肪分解和凋亡。通过使用透明质酸(HA)和MMP2底物连接P3肽修饰的HA(P3-HA)进一步功能化,通过P3和HA的双靶向以及MMP2裂解后HA介导的CD44多聚簇获得增强的抗肥胖效果。经激光照射后,设计的纳米三明治(P3-HA/PM@BP)可有效抑制肥胖小鼠的肥胖发展,增加AT中的M2/M1比率,降低血清胆固醇/甘油三酯水平并改善胰岛素敏感性,表现出良好的研究潜力,以促进现代抗肥胖疗法的临床发展。

肥胖是一种流行的代谢性疾病,其中多余的能量以脂肪的形式储存,并伴有低度慢性炎症,这被视为对公共健康的一大挑战。然而,除了日常饮食优化、运动或手术外,许多目前可用的小分子药物,无论是抑制胃肠道对膳食脂肪的吸收(如奥利司他®),还是抑制中枢神经系统食欲(如利拉鲁肽®),都存在副作用,并且由于脱靶效应和长期使用,减肥效果有限。因此,迫切需要开发安全有效的替代方法来治疗肥胖及其相关疾病。
通过光热疗法(PTT)消融脂肪组织(AT)是去除多余脂肪的直接方法。在一些报道的研究中,金纳米粒子(NPs)和CuS纳米点的光热效应被用于收缩脂肪细胞。与上述光热剂相比,黑磷纳米片(BP)具有优异的光热转换效率,具有良好的生物相容性和生物降解性、由于其褶皱的晶格结构而具有较高的表面积比、易于改性等独特优势,使其具有可靠的生物安全性和令人满意的药物负载能力。同时,BP可以在液相中简单地剥离以获得合适的粒径,使其成为生物医学领域理想的药物递送载体。基于这些优点,以BP为载体的纳米平台在基于光热治疗的抗肥胖方面显示出巨大的潜力。
然而,脂肪组织巨噬细胞内在的慢性炎症可能会削弱整体的肥胖治疗效果。正常脂肪组织巨噬细胞(ATM)占细胞总数的5%,但肥胖脂肪组织巨噬细胞中ATM可升高至50%,这是由于骨髓来源的前体细胞的流入以及随后向表达F4/80的巨噬细胞的分化所致。此外,由于脂肪组织中含有丰富的游离脂肪酸(FFA)、肿瘤坏死因子-α(TNF-α)和脂多糖(LPS),M2样巨噬细胞倾向于复极化为M1样巨噬细胞。M1分泌的促炎因子还能通过上调的基质金属蛋白酶2(MMP2)引发的细胞外基质(ECM)重塑加剧脂肪细胞纤维化和全身代谢紊乱。因此,降脂与抗炎相结合是一种可行的减肥治疗策略。
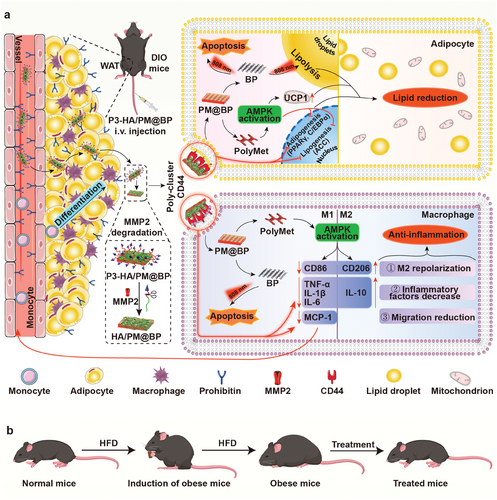
P3-HA/PM@BP纳米夹层治疗肥胖症的示意图(图源自Advanced Science )
二甲双胍(Met)是治疗2型糖尿病(T2D)的一线口服降糖药,其良好的减肥作用已得到广泛证实。Met通过激活AMP活化蛋白激酶(AMPK),下调3T3-L1细胞中过氧化物酶体增殖激活受体γ(PPARγ)和CAAT增强子结合蛋白α(C/EBPα)的表达,从而抑制脂肪生成和脂肪形成。此外,已有研究证明Met可降低肥胖AT中单核细胞趋化蛋白-1(MCP-1)、M1标志物如CD11c以及促炎细胞因子如白细胞介素-6(IL-6)和TNF-α的水平,提示Met通过减少巨噬细胞浸润、M2巨噬细胞复极化和减少炎性因子分泌等机制发挥抗炎作用。
本课题组前期研究通过壳聚糖和双氰胺的加成反应合成了含有大量双胍类基团的聚二甲双胍(PolyMet),本研究希望将PolyMet发挥与Met相同的双重作用,发挥降脂和抗肥胖炎作用。透明质酸(HA)是一种线性糖胺聚糖,通过特异性结合CD44受体参与细胞增殖和转移,已有研究表明HA的分子量和分散状态影响其对细胞的作用,高分子量(HMW)的HA或HA包覆的NPs可以靶向和聚集脂肪细胞或巨噬细胞表面的CD44受体,从而阻断下游信号通路,最终抑制肥胖小鼠的脂肪生成和炎症。此外,短P3肽(CKGGRAKDC)可以特异性地结合在脂肪组织血管和成熟脂肪细胞膜上高度表达的抑制素(PHB),从而增强AT的靶向性。
静电逐层制备多层纳米结构技术由于其通用性和相对简单的步骤引起了研究者的兴趣。利用LbL法制备多层纳米结构涉及几个不同的阶段,包括选择模板和一对带相反电荷的聚电解质,以及两种聚电解质吸附到所选模板上,由于两种聚电解质之间存在静电吸附和其他相互作用而形成多层纳米结构。多层纳米结构的层数由所选材料的本征性质和温度、pH值和离子强度等外部制备条件决定。研究表明,BP能与氧和水反应,在表面形成磷酸根离子,使其具有负电性。PolyMet以酸化壳聚糖为原料,由于氨基的质子化,壳聚糖在水溶液中带有大量正电荷,因此可以通过静电吸附将带正电荷的PolyMet附着在带负电荷的BP上吸附,最终形成带正电的PM@BP纳米复合材料。由于HA和MMP2底物连接P3肽修饰的HA(P3-HA)上有大量羧基,带负电,随后可以通过静电相互作用吸附到带正电的PM@BP上,构建最终的P3-HA/PM@BP纳米三明治。
在此基础上,提出了一种通过制备P3-HA/PM@BP纳米三明治进行减肥的“降脂抗炎”策略。在该纳米三明治中,PolyMet、HA和P3-HA以LbL方式自组装,通过静电相互作用沉积在BP上。静脉注射后,P3-HA/PM@BP纳米夹层在P3和HA的双重引导下靶向肥胖AT中的脂肪细胞和巨噬细胞,随后在MMP2降解后将CD44与暴露的HA多聚簇,以抑制脂肪生成和炎症。同时,PolyMet通过AMPK激活进一步促进了这些对脂肪生成和炎症的抑制作用。激光照射后,BP引发的光热效应诱导细胞凋亡和脂肪分解,导致AT中的脂肪细胞收缩(图1a)。因此,P3-HA/PM@BP纳米夹层加激光治疗改善了整个代谢,包括减轻体重、降低血清脂质谱和增加胰岛素敏感性(图1b)。总之,这项工作中设计的策略为肥胖管理提供了一个新的机会,为精准体重控制提供了合理的研究意义,展现出在预防肥胖相关代谢紊乱方面的潜力。
参考消息:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202406985
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#二甲双胍# #抗肥胖纳米三明治#
96 举报