缺血性卒中(IS)是由于脑血管局部血流减少或血栓形成导致的脑血管暂时性或永久性闭塞。而脑缺血再灌注(I/R)损伤指的是脑缺血后血流恢复时引发的严重脑损伤。脑I/R引发的严重脑损伤与细胞凋亡、坏死、自噬、氧化应激、兴奋毒性以及炎症等机制相关。尽管重组组织纤溶酶原激活剂(rt-PA)的再通治疗被证实有效,但其临床应用因治疗时间窗口有限、颅内出血风险以及神经毒性等副作用而受到限制。因此,开发治疗IS的新药显得尤为迫切。中药在脑卒中的临床治疗中已有数千年的应用历史,具有调节多个靶点、多成分的整体网络等特点,并且毒副作用较小。
黄熊方(HXF),是安徽中医药大学第一附属医院的医院制剂,由大黄、川芎、姜黄和石菖蒲组成,具备理气化痰、促进血液循环及清除毒素的功效。临床上主要用于治疗脑梗死、腔隙性脑梗死以及脑梗死合并糖尿病等疾病。研究显示,HXF能显著改善神经功能缺损、缺血和缺氧状况,进而对大脑起到保护作用。尽管如此,HXF的主要活性成分及其治疗IS的机制仍需进一步研究明确。
日前,一篇名为“Network pharmacology-based prediction and validation of the active ingredients and potential mechanisms of the Huangxiong formula for treating ischemic stroke”的文章探究了HXF治疗IS的有效成分及潜在机制。

图1 论文首页
HXF在治疗脑卒中中的潜在活性成分和靶点
为阐释HXF的作用机制,研究采用网络药理学方法,通过TCMSP数据库及文献检索,依据标准参数(OB≥30%,DL≥0.18)筛选其全部化学成分。从PubChem数据库获取对应的小分子结构,并将这些结构导入瑞士目标预测数据库,设置概率阈值>0。该研究共识别出44种活性成分及795个潜在靶点。利用关键词“缺血性中风”、“脑缺血”和“脑梗死”在基因卡、药物库、OMIM和DisGeNET中检索,最终筛选出2244个与缺血性中风相关的疾病靶点。
图2A揭示,掌舌草、纹状体、香积蒲、石菖蒲的主要活性成分分别对应430、354、357和364个靶点。通过将这些成分的靶点与疾病靶点进行匹配,共筛选出317个交集靶点,作为HXF治疗缺血性中风的潜在靶点(图2B)。此外,研究还构建了一个包含4种中草药、44种活性化合物和317个候选靶点的中草药-化合物-靶点网络(图2C)。该网络由365个节点和1308条边构成,44种活性成分的平均表达度为30.6,体现了HXF的多靶点治疗特性。
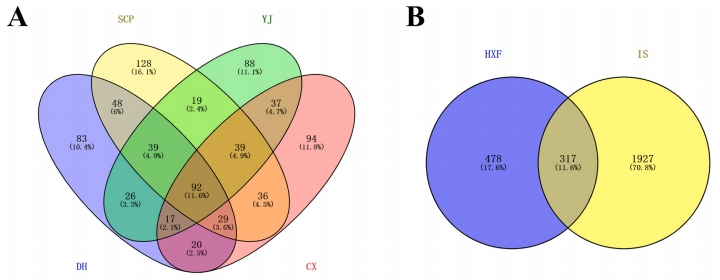
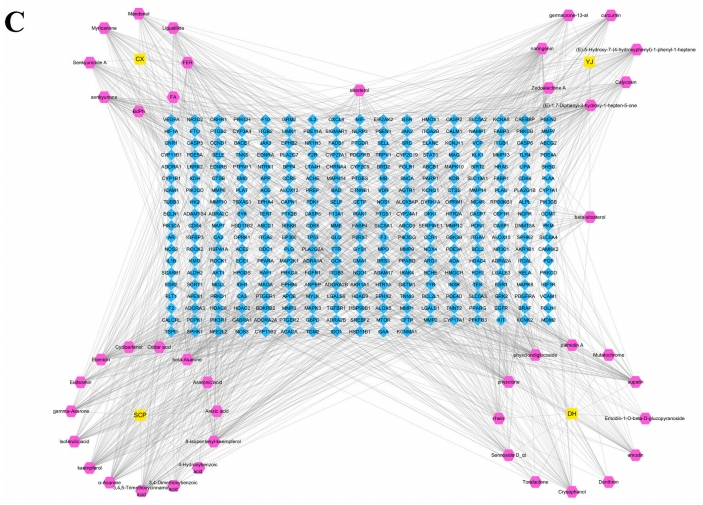
图2 HXF在治疗脑卒中中的潜在活性成分和靶点
HXF方减少了I/R大鼠的神经元损伤
为评估HXF在脑卒中后恢复期的疗效,研究以尼莫地平作为阳性对照药物。尼莫地平属于二氢吡啶类钙通道阻滞剂,具备优异的脂溶性,能够穿透血脑屏障,在脑缺血的临床治疗中已得到广泛应用。假手术组出现大鼠死亡的情况,但术后模型组死亡率达到了42.8%,HXF低剂量组为31.5%,而HXF高剂量组则为21.1%。Longa评分和TTC染色结果如图3A-C所示。与模型组相比,HXF低剂量组和高剂量组的Longa评分均显著降低。与假手术组相比,模型组的脑梗死体积显著增大(P<0.01);尼莫地平组和HXF组的梗死体积相较于模型组均显著缩小(P<0.01)(图3C)。此外,HXF显著降低了反映脑水肿程度的脑指数(图3D)。HE染色和Nissl染色结果显示,模型组的神经元数量减少,细胞染色变暗、起皱,而活血方组的神经元数量增加,细胞质清晰,形态较为完整,显示出明显的改善(图3E、F)。这些结果表明,HXF能够减轻I/R大鼠的神经元损伤。
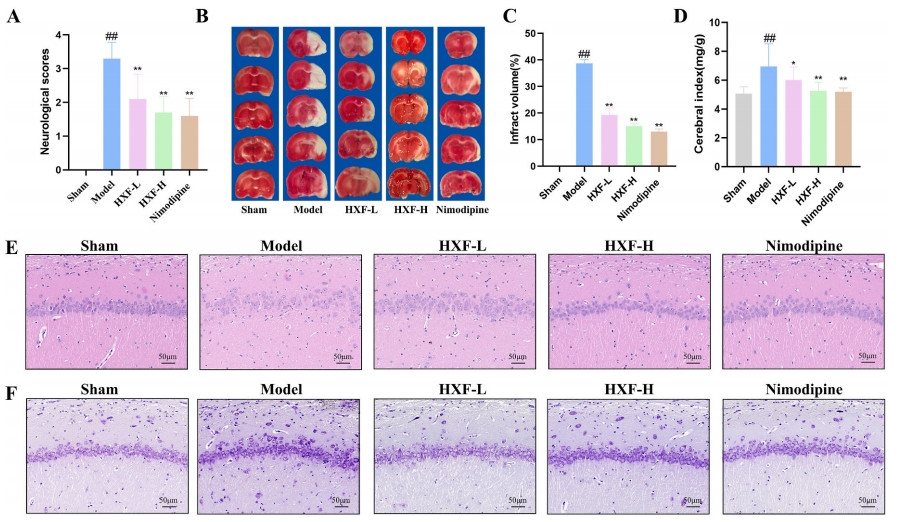
图3 HXF的神经保护作用
α-Asarone对OGD/R所致HT 22细胞损伤的保护作用
通过C-T-P网络和UPLC分析,研究发现α-Asarone可能是HXF的关键成分。首先,研究者通过对细胞活力和LDH释放进行了测定,并采用CCK-8法评估α-Asarone对正常培养的HT22细胞活性的影响,探讨了α-Asarone对HT22细胞OGD/R后的保护作用。结果显示,六种不同浓度的α-Asarone(1、5、10、20、40或100 nM)均未对HT22细胞的活力产生影响,并且对正常HT22细胞无细胞毒性(图4A)。进一步观察了α-Asarone是否对OGD/R后的HT22细胞具有保护作用,通过细胞活力和LDH释放进行评估。
结果表明,OGD/R组细胞存活率显著低于正常组(P<0.01)。与OGD/R组相比,α-Asarone浓度组(5、10、20 nmol/L)显示出显著提高的细胞存活率(P<0.05,P<0.01)(图4B)。α-Asarone给药组和尼莫地平给药组的LDH释放量低于OGD/R组(P<0.01)(图4C)。此外,OGD/R损伤导致细胞收缩,但在α-Asarone干预后,细胞形态得以恢复正常(图4D)。综上所述,α-Asarone能够减轻OGD/R诱导的细胞损伤。
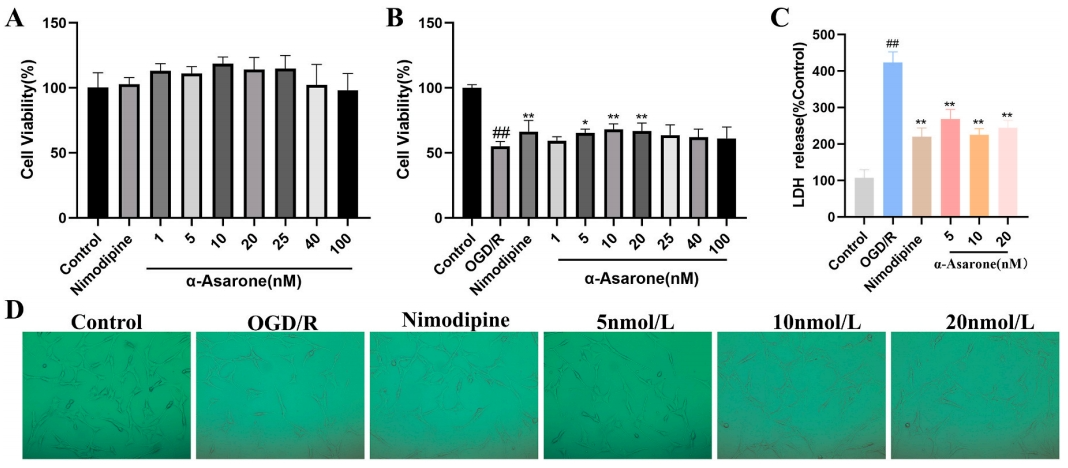
图4 α-Asarone治疗对OGD/R诱导的HT22细胞损伤的影响
α-Asarone抑制OGD/R诱导的细胞凋亡
同时,为深入研究α-Asarone对OGD/R所致HT 22细胞损伤的保护效应,研究对细胞凋亡现象进行了检测。相较于对照组,OGD/R组的绿色荧光强度显著上升,而α-Asarone的加入则有效降低了该荧光强度(图5A)。在对照组、OGD/R组、尼莫地平组、α-Asarone(5nmol/L)组、α-Asarone(10nmol/L)组以及α-Asarone(20nmol/L)组中,细胞平均清除率分别为9.9%±0.39%、42.6%±2.54%、14.6%±0.74%、21.4%±2.60%、15.1%±1.35%和17.6%±1.14%(图5B、图5C)。通过RT-qPCR技术检测Bax和Bcl-2 mRNA的表达水平,结果显示,与OGD/R组相比,α-Asarone和尼莫地平组的Bax mRNA表达水平明显下降,而Bcl-2 mRNA表达水平则显著上升(P<0.01)(图5D、E)。这些研究结果揭示了α-Asarone能够减轻由OGD/R引起的细胞凋亡。
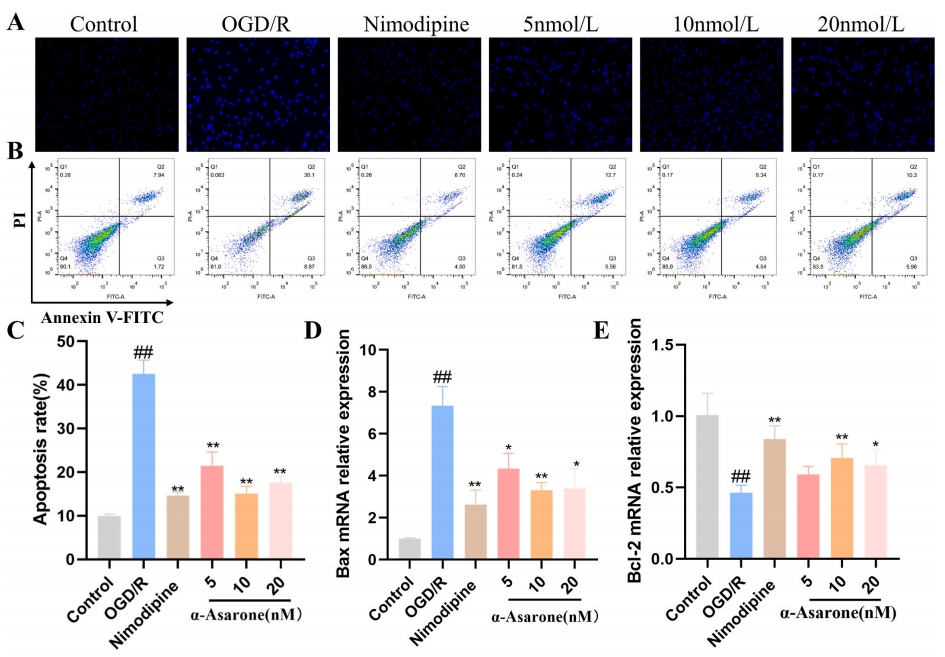
图5 α-Asarone对OGD/R诱导的HT22细胞凋亡的影响
PI3K/AKT通路参与α-Asarone对OGD/R诱导的神经元损伤的保护作用
在HT22细胞中检测PI3K、p-PI3K、AKT、p-AKT、Bax、Bcl-2以及裂解的caspase-9的表达情况,旨在确认α-Asarone是否通过调节PI3K/AKT通路对OGD/R损伤产生改善效果。相较于OGD/R组,α-Asarone与尼莫地平组的p-PI 3 K、p-AKT、Bcl-2蛋白表达水平显著提升(P<0.01),而Bax、裂解型caspase-9蛋白表达水平则显著下降(图6)。因此,α-Asarone能够通过PI3 K/AKT信号通路减轻HT22细胞中的OGD/R损伤。
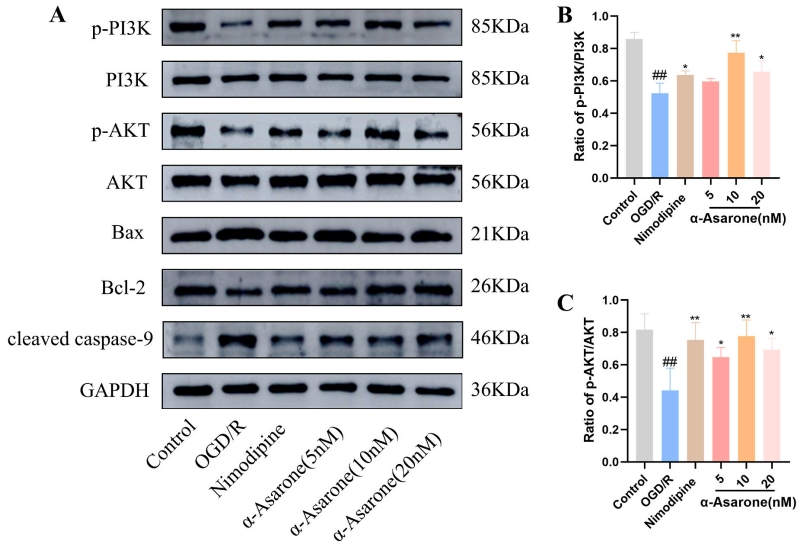
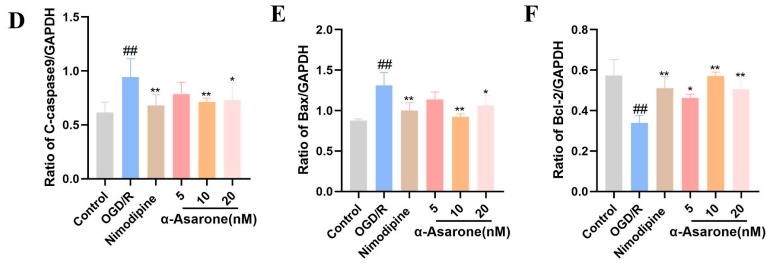
图6 α-Asarone对PI3K/AKT通路蛋白表达的影响
结论
总之,研究将网络药理学预测、分子对接、DARTS技术以及CETSA方法与体外和体内实验相结合。通过体外实验,验证了HXF的作用机制及其主要生物活性成分在治疗IS中的应用,这些发现为HXF的临床应用提供了科学依据。
参考文献:
Zhao S, Zhang P, Yan Y, Xu W, Li J, Wang L, Wang N, Huang Y. Network pharmacology-based prediction and validation of the active ingredients and potential mechanisms of the Huangxiong formula for treating ischemic stroke. J Ethnopharmacol. 2023 Aug 10;312:116507. doi: 10.1016/j.jep.2023.116507

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#缺血性卒中# #黄熊方#
7