【衡道丨病例】病理诊断——原发眼睑产粘液的内分泌汗腺癌1例
2025-03-22 衡道病理 衡道病理 发表于陕西省
今天由徐州市第一人民医院病理科刘霞医生为大家带来一例原发眼睑产粘液的内分泌汗腺癌的病例分享。
临床资料
患者,男,62岁,2年前右眼下睑处无明显诱因长出一肿块,渐大(图1),故来我院眼科就诊。
完善相关检查如下:双眼视力均1.2,眼压、眼底等均无异常,全身淋巴结无肿大,相关系列检查均无异常。遂行门诊手术切除肿块。
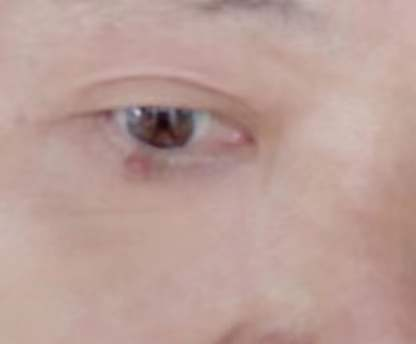
图1 右眼下睑处无明显诱因长出一肿块,大小0.8x0.7x0.5cm,突出皮肤表面,光滑无破溃
大体检查
皮肤及皮下组织1块,大小0.8x0.7x0.5cm,表面光滑,切面质地中。
镜下所示
镜下组织特征如下:
肿瘤实体为边界清楚的膨胀性结节状,伴有囊性、实性、乳头状、筛孔状结构,乳头结构具有纤维血管轴心;肿瘤细胞小到中等大,多边形至圆形的导管细胞,胞浆嗜双色性或呈蓝灰色。核染色质细腻呈细小斑点状、核圆形或卵圆形,核仁不明显,核分裂活性低,可见细胞内粘液和细胞外粘液(图2-4)。

图2 肿块为边界清楚的膨胀性结节状,伴有囊性变,间质可见粘液(HEX100)
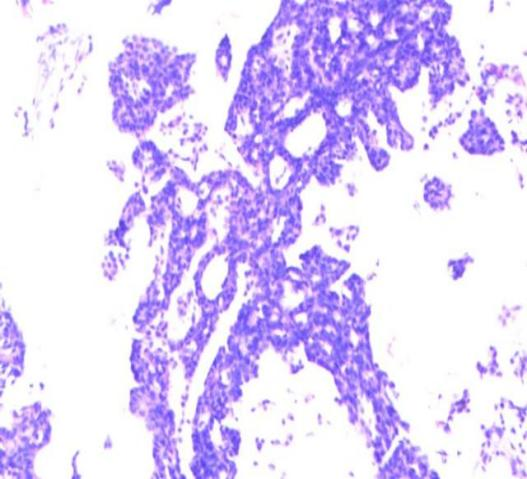
图3 肿块呈乳头状结构,乳头结构具有纤维血管轴心(HEX100)
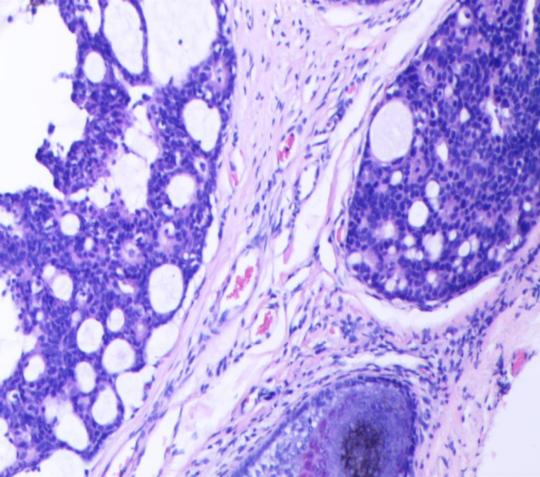
图4 肿块呈筛孔状结构,肿瘤细胞小到中等大,多边形至圆形的导管细胞(HEX100)
免疫组化:
免疫组化强阳性表达有:CAM5.2、GCDFP-15(图5)、CK7,ER(图6)和PR(图7),Syn(图8)、CgA部分表达;呈局灶性阳性的有:MA、p63、CD56;而CEA和CK20(图9)则为完全阴性;Ki-67增殖指数(+5-10%)(图10)。
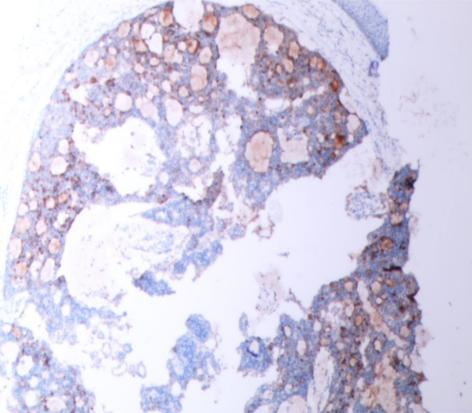
图5 GCDFP-15(+)(SPX100)
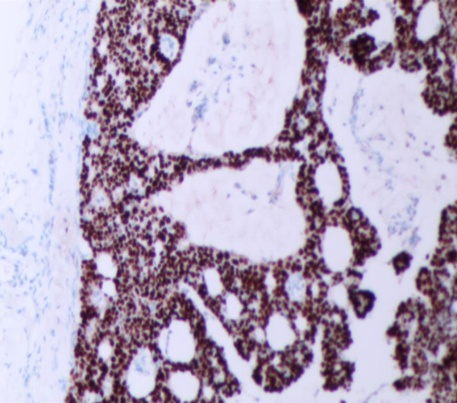
图6 ER(强+,80%)(SPX100)
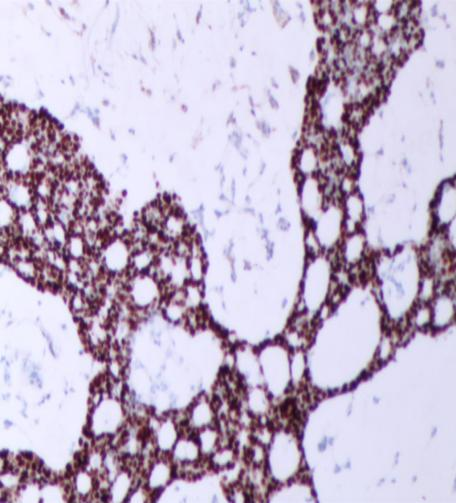
图7 PR(强+,80%)(SPX100)
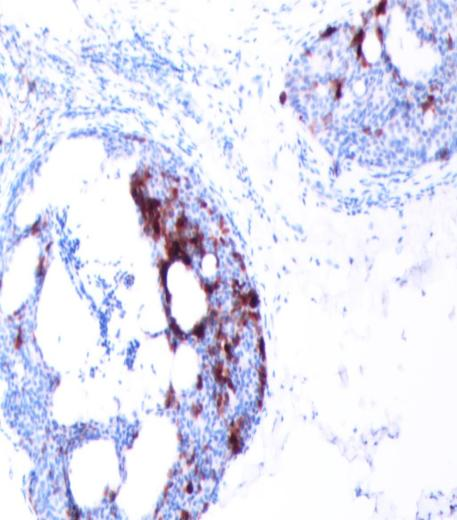
图8 Syn(+)(SPX100)
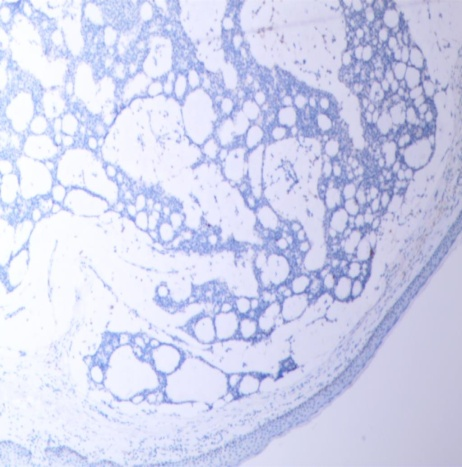
图9 CK20(-)(SPX100)
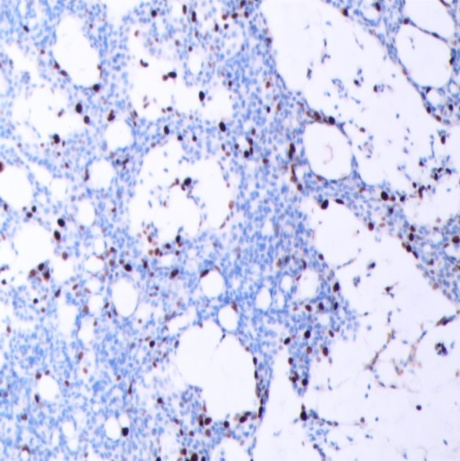
图10 Ki-67增殖指数(+5-10%)(SPX100)
特殊染色:
阿新蓝、PAS 组织化学染色显示胞浆内粘蛋白和胞外粘蛋白沉积(图11-12)。

图11阿新蓝染色示细胞外粘蛋白 (特染X100)
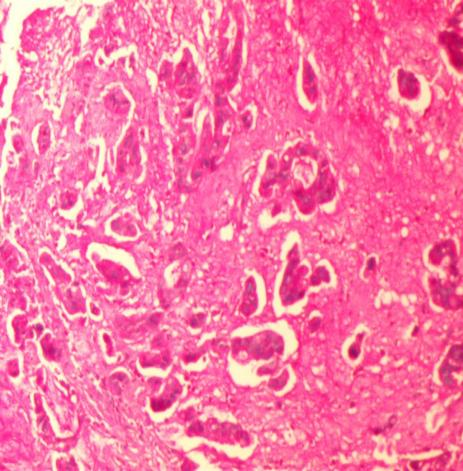
图12 PAS染色示细胞内粘蛋白(特染X100)
最终诊断
常规病理报告:
(右眼下睑)少见肿瘤,有粘液分泌,汗腺来源可能,低级别肿瘤,考虑为产粘液的内分泌汗腺癌,部分区域向粘液癌分化,部分切缘(+),建议务必行免疫组化进一步明确诊断;
结合免疫组化病理报告:
(右眼下睑)产粘液的内分泌汗腺癌(EMPSGC)。
讨论
产粘液内分泌汗腺癌(EMPSGC)是一种少见的皮肤附属器肿瘤,也是一种低级别神经内分泌肿瘤,具有低级别的细胞学特征和神经内分泌分化,形态类似乳腺实性乳头状腺癌的皮肤肿瘤。好发部位在眼睑及眼部周围皮肤,但也有报告发生在面部或额外皮肤的位置。在一些病例中,此类肿瘤被认为是粘液癌的前驱病变。
临床特征:
EMPSGC是好发50-60岁老年女性的少见肿瘤,多发生在眼睑和眼周皮肤,但也有其它部位的报道。根据组织发生,汗腺肿瘤主要显示大汗腺或小汗腺分化,EMPSGC在最新的皮肤肿瘤WHO分类中被定义为一种低级别神经内分泌肿瘤,是发生于皮肤的类似于乳腺实体性乳头状癌的肿瘤[1-3]。自1997年Flieder等人首次描述以来,文献报道的病例不足200例[4-5]。免疫组化和超微结构分析证实与乳腺相同的肿瘤具有相似的表型[6]。此类肿瘤呈缓慢生长,外观皮肤色多数呈蓝灰色丘疹样,也可呈囊性外观。
镜下特征:
肿瘤表现为边界清楚的膨胀性结节,常有囊性、实性、乳头状、筛孔状结构,伴有神经内分泌分化和粘蛋白产生;乳头结构具有纤维血管轴心;肿瘤细胞小到中等大,多边形至圆形的导管细胞,胞浆嗜双色性或呈蓝灰色。核染色质细腻呈细小斑点状、核圆形或卵圆形,核仁不明显。一部分细胞内和细胞外粘液可用粘液卡红染色染出。核分裂活性低,Ki-67增殖指数<10%。无肿瘤性坏死。很多病例中原位癌位于具有良性导管上皮的扩张的小汗腺导管内,同时伴有肌上皮。大的膨胀性结节通常缺少肌上皮细胞层,此特点和伴有推挤性浸润的癌组织结构一致。大量的细胞外间质粘液池和/或浸润性肿瘤腺体或巢团的出现预示产内分泌粘蛋白的汗腺癌进展为粘液腺癌的概率提高。
免疫组化特征:
免疫组化强阳性染色有CAM5.2、GCDFP-15、CK7,突触素、嗜铬颗粒蛋白、NSE、CD57。雌激素和孕激素核染色阳性率为90-100%。EMA和p63、CD56呈局灶性阳性。Ki-67增殖指数<5-10%。CEA和CK20均为完全阴性。PAS、阿新蓝组织化学染色显示胞浆内粘蛋白和胞外粘蛋白沉积。
分子遗传学特征:
暂无特殊基因改变。
治疗和预后
EMPSGC预后好,完整切除即可,但切缘不净,产生粘液量过多(超过肿瘤范围50%的粘液)则是复发风险因素,但在迄今为止报道的190例EMPSGC中,也仅有1例局部转移[9]。本例EMPSGCE患者手术完整切除,现每3个月电话进行随访,患者至今预后良好。可见只有熟悉EMPSGC组织学特点,做出准确的病理诊断,方能对患者临床治疗方式的选择、预后风险评估以正确的指导。
鉴别诊断
(1)腺样囊性癌:
此肿瘤呈筛状、腺管状生长,由形态大小不一的“细胞岛”组成,内可见导管结构,其特征是由一层立方细胞和外围的肌上皮细胞组成,超微结构显示管腔内有微绒毛,有时筛状结构中可见大小不一微囊,囊内充满嗜碱性黏液样物质,肿瘤细胞比较均匀一致,有轻度异型,间质通常可见玻璃样变性,也可伴有黏液样变性并常常侵犯神经周围。典型的腺样囊性癌一般与表皮不相连,经典的筛孔样结构可作为与EMPSGC相鉴别的重要依据,而当出现囊内富含黏液样变性的腺样囊性癌时,仔细寻找肿瘤交界区浸润的方式和有无神经的侵犯可帮助与EMPSGC鉴别。必要时借助免疫组化,腺样性癌囊常表达EMA、S-100、CD117,周围肌上皮细胞表达p63等,MYB异位是特征性的分子表型[7]。
(2)汗腺腺癌:
汗腺癌可分为小汗腺癌、大汗腺癌及一些特殊类型,鉴别要点是小汗腺癌腺腔窄,被覆一层扁平或立方形细胞,大汗腺癌腺腔较宽,瘤细胞大,胞浆强嗜酸性,大汗腺癌系发生于大汗腺处[8]。汗腺腺癌多呈囊性结节状生长,细胞成分多样,有透明细胞样、鳞状细胞样、肌上皮样等,也可见上皮细胞内小泡,细胞异型大,核分裂多见。汗腺癌的免疫组化也常表达GCDFP-15、ER、PR,而汗腺癌少有粘液分泌,少有神经内分泌分化可作为与EMPSGC的鉴别点。
(3)汗孔癌:
此肿瘤可呈原位癌或浸润性癌两种改变,原位汗孔癌病变局限在表皮,表现为典型汗孔瘤的模式,少见EMPSGC囊性、实性、乳头状、筛孔状肿瘤细胞结构,原位汗孔癌细胞呈蜂窝样排列,核呈多形性、核深染、有非典型核分裂像。汗孔癌组织形态多为溃疡结节,少见色素沉着,浸润性生长的汗孔癌,低倍镜下可见肿瘤局灶与表皮相延续向真皮深部呈浸润性生长,肿瘤从表皮下一直延伸到真皮深部,肿瘤的巢团中央可见片状的坏死及钙化,肿瘤细胞巢团所在的间质呈促纤维增生性间质,组织形态学上即可诊断为恶性,相较而言其生长方式就没EMPSG友善,肿瘤细胞形态也比EMPSGC异型,具体表现核深染,局灶核仁明显,核分裂象较多。
(4)基底细胞癌:
基底细胞癌镜下呈结节状,常显示肿瘤细胞巢周边程度不一的栅栏状结构,而中心部细胞排列杂乱,肿瘤细胞胞质稀少、淡染或稍嗜酸性,细胞核具不典型、核分裂多见,核膜较厚;肿瘤内黏液可形成较大的湖状或囊腔,其间质为特征性的炎性黏液样,由比例不一的黏液、淋巴细胞、大量纤维母细胞、胶原等成分,这种间质特点可与EMPSG单一的黏液间质相鉴别;其二基底细胞癌的肿瘤巢团与周围间质之间可形成特征性的裂隙,这一特点可广泛分布或仅局灶出现,也会帮助与EMPSG区别。
(5)皮肤的粘液腺癌:
此肿瘤也好发眼睑皮肤,位于真皮及皮下,镜下显著特征是粘蛋白湖中漂浮着肿瘤细胞岛;肿瘤细胞呈团块实性分布,小的基底样细胞增生组成小巢或腺样结构,其内可见导管和微小囊状结构,多有腺样分化,出现筛孔状是其特点;肿瘤细胞呈多角形基底样,偶可见印戒细胞样,细胞有轻度异型,核分裂相少见,间质可见显著的粘液,彼此相互融合形成粘液湖,因产内分泌粘蛋白被认为是粘液癌的前驱病变,同属一谱系,故当核分裂多,细胞异型大时可以归为粘液腺癌。
(6)小汗腺螺旋腺瘤:
此肿瘤属于良性皮肤附属器肿瘤,呈基底细胞样结节状生长,可伴小汗腺或大汗腺分化,瘤体位于真皮深层,由多个或单个小叶组成,与表皮不相连,小叶周边细胞体积小,呈基底细胞样,胞浆少,细胞核圆形、深染;而小叶中央细胞体积大,细胞核淡染,苍白,胞浆嗜酸性;有时细胞巢可见局灶或弥漫小汗腺导管结构,腔内含嗜酸性耐淀粉酶物质,PAS染色阳性;细胞巢内有时可见局灶或弥漫小,偶尔可伴局灶毛母细胞瘤成分或皮肤淋巴腺成分。免疫组化显示肿瘤细胞CK7、CK8/18、CK5/6及p63阳性;导管CEA及EMA阳性;部分显示SMA、calponin及S100阳性(伴肌上皮分化)。
(7)汗腺瘤:
此肿瘤界限清楚,多发生在真皮浅层,可与表皮相连,较大体积者可深达皮下组织,肿瘤由2种细胞构成,一致的嗜酸细胞和胞质透明富含糖原胞质透明的细胞,部分区域伴鳞状分化甚至可见角化珠形成。瘤体中有汗腺小管结构,可见扩张呈囊性的区域,囊内充满粉染无结构物,管腔或囊内衬立方导管细胞或柱状分泌细胞,核分裂少见。间质纤维化,由纤维血管组成或透明变性的胶原组成,可以粉染逐渐透明,也可以有腺管样结构,周边围绕硬化的胶原/基底膜样物质,腺管内细胞可以有粘液化生。免疫组化腔面细胞呈EMA、CEA、HMFG-1及GCDFP-15阳性,肌上皮细胞呈S100及SMA阳性。
参考文献:
[1]Nakamura M, Sakurai M, Ozawa H, Morita A. Four male cases of endocrine mucin-producing sweat gland carcinoma: specific gender differences in East Asia. Kaohsiung J Med Sci. 2020; 36(6): 467- 468.
[2]Agni M, Raven ML, Bowen RC, et al. An update on endocrine mucin-producing sweat gland carcinoma: clinicopathologic study of 63 cases and comparative analysis. Am J Surg Pathol. 2020,44(10): 1005- 1016.
[3]Froehlich M, Cook J, Bruner E, Stalcup S, Patel K, Day T. Endocrine mucin-producing sweat gland carcinoma of the eyelid with locoregional metastasis to the parotid gland. Dermatologic Surg. 2020; 46(8): 1116- 1118.
[4]Cornejo KM, Hutchinson L, Meng X, OʼDonnell P, Deng A. Endocrine mucin-producing sweat gland carcinoma of the eyelid: a report of a case with molecular analysis. Am J Dermatopathol. 2016; 38(8): 636- 638.
[5]Kawasaki T, Kubota T, Ichihara S, Horibe K, Hasebe T. Neuroendocrine cells associated with endocrine mucin-producing sweat gland carcinoma: a potential precursor lesion? Pathology. 2018; 50(5): 573- 575
[6]Nasser H, Siddiqui S. Endocrine Mucin-producing sweat gland carcinoma: two new eyelid cases and review of the literature. Int J Surg Pathol. 2020; 28(6): 653.
[7]周波, 林婷婷, 刘勋,等. 泪腺腺样囊性癌高级别转化临床预后分析[J]. 中华实验眼科杂志, 2018, 36(6):7.
[8]高文俊, 刘敏, 韩丹. 右腋窝大汗腺癌1例[J]. 中国临床案例成果数据库, 2022, 04(01):E02397-E02397.
[9]Shah S,Parekh P, Rodriguez M. Endocrine mucin-producing sweat gland carcinoma in an elderly man. Am J Dermatopathol. 2020; 42(2): 153- 1550.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#病理诊断# #产粘液内分泌汗腺癌#
6