南方医科大区彩文团队Biomaterials:生物逻辑门控的纳米特洛伊木马通过STING-铁死亡选择性激活用于三阴性乳腺癌治疗
2024-11-01 BioMed科技 BioMed科技 发表于上海
针对三阴性乳腺癌治疗难题,南方医科大学团队开发生物逻辑门控特洛伊木马策略,结合铁死亡与激活 STING 通路,精准打击肿瘤细胞并激活免疫,在小鼠模型中展现良好效果,具广阔应用前景。
三阴性乳腺癌(TNBC)是乳腺癌中最具侵袭性的类型之一。由于其缺乏雌激素受体、孕激素受体和HER2蛋白,使得传统的内分泌疗法和靶向疗法难以有效发挥作用,治疗手段较为有限,且TNBC具有极高的复发和转移风险。基于这一现状,科学家们一直在探索更具针对性和有效性的治疗方法,铁死亡疗法和通过小分子药物激活的干扰素刺激基因(STING)通路在此背景下崭露头角,成为癌症免疫治疗中的前沿策略。这两种疗法的结合在抵抗性强的癌症中,尤其是TNBC中,展现出显著的潜力。然而,铁死亡过程中脂质过氧化物(LPO)的过度积累及化疗药物对肿瘤细胞DNA的损伤,往往会导致机体的免疫抑制,进而增加肿瘤复发和转移的风险,这成为当前治疗方案的一大瓶颈。
在这一背景下,南方医科大学第十附属医院的区彩文教授团队针对TNBC的特殊性,开发出了一种创新的“生物逻辑门控特洛伊木马策略,在个性化TNBC治疗中取得了重要进展。这一策略通过智能调控,实现了在肿瘤微环境下的靶向药物释放,并有效避免了传统疗法带来的免疫抑制问题,为TNBC精准治疗提供了全新思路,填补了该领域的空白。
创新的生物逻辑门控特洛伊木马策略
“生物逻辑门控特洛伊木马策略”是一种智能化的治疗调控方式,其核心是利用生物逻辑门控机制,在肿瘤细胞和免疫细胞的特定微环境下选择性地激活药物。这一策略通过控制治疗的时机和地点,实现对TNBC的精准打击和免疫激活,同时避免正常细胞受到不必要的伤害。

逻辑门控机制是一种基于生物学标志物的智能触发系统,可以确保治疗过程中的精准性和选择性。其作用方式类似于计算机中的逻辑门,通过多个条件共同作用决定药物是否释放。具体到本研究中,铁死亡的触发要求满足肿瘤细胞内的高GSH浓度,而STING通路的激活则依赖于抗原呈递细胞中的DNA片段结合,从而保证两者仅在目标细胞中发生,避免了对其他细胞的干扰。
该策略利用了具有逻辑门控功能的纳米载Fe0@HMON@DNA-Exo,由零价铁(Fe0)、中空介孔有机硅(HMON)和DNA片段修饰的4T1细胞外泌体(DNA-Exo)构成。纳米载体中的零价铁能够在高谷胱甘肽(GSH)且弱酸性(pH 6.8)的肿瘤微环境条件下释放铁离子,并触发铁死亡,即“与” (AND)门;而DNA-Exo在巨噬细胞或树突状细胞中激活STING通路, 即或(OR)门。通过这一“逻辑门控”机制,该纳米载体可以根据不同的环境条件有选择性地激活铁死亡或STING通路。
在肿瘤治疗过程中,Fe0@HMON@DNA-Exo在高GSH浓度的条件下释放铁离子和过氧化强,通过Fenton反应生成ROS,引发铁死亡。这一过程会造成肿瘤细胞的脂质过氧化,破坏细胞膜,最终导致细胞凋亡。这种精确的触发机制避免了铁死亡对免疫细胞的影响,使铁死亡的作用仅限于肿瘤细胞。同时,Fe0@HMON@DNA-Exo在抗原呈递细胞中能够识别并激活STING通路。STING信号通路是人体先天免疫系统的重要组成部分,通过激活STING可以引发一系列免疫反应,包括释放干扰素和促进T细胞活化,从而增强机体的免疫记忆能力,提高对肿瘤细胞的识别和清除效果(图1和2)。
生物逻辑门控策略的优势与创新
传统TNBC治疗的主要挑战在于该类肿瘤缺乏特异性生物标志物,导致疗效有限且副作用较大。区彩文团队的生物逻辑门控特洛伊木马策略则提供了一个解决方案。其创新之处在于,通过逻辑门控机制,该策略能够根据肿瘤和免疫细胞的特定微环境精准激活不同治疗机制,克服了以往治疗过程中免疫抑制带来的副作用。
具体来说,该策略通过在肿瘤细胞内触发铁死亡并在免疫细胞中激活STING通路,实现了双重效果:一方面直接摧毁肿瘤细胞,另一方面激活免疫系统,形成一种“纳米疫苗”效果。这种双管齐下的方法不仅缩小了肿瘤体积,还增强了免疫系统对肿瘤的记忆效应,从而有效降低了TNBC的复发和转移风险。
实验结果与前景展望
在小鼠TNBC模型中的实验结果显示,该策略成功逆转了肿瘤的免疫抑制状态,使免疫系统能够更有效地识别和攻击癌细胞。通过这种选择性杀伤机制,研究团队不仅显著缩小了肿瘤体积,还有效抑制了转移的发生,治疗效果大幅提升。与单一的铁死亡或STING激活疗法相比,生物逻辑门控特洛伊木马策略展现出更强的抗肿瘤能力和更低的副作用,极大地提高了小鼠模型中的生存率,显现出强大的抗肿瘤潜力 (图3和4)。
这一创新策略展示出广泛的应用前景,尤其是在TNBC等难治性癌症的个性化治疗中具有较高的潜力。除了TNBC,该策略也有望应用于其他类型的恶性肿瘤中,利用逻辑门控机制调控不同的信号通路,进一步提升治疗效果。未来的研究可继续优化这一纳米载体系统,进一步提高其在人体中的稳定性和安全性,并探索其在其他肿瘤类型中的应用可行性。
此外,该策略还启示了逻辑门控技术在纳米医学中的潜力,即通过动态响应不同的微环境条件实现精准治疗。基于这一思路,未来的纳米医学研究可能会进一步发展更加复杂的逻辑门控系统,以实现更精准、智能的个性化癌症治疗方案。
结语
南方医科大学第十附属医院区彩文团队的“生物逻辑门控特洛伊木马策略”为TNBC等难治性癌症的治疗提供了一种全新的个性化、精准化治疗思路。通过智能逻辑门控机制,该策略有效结合了铁死亡和STING通路的优势,不仅克服了传统疗法的局限性,还为未来的癌症治疗提供了更具前瞻性的思路。随着纳米医学和逻辑门控技术的进一步发展,这一创新策略有望在临床应用中发挥更大的作用,为癌症患者带来更加精准和高效的治疗体验。
本研究第一作者为南方医科大学第十附属医院博士后郭帅,共同第一作者为博士后关天旺和硕士生柯毓珅,通讯作者为区彩文教授,共同通讯作者为博士后邓少辉。
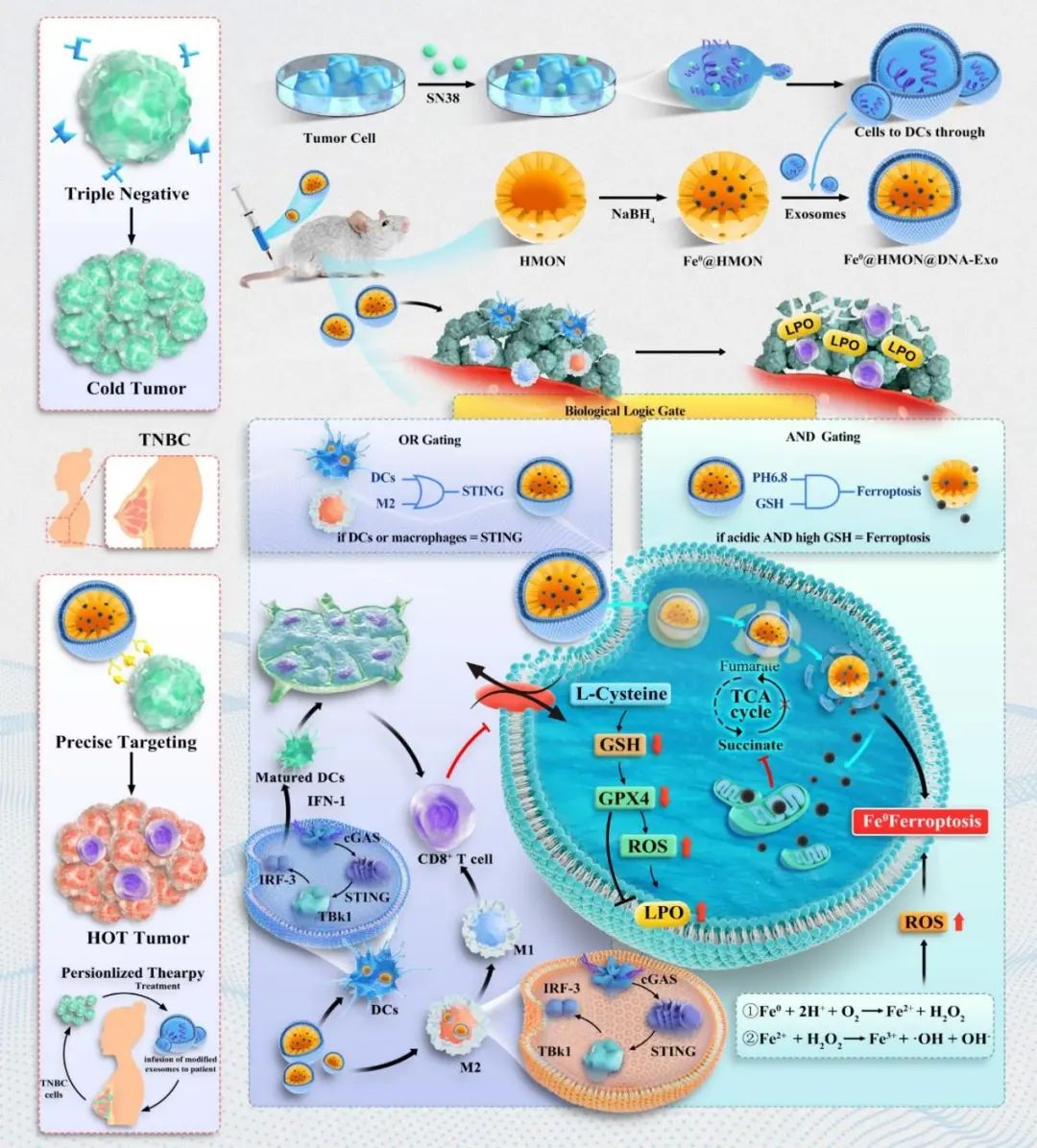
图1:生物逻辑门控的纳米特洛伊木马通过STING-铁死亡选择性激活用于三阴性乳腺癌治疗。
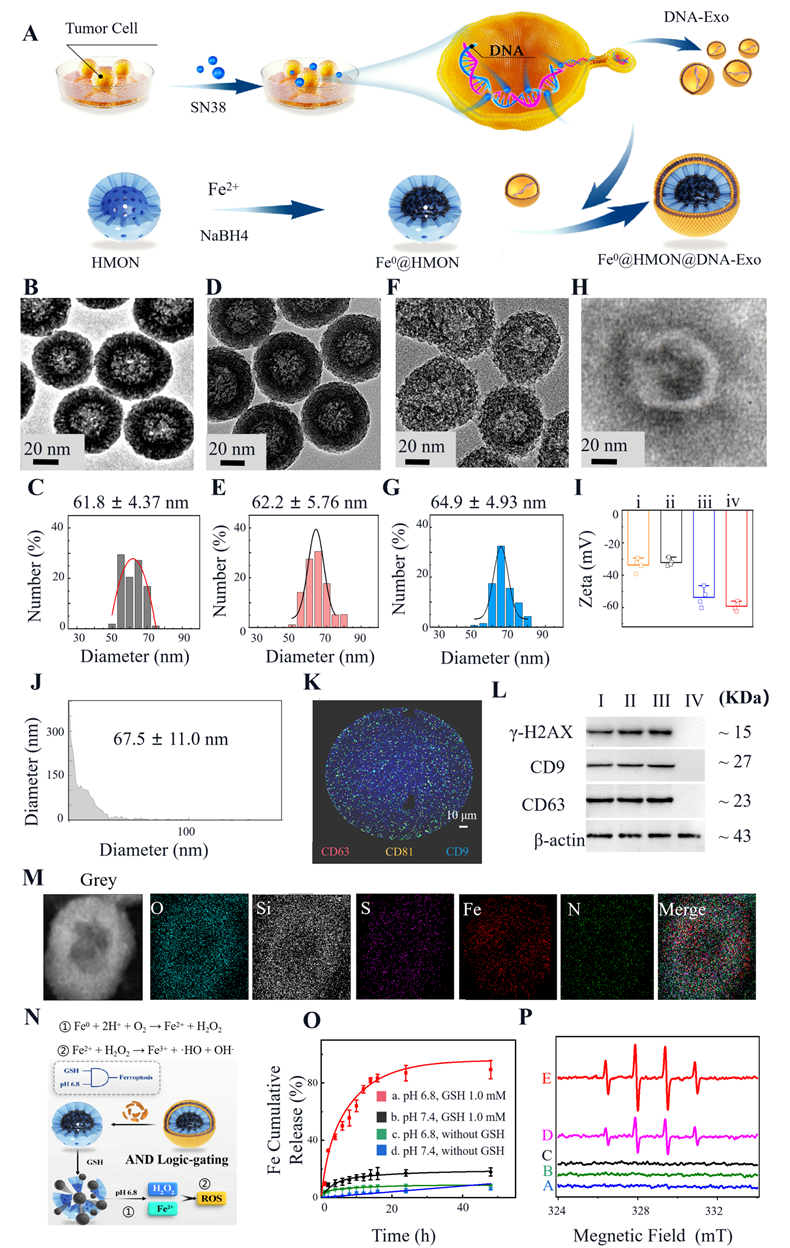
图2:Fe0@HMON@DNA-Exo纳米体系合成和表征
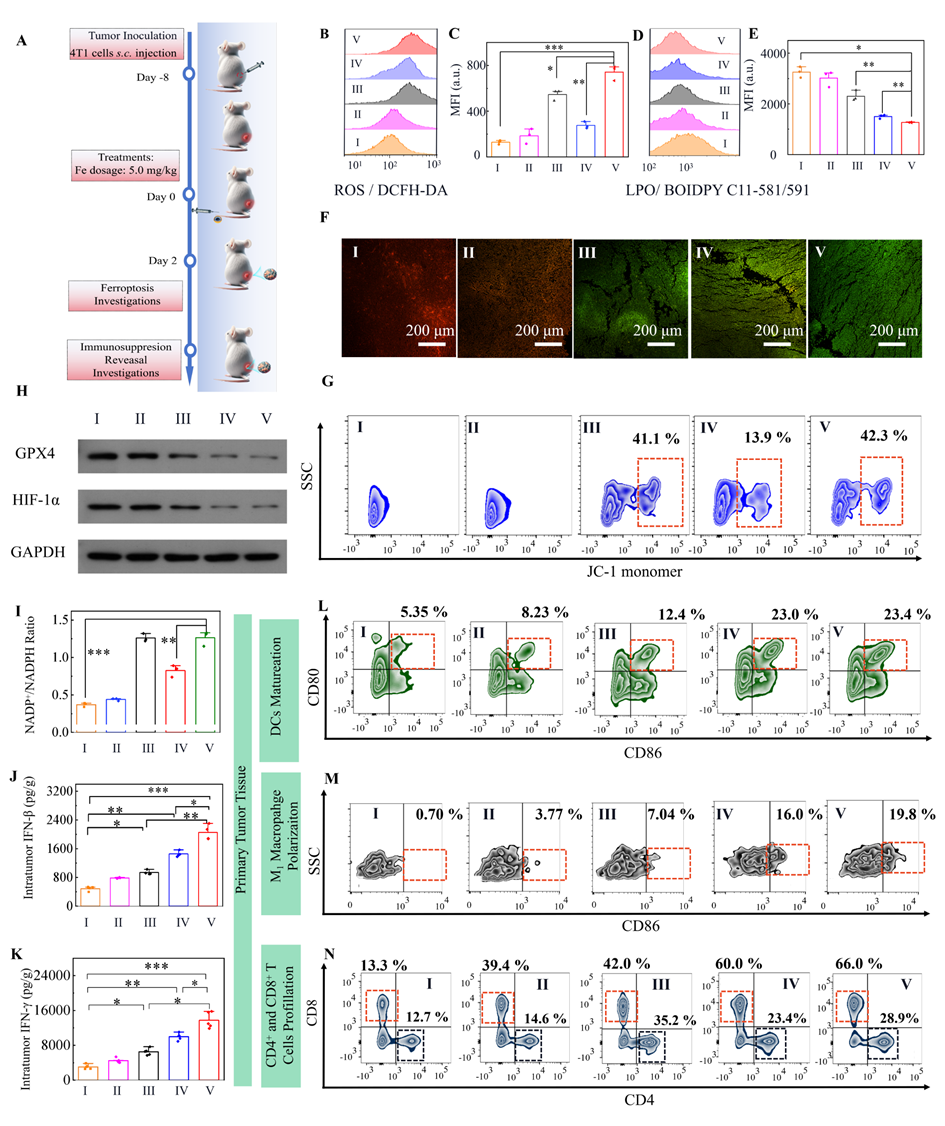
图3:Fe0@HMON@DNA-Exo纳米体系通过选择性激活铁死亡和STING抑制TNBC及其转移。
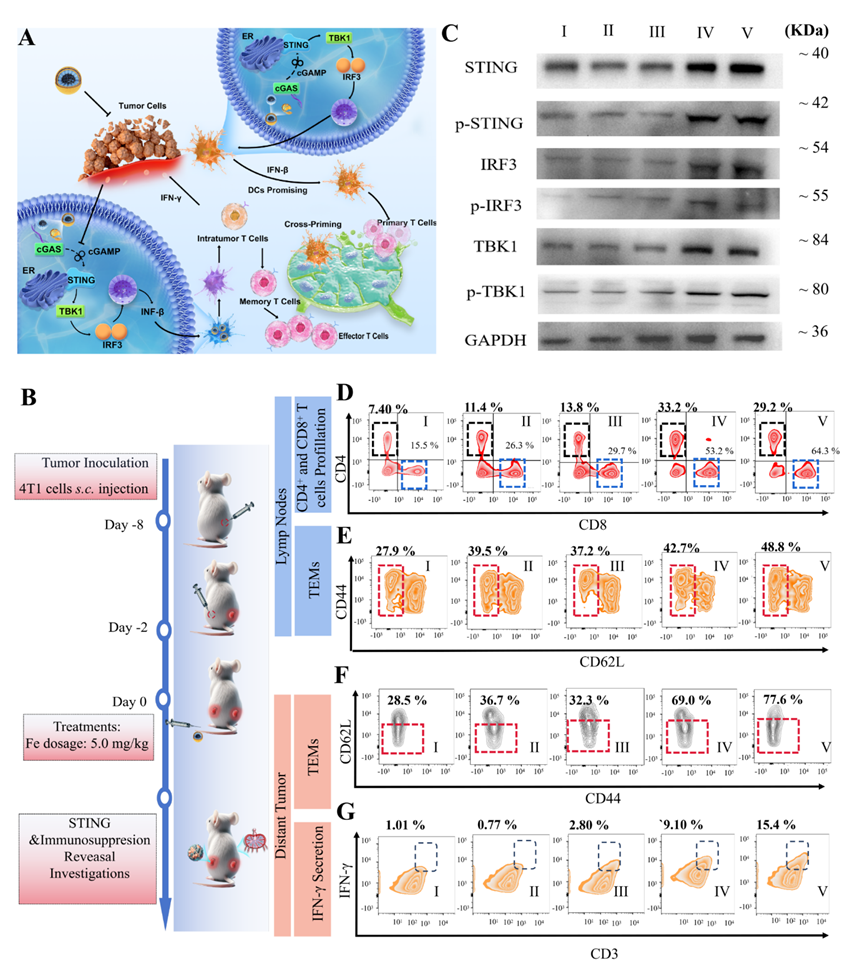
图4:Fe0@HMON@DNA-Exo纳米体系可激活和抑制转移肿瘤。
原文链接:
https://doi.org/10.1016/j.biomaterials.2024.122905
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#三阴性乳腺癌# #精准治疗#
76