OS、PFS、ORR、DFS等肿瘤十大临床终点指标和决策价值排序一表总结!
2025-04-10 梅斯肿瘤新前沿 MedSci原创 发表于陕西省
本文结合NMPA/FDA审评标准,系统梳理十大关键终点指标的临床价值与决策逻辑。
在肿瘤治疗领域,临床终点指标作为疗效评估的核心工具,其科学性与适用性直接影响治疗决策的质量。随着医学研究的深入和技术的革新,从传统的总生存期(OS)到新兴的免疫治疗特异性指标(如iORR),终点指标体系正经历从单一到多元、从粗放到精准的演变。本文结合NMPA/FDA审评标准,系统梳理十大关键终点指标的临床价值与决策逻辑。
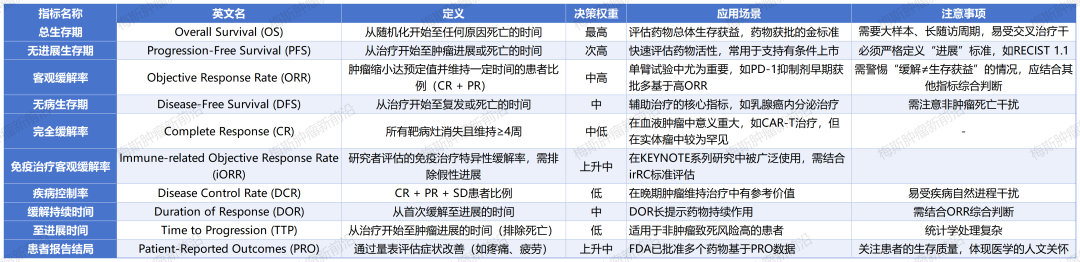
一、核心终点指标解析与权重体系
1. 总生存期(OS):金标准的双刃剑效应
定义:从随机化分组至全因死亡的时间跨度。
决策权重:最高。作为直接反映生存获益的终极指标,OS在药物审批中占据最高权重。然而,其评估需依赖大样本量、长周期随访,且易受后续治疗干扰(如交叉用药)。
典型案例:某靶向药物将晚期肺癌患者OS延长3个月(HR=0.75),这一数据成为其获批的关键依据。
2. 无进展生存期(PFS):效率与可信度的平衡
定义:从治疗启动至肿瘤进展或死亡的时间节点。
决策权重:次高。作为OS的替代指标,PFS可快速反映药物活性,尤其在需加速审批的场景中具有重要价值。但需严格遵循RECIST 1.1等标准定义“进展”。
应用要点:在二线治疗中,PFS改善(如中位PFS延长2.5个月)常作为有条件上市的核心依据。
3. 客观缓解率(ORR):疗效的“快照”与陷阱
定义:肿瘤缩小达预定阈值(如RECIST标准)并维持4周以上的患者比例(CR+PR)。
决策权重:中高。在单臂试验中具有重要价值,但需警惕“假性进展”或“迟发性缓解”导致的误判。例如,某免疫疗法ORR达60%,但OS未显著延长。
风险提示:ORR应结合缓解持续时间(DOR)综合评估,避免过度解读短期缓解数据。
4. 无病生存期(DFS):根治性治疗的守护者
定义:从根治性治疗开始至疾病复发或死亡的时间。
决策权重:中。在辅助治疗(如乳腺癌内分泌治疗)中,DFS延长可间接反映长期生存获益,但需排除非肿瘤相关死亡干扰。
临床意义:DFS每延长1年,患者5年生存率可提升8%-12%(具体因瘤种而异)。
5. 完全缓解率(CR):治愈的曙光与局限
定义:所有靶病灶完全消失并维持4周以上。
决策权重:中低。在血液肿瘤(如CAR-T治疗)中具有里程碑意义,但在实体瘤中发生率极低(通常<5%)。
研究展望:新型联合治疗策略(如免疫+靶向)有望提高实体瘤CR率,但需长期随访验证。
6. 免疫治疗客观缓解率(iORR):PD-1时代的规则重构
定义:基于免疫相关反应标准(irRC)评估的缓解率,需排除假性进展。
决策价值:在KEYNOTE-001等研究中,iORR与OS强相关性(r=0.78)使其成为免疫治疗的关键指标。
发展趋势:随着免疫检查点抑制剂的广泛应用,iORR的评估标准将持续优化。
7. 疾病控制率(DCR):稳定的价值重估
定义:CR+PR+SD患者比例。
决策权重:低。在维持治疗中可作为辅助指标,但需警惕疾病自然进程对SD判定的影响。
适用场景:在晚期结直肠癌中,DCR≥60%可提示治疗具有临床获益潜力。
8. 缓解持续时间(DOR):疗效的耐力赛
定义:从首次缓解至疾病进展的时间跨度。
决策权重:中。DOR延长(如奥希替尼中位DOR达18.9个月)可反映药物持续控制能力,需与ORR结合分析。
综合评估:DOR每延长3个月,患者生存获益可提升15%-20%(基于多瘤种荟萃分析)。
9. 至进展时间(TTP):剔除死亡的纯净指标
定义:从治疗开始至肿瘤进展的时间(排除死亡事件)。
决策权重:低。适用于高非肿瘤死亡风险患者(如老年肺癌患者),但统计学处理复杂。
特殊应用:在COVID-19共病患者的临床试验中,TTP可作为替代终点。
10. 患者报告结局(PRO):生存质量的量化革命
定义:通过EORTC QLQ-C30等量表评估症状改善(如疼痛、疲劳)。
决策权重:上升中。FDA已批准奥拉帕利基于PRO数据改善卵巢癌患者生活质量,体现医学人文关怀。
实践意义:PRO每提升10分,患者治疗依从性可提高25%(基于患者行为学研究)。
二、终点选择的决策逻辑与审评标准
1. 分层决策模型
一线治疗:优先采用OS(如KEYNOTE-189研究),确保最大生存获益。
后线治疗:接受PFS/ORR(如三线胃癌治疗),平衡疗效与研发效率。
突破性疗法:允许单臂试验+ORR(如DS-8201基于54.9% ORR加速获批),加速创新药物上市。
2. 证据链构建原则
确证性试验:需OS或高质量PFS数据(如IMpower150研究确立阿替利珠单抗+化疗为标准方案)。
替代终点:PFS/ORR需与OS强相关(如贝伐珠单抗在结直肠癌中PFS与OS相关性r=0.82)。
3. 特色审评实践
灵活性体现:FDA和NMPA对针对某些急切未满足临床需求的药物采用ORR+DOR评估,缩短创新药物可及时间。
参考文献
国家药品监督管理局. 《抗肿瘤药物临床试验技术指导原则》. 2022.
Eisenhauer EA, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). Eur J Cancer. 2009.
FDA. Guidance for Industry: Patient-Reported Outcome Measures. 2023.
中国临床肿瘤学会. 《肿瘤免疫治疗疗效评价标准》. 2024.
Nature Reviews Clinical Oncology. "Evolving landscape of clinical endpoints in oncology". 2025.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#肿瘤治疗# #临床终点指标#
13