聂广军团队最新《自然·通讯》:程序化纳米药物对胰腺癌代谢异常的双重矫正
2024-12-06 BioMed科技 BioMed科技 发表于陕西省
聂广军等设计纳米系统包封 TPCA-1 和特定 siRNA,该系统可在肿瘤微环境响应释放,纠正 PDAC 细胞和 PSC 代谢异常,抑制糖酵解和氧化磷酸化,在小鼠模型中显抗 PDAC 效力。
胰腺导管腺癌(PDAC)是一种高度侵袭性和致命性的恶性肿瘤,其特征是能量和间质代谢失调。这一特征得到了活化的胰腺星状细胞(PSC)的强烈支持,在这一过程中,PSC通过代谢串扰驱动过度的结缔组织增生和肿瘤生长
在这一研究中,郑州大学聂广军教授和国家纳米科学中心Yiye Li等人设计了一个程序化的纳米系统,旨在双重纠正过表达葡萄糖转运蛋白1(GLUT1)和CD71的PDAC细胞和PSC的代谢异常,以实现肿瘤治疗。该纳米系统基于一种肿瘤微环境响应脂质体,该脂质体包封了NF-κB抑制剂(TPCA-1)和CD71适配体连接的Glut1 siRNA。TPCA-1可将活化的PSC逆转为静止状态,这阻碍了PSC对PDAC细胞的代谢支持,并增强了siRNA对PDAC细胞的靶向递送。上述纳米调节策略抑制了有氧糖酵解和随后的氧化磷酸化增强,从而在原位异种移植物小鼠模型中增强抗PDAC的效力。因此,该研究的结果阐释了基于不同能量代谢特征的更个性化的PDAC疗法的治疗潜力。相关工作以“Dual rectification of metabolism abnormality in pancreatic cancer by a programmed nanomedicine”为题发表在Nature Communications。

【文章要点】
如图1所示,作者展示了一种基于阳离子脂质体的TME/PDAC细胞序贯靶向纳米系统(T-AsiG-CPL),用于共递送TPCA-1、选择性NF-κB抑制剂以及通过二硫键(AsiG)连接的CD71适配体/Glut1 siRNA(siG)杂交核苷酸序列,以恢复PDAC能量和基质代谢稳态。研究证明了,T-AsiG-CPL可在酸性肿瘤微环境(TME)中分解,导致TPCA-1和AsiG的释放。
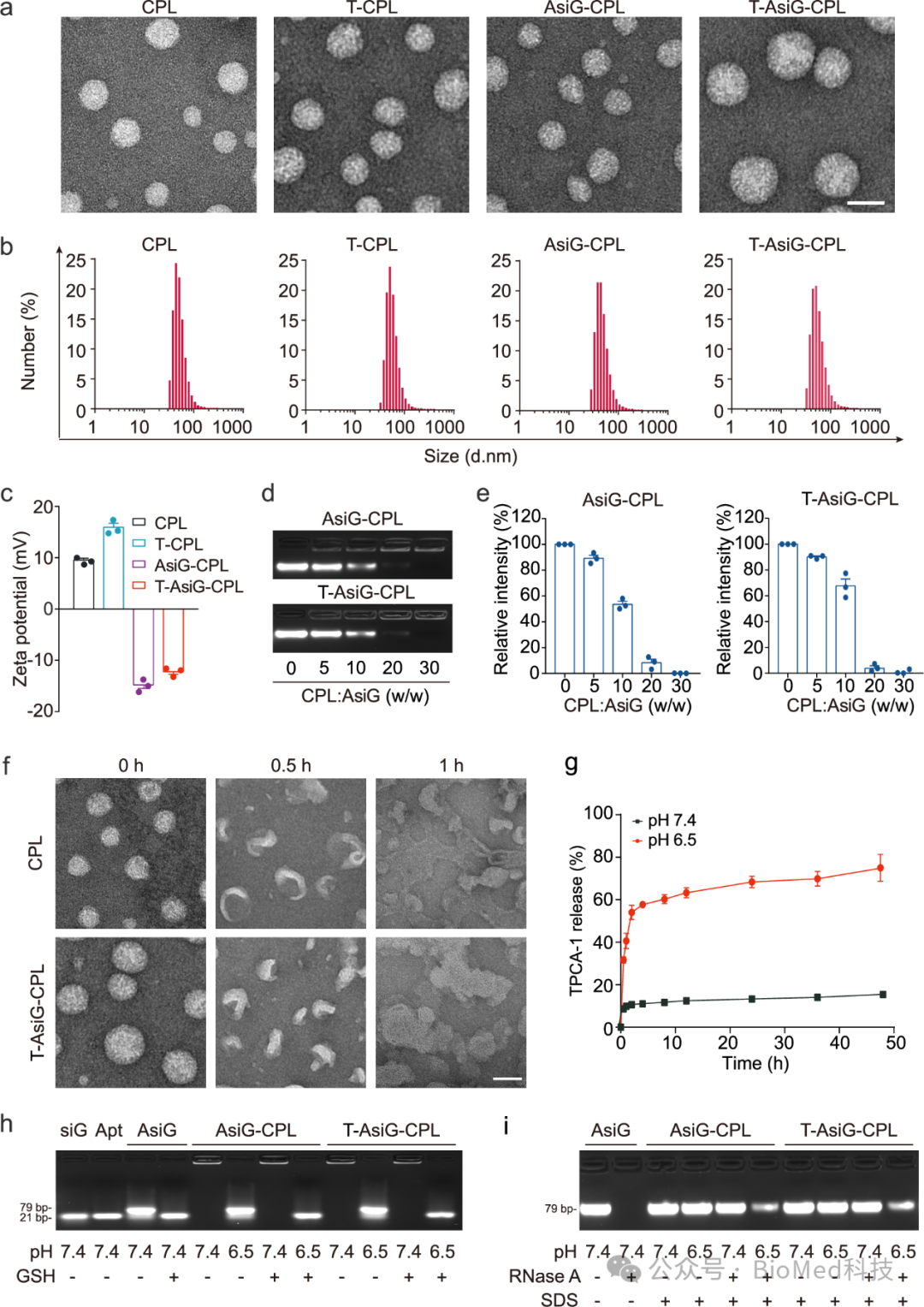
图1 T-AsiG-CPL的表征
释放后,TPCA-1诱导活化的PSC恢复到静止状态,减少ECM沉积,促进AsiG在肿瘤组织深处的二次递送。AsiG随后靶向过表达CD71受体的PDAC细胞,并在二硫键断裂时响应高浓度的细胞内谷胱甘肽(GSH)以释放siG。Glut1沉默降低了PDAC细胞的葡萄糖摄取并介导了有氧糖酵解的减弱,而TPCA-1进一步破坏了葡萄糖剥夺下NF-kB激活诱导的OXPHOS增强。NF-kB抑制和Glut1敲除的结合也协同中断了PSC和PDAC细胞之间的物质和能量交换(图2)。该策略解决了基质和能量代谢的异常,有望改善挑战性PDAC的治疗结果。此外,揭示PSC和T3M4细胞(T3M4细胞是一种以GLUT1过表达为特征的人类PDAC细胞系)之间的能量代谢串扰是一种有益的尝试,强调了上述纳米系统在中断细胞间能量和物质交换方面的有效性。最后,量身定制的代谢串扰调节可有效抑制PDAC原位异种移植物小鼠模型中的肿瘤进展。考虑到肿瘤的不同能量代谢特征,这指向了一种更个性化的PDAC治疗方法。
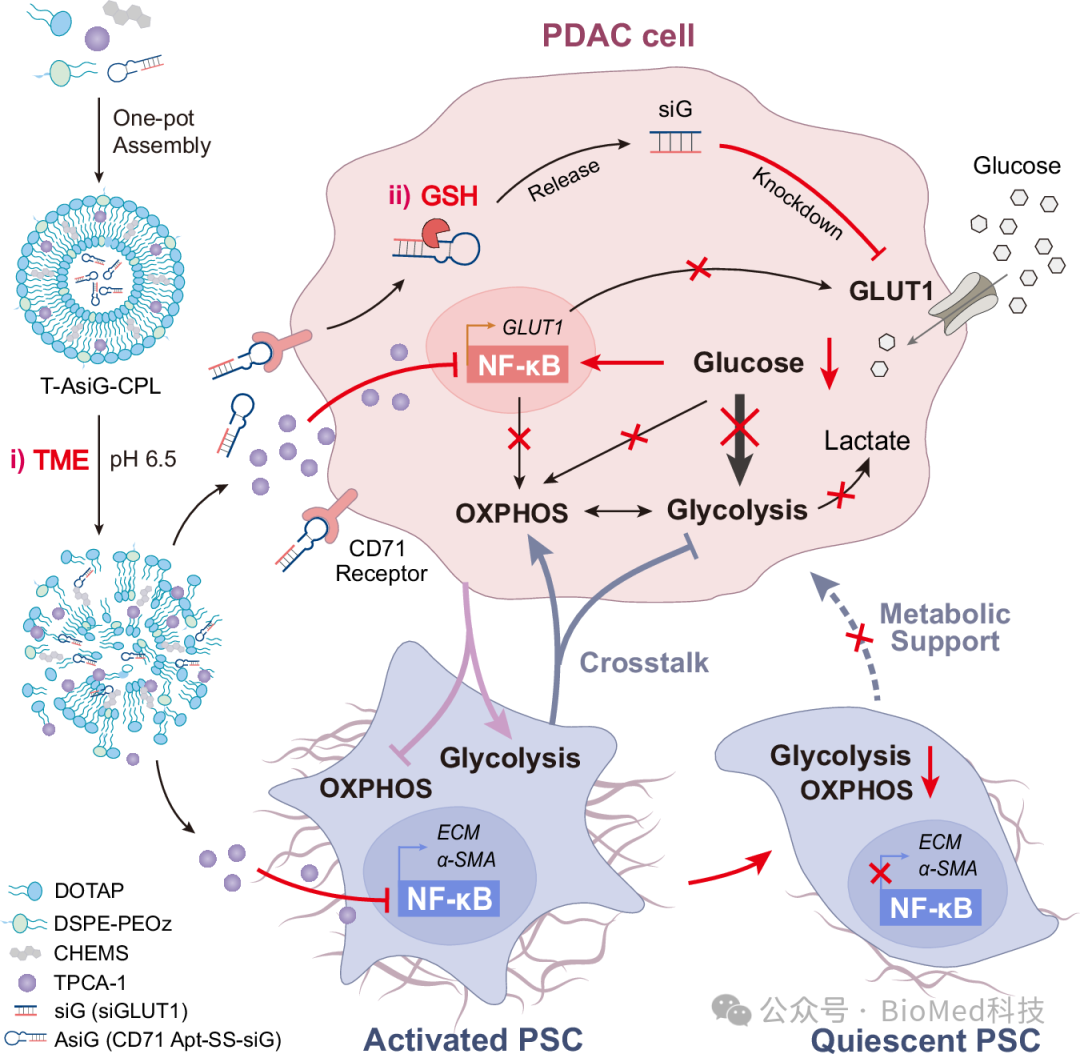
图2 通过T-AsiG-CPL介导的能量和基质代谢双重调节治疗PDAC
原文链接:
https://www.nature.com/articles/s41467-024-54963-y
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















#胰腺导管腺癌# #肿瘤治疗#
10