Nat Cardiovasc Res 中国科学技术大学翁建平团队揭示IGFBP6调控内皮细胞炎症和动脉粥样硬化的作用及机制
昨天 论道心血管 论道心血管 发表于陕西省
研究人员通过从体内到体外、从模式动物到患者等多维度开展了实验研究,揭示了IGFBP6是减轻内皮细胞炎症和预防动脉粥样硬化性心血管疾病的一个新的分子靶点。
动脉粥样硬化引起的心血管疾病(ASCVD)是全世界人类死亡的主要原因之一。炎症是引起和加速ASCVD发生发展的重要机制。几项具有里程碑意义的临床试验,比如CANTOS (N Engl J Med, 2017)、COLCOT (N Engl J Med, 2019)、LoDoCo2 (N Engl J Med, 2021)、RESCUE (Lancet, 2021),以及2023年美国FDA批准低剂量秋水仙碱作为减少ASCVD患者心血管事件的第一种抗炎药物,这些证据均表明靶向残余炎症风险对于ASCVD的治疗至关重要。与此观点一致的是:Ridker及其同事对31,245名接受他汀类药物治疗的患者进行了分析,发现hs-CRP评估的残余炎症风险比LDL-C评估的残余胆固醇风险更能预测未来心血管事件和死亡的风险(Lancet, 2023)。因此,寻找抵抗血管炎症的新靶点有望为治疗ASCVD带来新的希望。
研究人员从GEO公共数据库中选择了具有动脉粥样硬化保护效果的干预(他汀类药物或层流剪切应力)测序数据集,以及动脉粥样硬化患者斑块的基因表达数据集,发现胰岛素样生长因子结合蛋白6 (IGFBP6)可能是一种潜在的血管稳态相关分子。已有研究表明,IGFBP6在调节细胞周期、增殖、细胞迁移等方面发挥着至关重要的作用。然而,IGFBP6在内皮稳态和动脉粥样硬化中的确切作用和机制尚不清楚。
2025年1月10日,中国科学技术大学生命科学与医学部翁建平教授团队在Nature Cardiovascular Research期刊发表了题为“Endothelial IGFBP6 Suppresses Vascular Inflammation and Atherosclerosis”的研究论文。研究人员通过从体内到体外、从模式动物到患者等多维度开展了实验研究,揭示了IGFBP6是减轻内皮细胞炎症和预防动脉粥样硬化性心血管疾病的一个新的分子靶点。血流剪切应力领域知名专家美国耶鲁大学Martin A. Schwartz教授撰文“IGFBP6 contributes to vascular resilience”对此重点评论。

首先,研究者发现与健康人群相比,动脉粥样硬化患者的斑块和血清中IGFBP6水平降低。湍流刺激会引起人脐静脉内皮细胞(HUVEC)中的IGFBP6表达下调。对小鼠进行颈动脉部分结扎手术,发现与未结扎的血管相比,结扎后IGFBP6表达下降,分离小鼠的主动脉进行en face染色发现,与血流处于层流部位的胸主动脉(TA)相比,主动脉弓(AA)处IGFBP6也显著下调。以上结果说明,IGFBP6可以响应血流剪切应力的刺激,并且在湍流刺激下其表达显著降低。
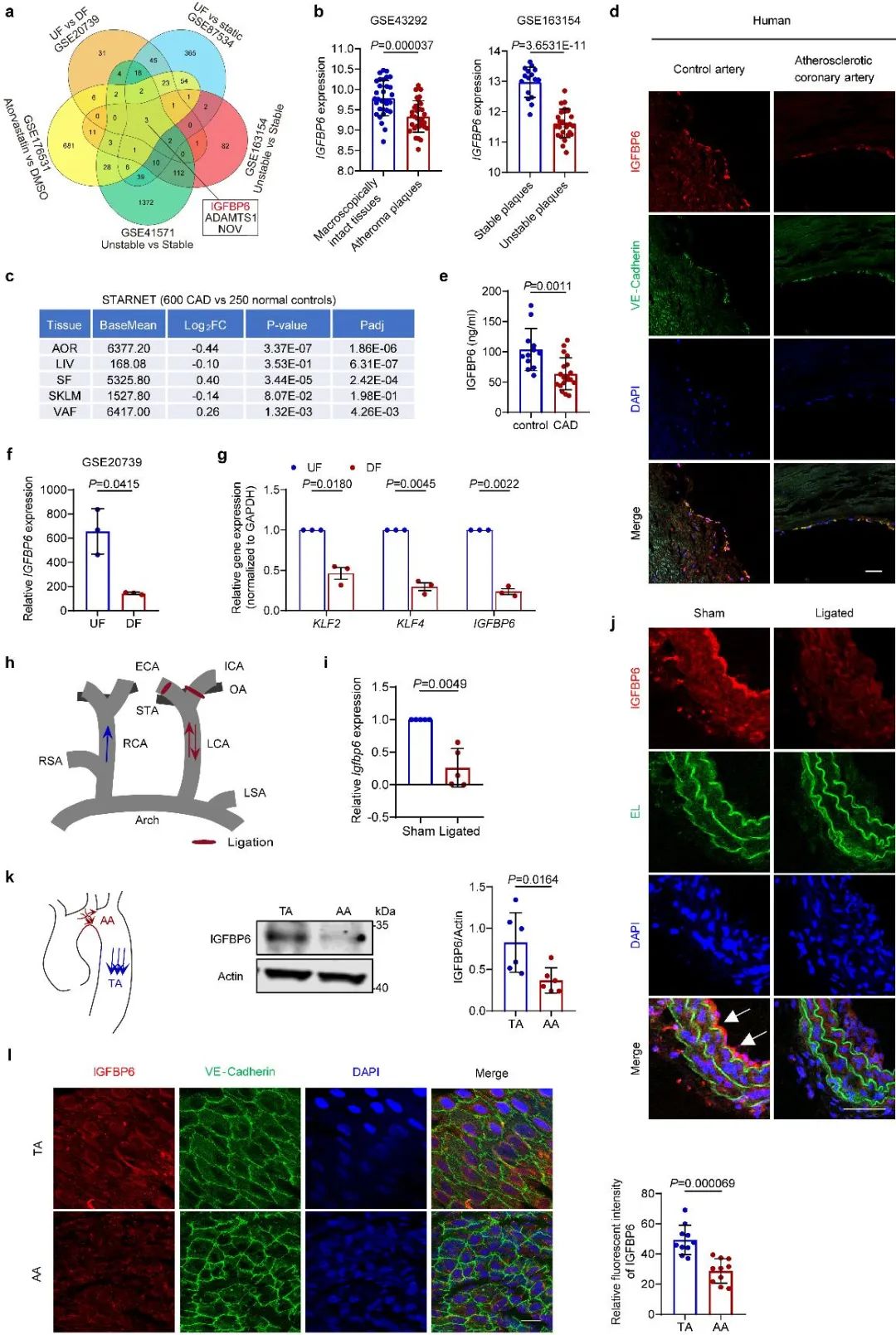
图1. IGFBP6在人动脉粥样硬化斑块中降低并受血流调节
接下来,为了进一步探究IGFBP6在动脉粥样硬化中的作用,研究者构建了IGFBP6全身敲除小鼠、内皮特异性敲除小鼠和内皮特异性过表达小鼠。分别给予左颈动脉部分结扎手术并喂养HCD饲料5周或尾静脉注射AAV8-PCSK9并喂养HCD饲料12周,构建不同的动脉粥样硬化小鼠模型以观察IGFBP6的具体作用。结果显示,全身敲除IGFBP6增加小鼠左颈动脉斑块面积;内皮特异性敲除IGFBP6增加小鼠主动脉和主动脉窦处斑块面积;内皮特异性过表达IGFBP6减少小鼠主动脉和主动脉窦处斑块面积,并降低炎症,增加斑块稳定性。以上实验结果表明,IGFBP6在动脉粥样硬化中发挥重要保护作用。
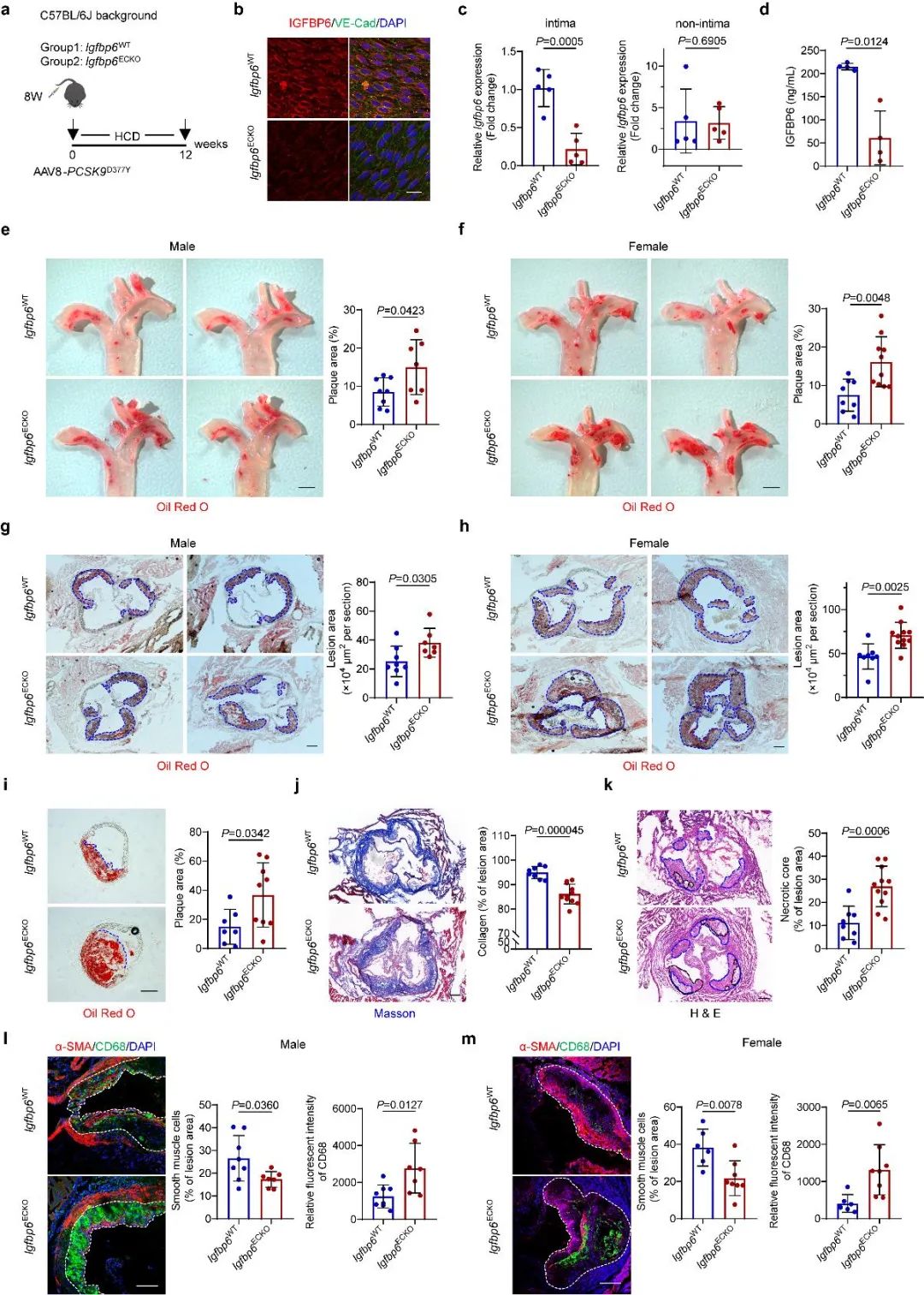
图2. 内皮特异性敲除IGFBP6可加重小鼠动脉粥样硬化
紧接着,研究者在HUVEC和人主动脉内皮细胞(HAEC)中发现IGFBP6与内皮炎症相关,并且通过敲低和过表达的方法确定了IGFBP6能调节TNF以及湍流所诱导的内皮炎症和单核细胞的粘附。研究者还发现,内皮特异性敲除IGFBP6能增加小鼠血管内白细胞数量和移动速率。
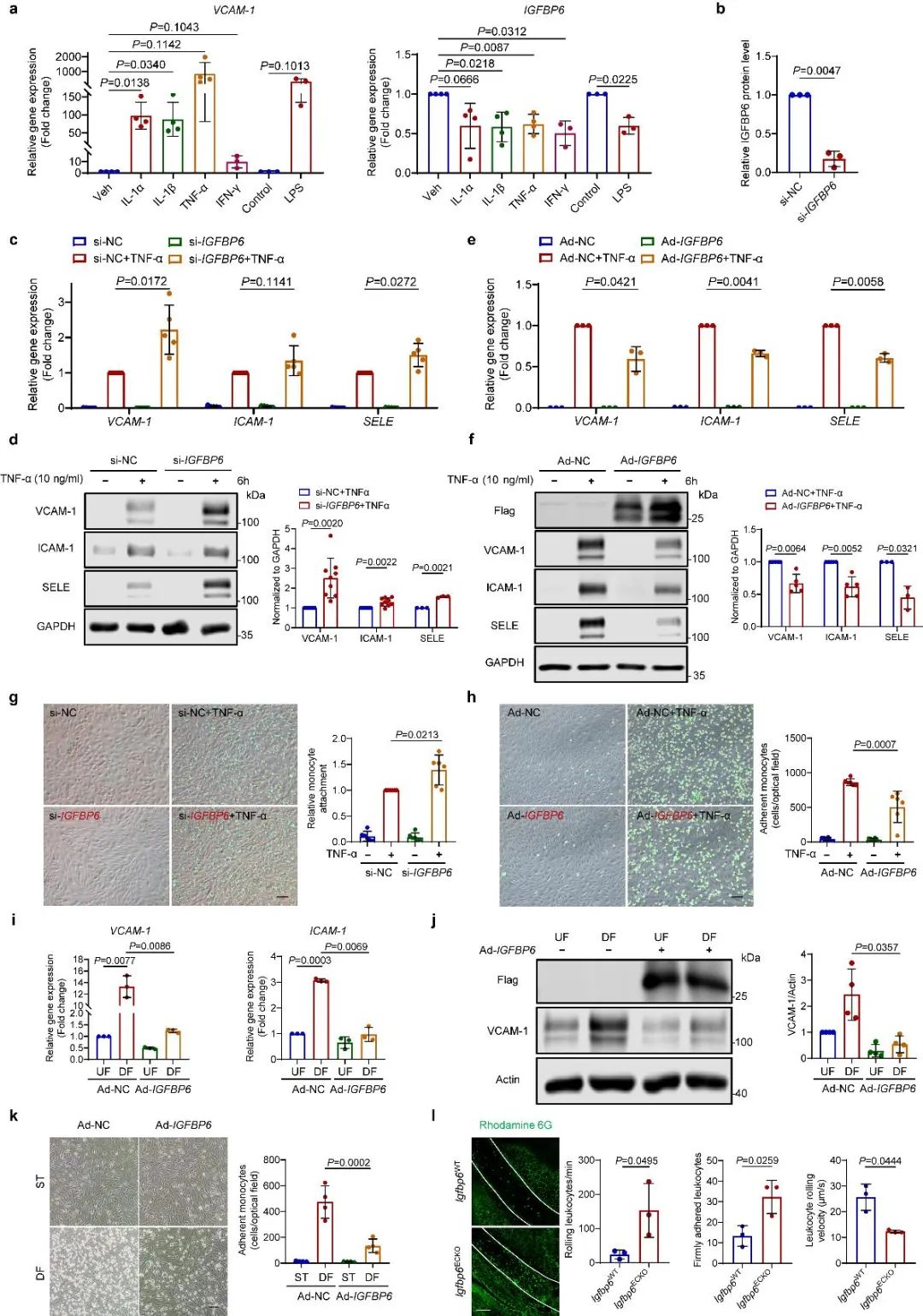
图3. IGFBP6调节内皮细胞炎症
为了进一步探究IGFBP6抑制内皮炎症的具体分子机制,研究者使用蛋白互作-质谱的方法找到主拱顶蛋白(MVP)可能是IGFBP6的互作蛋白。随后通过CoIP、SPR、免疫荧光等实验,进一步验证IGFBP6与MVP之间的结合。鉴于MVP通过c-Jun N-末端激酶(JNK)/核因子κB (NF-κB)信号轴发挥抗炎作用,研究者进一步发现在HUVEC和HAEC中,敲低或过表达IGFBP6均能促进或抑制p65和JNK的磷酸化。通过敲低MVP发现能逆转IGFBP6的作用,以及发现突变掉IGFBP6与MVP的结合位点后IGFBP6抗炎作用消退等,证明IGFBP6的内皮抗炎作用依赖于与MVP的结合。
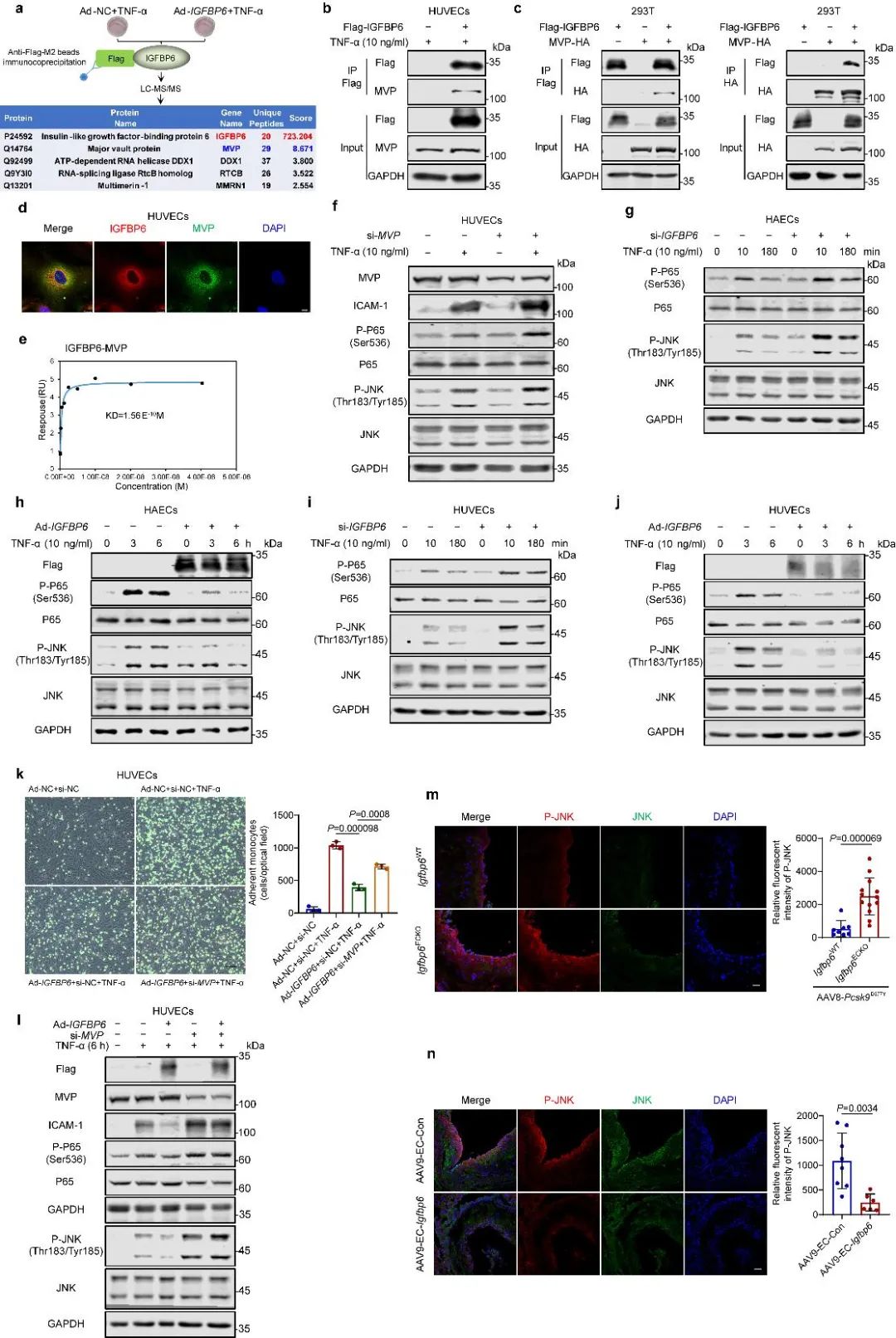
图4. IGFBP6通过与MVP互作抑制内皮炎症
综上,本研究表明IGFBP6响应血流剪切应力并具有抵抗内皮炎症和动脉粥样硬化的作用,有望成为治疗动脉粥样硬化和泛血管疾病的新靶点。
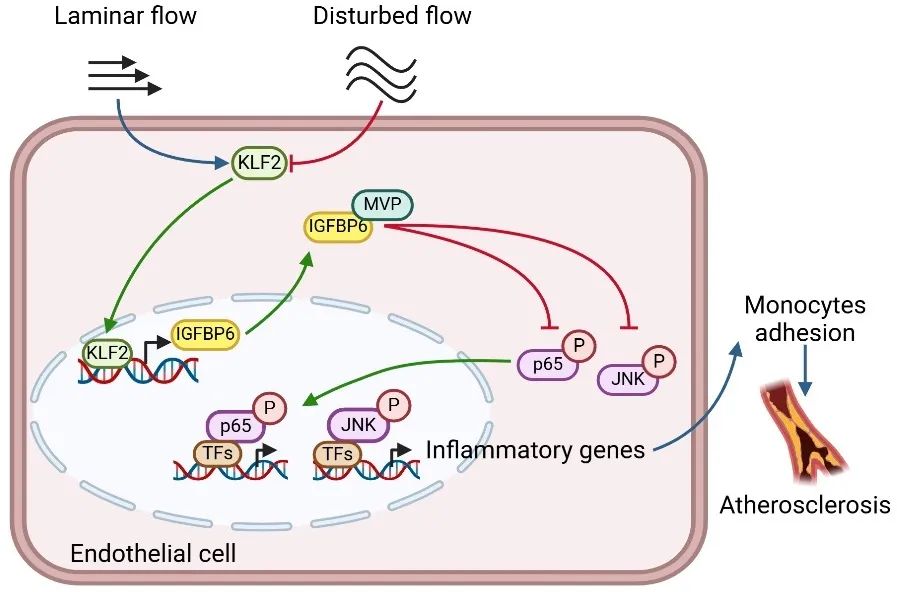
图5. IGFBP6保护内皮功能与动脉粥样硬化的机制示意图
中国科学技术大学生命科学与医学部博士研究生苏美名、博士研究生赵玟淇和课题组博士后蒋辉为该论文的共同第一作者,翁建平教授与徐索文研究员为本论文的共同通讯作者。复旦大学附属中山医院葛均波院士,美国罗切斯特大学Bradford C. Berk教授,美国埃默里大学Hanjoong Jo教授,美国弗吉尼亚州大学Clint L. Miller教授, 美国芝加哥大学Yun Fang教授,英国伦敦玛丽女王大学Paul C Evans教授,德国马普心肺研究所Stefan Offermanns院士,波兰罗兹医科大学Maciej Banach教授,苏州大学唐朝君教授、朱力教授,香港城市大学黄聿教授、王力教授,中国科学技术大学生命科学与医学部曾筑天教授均给予了重要帮助。该工作得到了科技部重点研发项目、国家自然科学基金、中国科大附一院创新攻关团队项目等资助,以及代谢健康与泛血管病安徽省重点实验室、中国科学技术大学内分泌与代谢病研究所的大力支持。
原文链接:
https://www.nature.com/articles/s44161-024-00591-0
述评链接:
https://www.nature.com/articles/s44161-024-00597-8
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















#动脉粥样硬化# #内皮细胞炎症#
10