Cell子刊:利用新型降解剂治疗神经母细胞瘤提供潜在新方案
2025-03-12 儿童肿瘤前沿 儿童肿瘤前沿 发表于陕西省
作者开发了一种选择性Aurora-A降解剂HLB-0532259能够靶向诱导N-Myc降解,并在治疗MYCN扩增的神经母细胞瘤方面展现出良好的疗效。
MYCN的异常表达与多种人类癌症的肿瘤发生密切相关,其中MYCN扩增是高危神经母细胞瘤 (NB) 的主要遗传驱动因素,也是临床上最强的独立不良预后因素。MYCN基因编码致癌转录因子N-Myc在正常神经前体细胞中泛素化-蛋白酶体系统快速降解,在MYCN扩增的NB细胞中,Aurora-A激酶与SCF-Fbxw7 E3连接酶复合体结合,干扰泛素化,导致N-Myc稳态蛋白水平升高,从而促进肿瘤生长。
尽管Aurora-A变构抑制剂 (如MLN8237) 可破坏Aurora-A/N-Myc复合物,但其对N-Myc的作用存在负协同效应,临床疗效有限。另一策略则是通过Aurora-A降解剂促进N-Myc降解,蛋白降解靶向嵌合体 (PROTAC) 技术可以通过双功能配体将泛素连接酶E3和靶标蛋白连接成三体复合体,进而利用“泛素-蛋白酶体”途径特异性地降解靶蛋白,可以改善“不可成药”靶点的成药性。通过该技术选择性降解Aurora-A,可为N-Myc高表达患者提供新的治疗方案。
近日,Daniel A. Harki 团队在 Cell Chemical Biology 发表题为 Targeting N-Myc in neuroblastoma with selective Aurora kinase A degraders 的研究论文中,作者开发了一种选择性Aurora-A降解剂HLB-0532259能够靶向诱导N-Myc降解,并在治疗MYCN扩增的神经母细胞瘤方面展现出良好的疗效。

敲低Aurora-A表达可显著下调MYCN扩增型神经母细胞瘤中的N-Myc水平。因此,可以通过化学手段靶向降解Aurora-A来降解破坏N-Myc。研究人员通过PROTAC技术开发了Aurora-A降解剂,以促进N-Myc的降解。研究人员选择FDA已批准药物瑞博西利 (Ribociclib, 一种高度选择性的CDK4/6抑制剂) ,通过对其吡啶基哌嗪部分进行化学修饰,生成的配体2对Aurora A的结合亲和力增加了约1000倍;进一步,将配体2与沙利度胺(Thalidomide, 靶向CRBN,CRL4CRBN E3泛素连接酶的底物受体) 通过6碳烷基链连接,开发出了针对Aurora-A的蛋白降解嵌合体配体4,命名为HLB-0532259;同时根据两种药物分子特性生成对照配体3、5和6。对468个激酶在1 μM浓度下的筛选结果也显示HLB-0532259具有优异的靶点选择性。

图1. Aurora-A激酶选择性降解剂设计开发。A 表示通过靶向Aurora-A (AURKA) 蛋白质降解实现N-Myc降解示意图。B 显示了对CDK4/6抑制剂1 (Ribociclib) 进行化学修饰,合成Aurora-A配体2和3,以及Aurora-A 的蛋白降解嵌合体分子4、5和6。C 显示了Aurora-A配体对Aurora-A和CDK4-Cyclin D1的结合亲和力 (KD) 。D 显示了配体4对468种激酶的选择性分布图。E 显示配体4诱导MCF-7细胞中Aurora-A而非CDK4的降解。F 显示了配体4在MCF-7细胞中诱导Aurora-A降解的机制通过蛋白酶体降解途径。
HLB-0532259在MYCN扩增的神经母细胞瘤细胞中选择性促进Aurora-A和N-Myc的降解。研究证实,该降解剂通过泛素-蛋白酶体途径发挥作用,其降解效果优于MLN8237和CD532等抑制剂。其高选择性体现在对其他蛋白影响较小,尤其是已知CRBN调节剂的底物如GSPT1、CK1a和ZFP91。这些结果表明HLB-0532259在Aurora-A和N-Myc选择性降解方面具有显著优势。
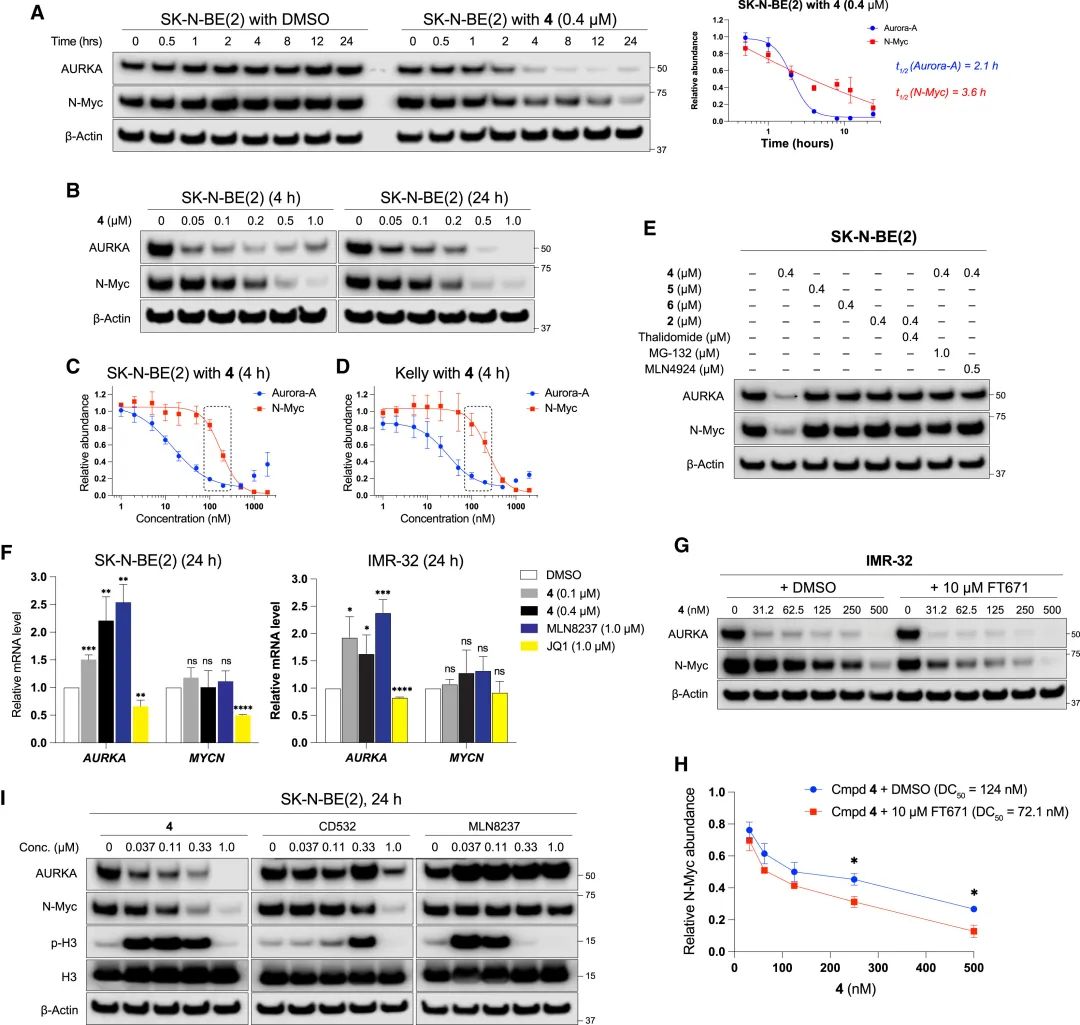
图2. HLB-0532259间接诱导MYCN扩增的NB细胞中N-Myc降解。A-D 结果显示在SK-N-BE(2)细胞中时间依赖性地诱导Aurora-A和N-Myc降解及其降解曲线。E 显示HLB-0532259诱导Aurora-A和N-Myc降解依赖泛素-蛋白酶体途径。F 结果显示HLB-0532259在SK-N-BE(2)和IMR-32细胞中并未影响MYCN mRNA水平,表明N-Myc蛋白水平的下降并非由于其转录抑制。G-H 表明与选择性USP7抑制剂FT671的联合治疗显示出协同降解N-Myc的效果,表明USP7对多聚泛素化N-Myc具有拯救作用。I 结果显示HLB-0532259与MLN8237和CD532比较具有更好的降解效果。
进一步的体内外实验表明,HLB-0532259对MYCN扩增的神经母细胞瘤具有显著治疗潜力。HLB-0532259处理显著影响了p53和N-Myc通路,导致MYCN扩增的NB细胞周期停滞和凋亡。在体外实验中,HLB-0532259对MYCN扩增的NB细胞表现出显著的抑制作用,而对MYCN非扩增的NB细胞效果较弱。此外,HLB-0532259在小鼠模型中也表现出抗肿瘤活性,能够显著延缓肿瘤生长,在初始治疗第9天时观察到肿瘤体积的显著减少。然而,长期使用可能导致肠道坏死等副作用,这可能与其较长的半衰期和较高的药物暴露有关。这些结果为未来优化HLB-0532259的理化和药代动力学特性以提高其治疗效果提供了基础。
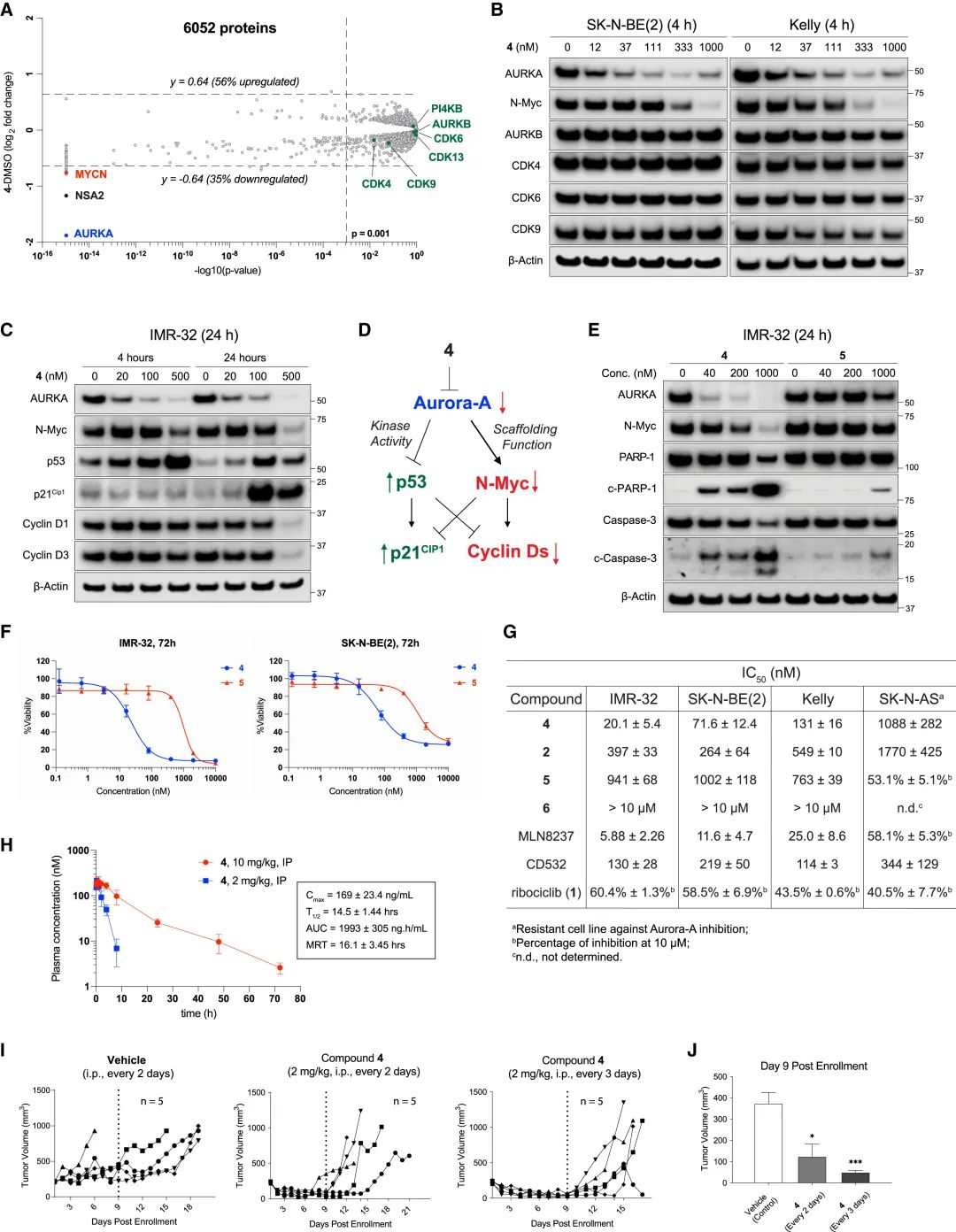
图3. HLB-0532259在神经母细胞瘤治疗中的作用及其机制。A 显示了SK-N-BE(2)细胞在HLB-0532259后蛋白质丰度的变化情况。B 显示SK-N-BE(2)和Kelly细胞在HLB-0532259,Aurora-A、N-Myc及其他激酶的蛋白表达情况。C-D 显示HLB-0532259处理TP53野生型IMR-32细胞中,上调了肿瘤抑制蛋白p53和p21Cip1的表达,下调了致癌蛋白N-Myc和CyclinDs表达。E 显示了HLB-0532259处理IMR-32细胞后凋亡标志物裂解的PARP-1和激活型caspase-3表达。F-G 分别显示了HLB-0532259在SK-N-BE(2)和IMR-32细胞中的细胞毒性,以及在MYCN扩增和MYCN非扩增的NB细胞中的细胞毒性。H 显示了HLB-0532259在小鼠中通过腹腔注射后的药代动力学特性。I-J 显示了HLB-0532259每2天或每3天腹腔注射对雌性裸鼠中SK-N-BE(2)肿瘤生长的影响。
综上,该研究开发的靶向Aurora-A蛋白降解嵌合分子HLB-0532259,可以间接诱导N-Myc的降解,并且有高度的降解选择性,并在体外和体内NB模型中表现出靶向调节效应和治疗潜力。但未来还需要进一步研究HLB-0532259诱导N-Myc降解的分子机制以及药物化学工作来优化和改善其药物样性质。

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#神经母细胞瘤# #HLB-0532259#
10