中位随访4年,NSCLC术后ctDNA-MRD阳性患者全复发, IA3期也未幸免,比影像早3.2个月
18小时前 苏州绘真医学 苏州绘真医学 发表于陕西省
研究对46例II-III期非小细胞肺癌患者进行ctDNA检测。标志性分析中,术后早期ctDNA阳性患者复发早、预后差;纵向分析显示ctDNA阳性患者均复发,系列检测可提前3.2个月发现复发。
据报道,通过循环肿瘤 DNA(ctDNA)检测到的分子残留病灶能够预测多种类型癌症患者在接受根治性治疗后的预后情况。然而,关于肺癌中纵向 ctDNA 检测与长期随访之间的关联,仍需要更多详细信息。在此,研究者报告了一组接受了根治性手术,并在术前、辅助治疗阶段和监测阶段进行了 ctDNA 分析的非小细胞肺癌(NSCLC)患者队列的相关情况。研究从 46 例临床分期为 II-III 期的NSCLC患者中采集血浆样本,包括术前(n = 46)、术后(n = 45)以及每六个月采集一次,直至术后两年(n = 78)。采用一种经过临床验证的、个性化的、tumor-informed的 16 重聚合酶链式反应 - 下一代测序检测方法,对回顾性分析的血浆样本中的 ctDNA 进行检测和定量。
在标志性分析中,13%(6/45)的患者在术后首次(术后 51 天内)采集的血浆样本中检测到了ctDNA。这些患者均在中位时间 9.1 个月内出现了疾病复发。与在标志性时间点未检测到 ctDNA 的患者相比,这些患者的无复发生存期和总生存期更短(p < 0.01),且在多变量分析中也是如此(p < 0.03)。从纵向角度(考虑所有术后随访时间点)来看,共有 13 例患者检测到了 ctDNA,且所有这些患者均出现了疾病复发(阳性预测值 = 100%)。有 3 例仅发生中枢神经系统转移的患者未检测到 ctDNA。
术后或监测期间存在 ctDNA 可识别出复发高风险的NSCLC患者。系列检测对于更早发现疾病复发至关重要(提前时间:3.2 个月)。
研究背景
尽管近期靶向治疗和免疫治疗在NSCLC患者围手术期管理中的应用极大地改善了患者的生存预后,但仍有部分患者可能需要更强化的治疗。同时,也有一些患者仅通过手术就得以治愈,因此术后治疗或许可以安全地降级甚至省略。目前,尚无可靠的生物标志物能够准确地对接受根治性手术的NSCLC患者进行风险分层,并辅助制定关于治疗升级或降级的决策。
基于ctDNA检测手术后的分子残留病灶(MRD),最近已成为包括NSCLC在内的多种实体瘤中一种颇具前景的预后评估工具。检测 ctDNA 有多种技术,包括基于聚合酶链式反应(PCR)的方法 以及基于下一代测序(NGS)的方法,其中也包括定制的NGS。这些方法各有优缺点,比如在灵敏度和成本方面存在差异;然而,目前尚不清楚不同的技术会如何影响检测结果。在Kindai大学之前的一项针对20名肺癌患者的试点研究中,使用基于NGS的癌症个性化分析,通过深度测序分析,大多数术后(3-12天内)ctDNA阳性患者在6个月内出现早期疾病复发。不过,即使在肺切除术后的标志性时间点未检测到 ctDNA 的患者中,对 ctDNA 进行纵向(监测)分析也可能是一种有用的工具,能够比临床或影像学检测更早地发现疾病复发。当考虑到具有更高 ctDNA 检测灵敏度的检测方法时,情况更是如此。因此,本研究评估了一种个性化的、tumor-informed的 ctDNA 检测方法的预后价值。研究者将通过纵向检测得出的 ctDNA 存在情况,与各种临床病理特征以及患者在较长随访期(中位随访期:47.5 个月,范围:4.8 - 68 个月)内的预后情况进行了关联分析。
研究方法
本研究对 2018 年 1 月至 2020 年 6 月期间在该机构接受肺切除术的 50 例临床(c)IIA-IIIA 期非小细胞肺癌(根据第八版肿瘤、淋巴结和转移分期标准)患者进行了纳入评估。曾接受新辅助化疗,或在过去五年内患有除肺癌以外的晚期恶性肿瘤的患者被排除在外。在这 50 例患者中,有 4 例(8%)被排除在研究之外;其中 1 例患者撤回了知情同意书,另外 3 例患者的血浆样本未通过质量检查。因此,本研究对 46 例患者的数据进行了分析。术前血样在手术前 48 小时内采集。术后首次血样在手术切除后/辅助治疗开始前的中位时间为 7 天(范围:2 - 51 天)采集,这个时间点被称为标志性时间点。此后,术后血样每六个月纵向采集一次(监测)。在每个时间点,将 8.5 毫升血液采集到游离 DNA 采集管中。血浆在一周内通过离心分离,并储存在 - 80°C 环境中备用。采用一种经过临床验证的、个性化的、tumor-informed的16-plex PCR-NGS(Signatera 检测法)对血浆样本中的 ctDNA 进行检测和定量。简而言之,对肿瘤组织(冷冻肿瘤组织 [n = 28] 或福尔马林固定、石蜡包埋组织 [n = 22])以及匹配的正常血样进行全外显子组测序。从全外显子组测序结果中选择最多 16 个患者特异性的体细胞单核苷酸变异位点,用于多重PCR检测,以便追踪相应患者储存的血浆样本中的 ctDNA(血浆样本的中位体积为 4.3 毫升,范围 2.4 毫升 - 6.4 毫升)。可检测到至少有 2 /16个变异位点的血浆样本被定义为 ctDNA 阳性,其浓度以每毫升血浆中平均肿瘤分子数来衡量。
研究结果
患者特征:
该队列由 36 名男性(78.2%)和 10 名女性(27.8%)组成,中位年龄为 72.5 岁(范围:50 - 89 岁),因此在本研究将年龄分界点设定为 73 岁。病理亚型包括 15 例鳞状细胞癌(41.7%)、26例腺癌(56.5%)、2 例腺鳞癌(4.3%)以及 3 例其他类型(6.5%)(小细胞癌与鳞状细胞癌混合型、大细胞神经内分泌癌和腺样囊性癌)。患者临床特征的详细信息总结于表 1 中。在这个队列中,17 名患者(37%)接受了辅助化疗,而 29 名患者(63%)未接受辅助化疗。
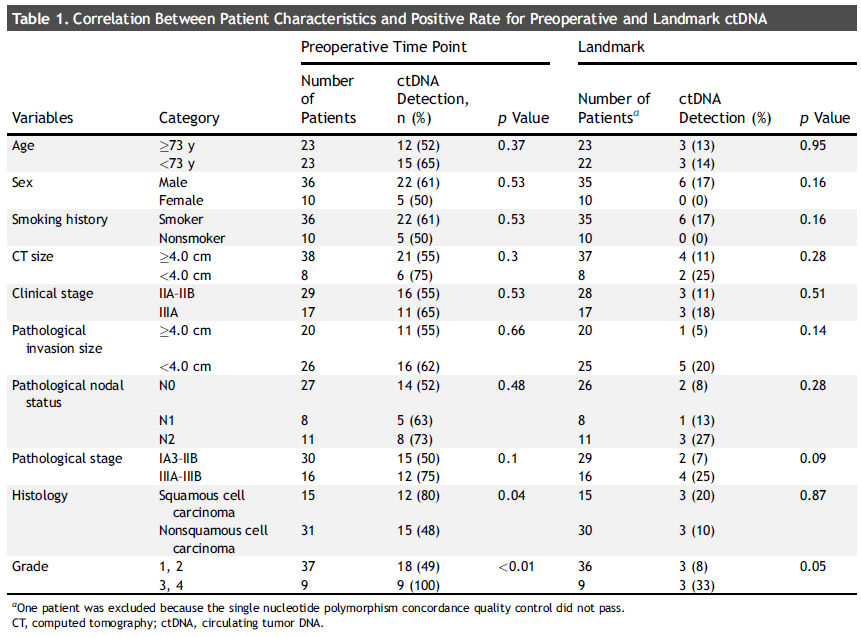
表1
术前ctDNA分析:
在 46 名患者中,27 名(59%)在术前检测到了 ctDNA(表 1)。显著影响ctDNA 阳性的因素是组织学类型(鳞状细胞癌中为 80%,非鳞状细胞癌中为 48%,p = 0.04)和组织学分级(1 - 2 级中为 49%,3 - 4 级中为 100%,p < 0.01)。术前 ctDNA 阳性的患者往往无复发生存期(RFS)较短(风险比 [HR] = 1.55,p = 0.31)(图 1A),总生存期(OS)也较短(HR = 1.57,p = 0.19)(图 1D);不过,这些差异未达到统计学显著性。
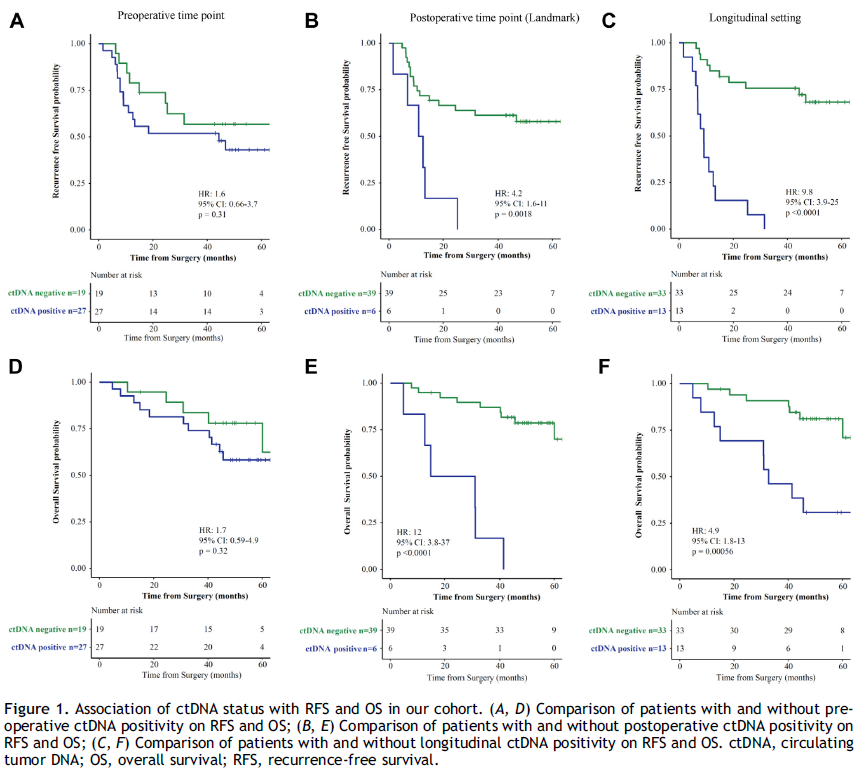
图1
标志性时间点ctDNA分析:
在 45 名在标志性时间点进行了 ctDNA 检测的患者中,有 6 名 ctDNA 呈阳性。标志性时间点的 ctDNA 阳性与组织学分级显著相关(1 - 2 级中为 8%,3 - 4 级中为 33%,p ≤ 0.05)。此外,病理分期较高的患者在标志性时间点 ctDNA 阳性的发生率往往更高(p 分期 I - II 期中为 7%,III 期中为 25%,p = 0.09)(表 1)。
在本研究中,中位随访时间为 47.5 个月(范围:4.8 - 68 个月,图 2),19 名患者出现了疾病复发(局部复发,n = 9;颅外远处转移 ± 中枢神经系统 [CNS] 转移,n = 7;仅CNS转移,n = 3 [图 3])。在标志性时间点 ctDNA 呈阳性的所有 6 名患者(100%)在手术后两年内(中位时间 9.1 个月)均出现了疾病复发,阳性预测值为 100%。另一方面,在标志性时间点 ctDNA 阴性的 39 名患者中,有13 名(33.3%)出现了疾病复发,其中只有 3 名患者发生了颅外远处转移,其余 10 名患者出现了局部复发(n = 7)和仅CNS转移(n = 3)。所有未出现疾病复发的患者在标志性时间点 ctDNA 均为阴性(特异性 = 100%);然而,需要注意的是,ctDNA 阴性并不能保证不复发,因为在 19 名出现疾病复发的患者中有 13 名 ctDNA 为阴性。
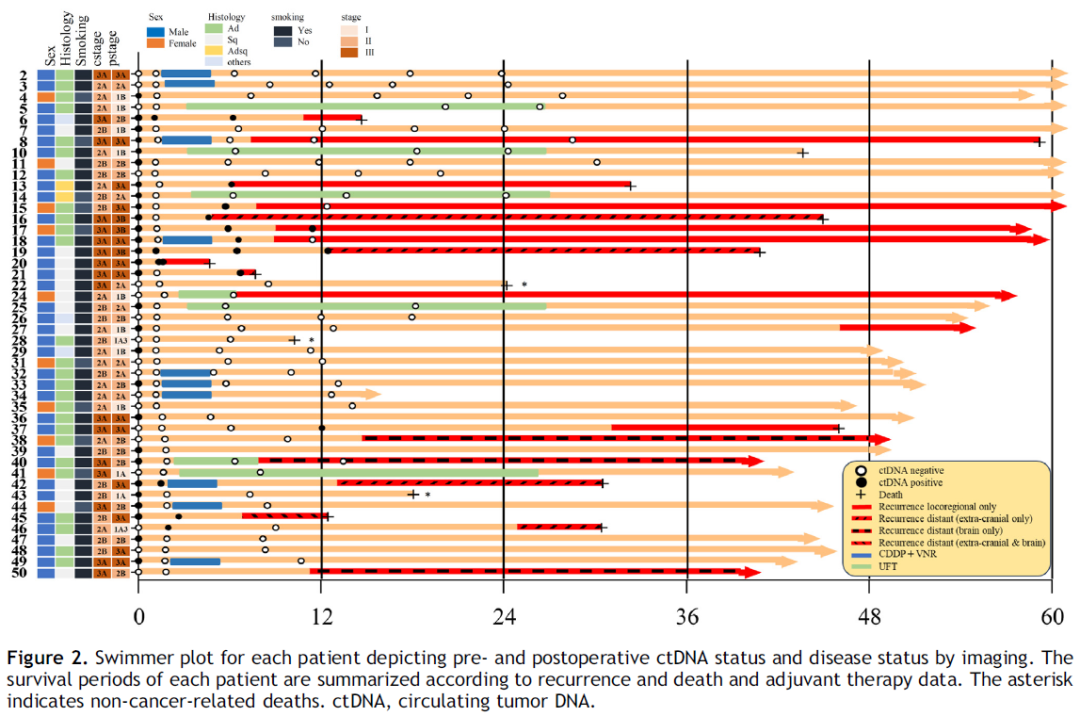
图2
在生存分析中,与标志性时间点 ctDNA 阴性的患者相比,标志性时间点 ctDNA 阳性的患者RFS(HR = 4.18,p < 0.01)和OS(HR = 14.4,p < 0.01)显著更差(图 1B 和 E)。在多变量分析中,标志性时间点的 ctDNA 阳性是RFS和OS较差的独立预测因素(表 2)。
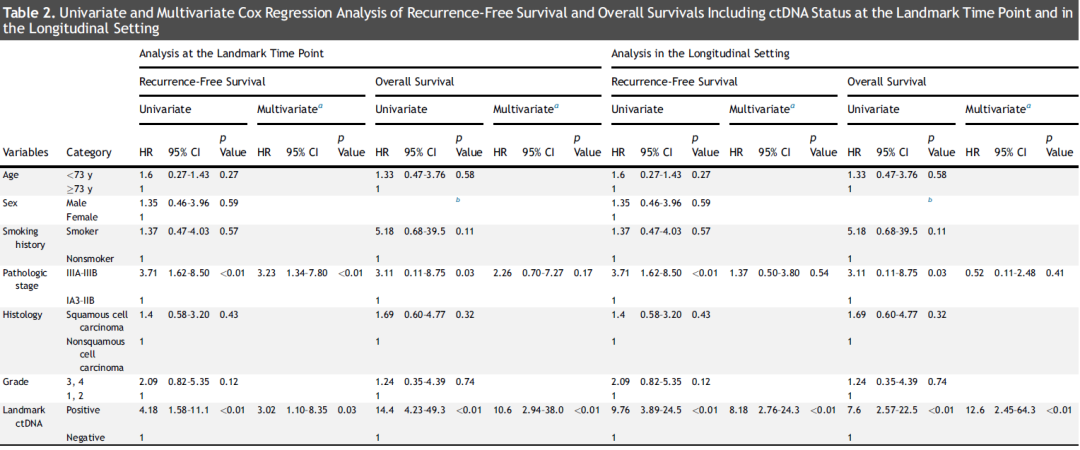
表2
接下来,研究者进行了竞争风险分析,以考虑数据集中观察到的非癌症死亡情况。竞争风险分析确定,术后 ctDNA 阳性(标志性时间点)与疾病复发的风险显著增加相关(p = 0.0009);而术前 ctDNA 阳性的显著性未得到确定(p = 0.25)。
纵向ctDNA分析:
在 16 名出现颅外远处复发的患者中,13 名患者(81.3%)在术后任何时间开始的纵向检测中 ctDNA 呈阳性。3 名仅发生CNS转移的患者在系列检测中ctDNA 始终为阴性(图 3)。值得注意的是,与术后系列检测中 ctDNA 始终为阴性的患者相比,术后任何时间点 ctDNA 呈阳性的患者发生颅外复发的可能性高 16 倍(HR = 16,p < 0.0001)。在影像学检测到复发之前,ctDNA 检测的中位提前时间为 3.2 个月(范围:0 - 24.3 个月)。直到随访结束时仍无复发的所有患者在系列检测中 ctDNA 均为阴性(特异性 = 100%)。
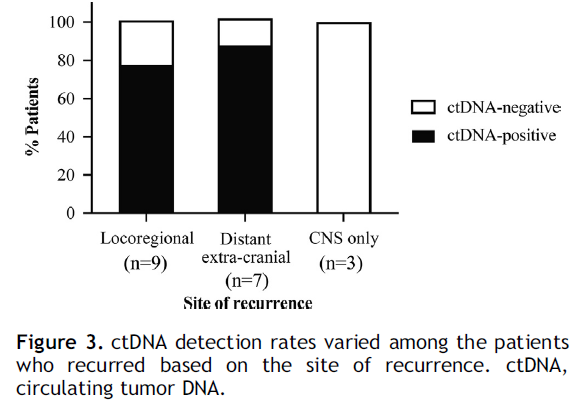
图3
在单变量和多变量分析中,与术后系列检测中 ctDNA 始终为阴性的患者相比,术后任何时间点 ctDNA 呈阳性(纵向 ctDNA 阳性)的患者RFS(HR = 9.76,p < 0.01)和OS(HR = 7.60,p < 0.01)显著更差(图 1C 和 F;表 2)。
有 6 名患者在影像学复发前的时间点未检测到 ctDNA(“患者 8、24、27、38、40 和 50”)(图 2)。在这 6 名患者中,3 名是鳞状细胞癌,3 名是非鳞状细胞癌;p 分期为 I 期、II 期和 III 期的患者分别有 2 名、3 名和 1 名。当查看复发部位时,这6 名患者中有 3 名仅发生了脑转移(图 3)。
病例报告:ctDNA 用于预测复发和监测治疗反应
一名 69 岁男性患者(患者 18;图 4)因肺腺癌(病理分期 IIIA 期)接受了左上肺叶切除术。他在术前检测到了 ctDNA;然而,在术后第(POD)9 天抽取的血液中未检测到ctDNA。不过,在术POD 200 天,ctDNA 转为阳性,而此时通过 CT 检查未发现复发迹象。在POD 272 天进行的后续 CT 检查显示,患者出现了纵隔淋巴结转移(提前发现时间:72 天)。他在POD 290 天开始接受同步放化疗,随后使用度伐利尤单抗治疗一年。在使用度伐利尤单抗治疗期间,ctDNA 消失了,这从POD 348 天的检测结果为阴性可以得到证实。直到最后一次随访(POD 1748 天),该患者一直未出现复发。这个病例强调了纵向 ctDNA 分析作为一种在影像学检查之前检测复发以及监测治疗反应的工具的临床实用性。
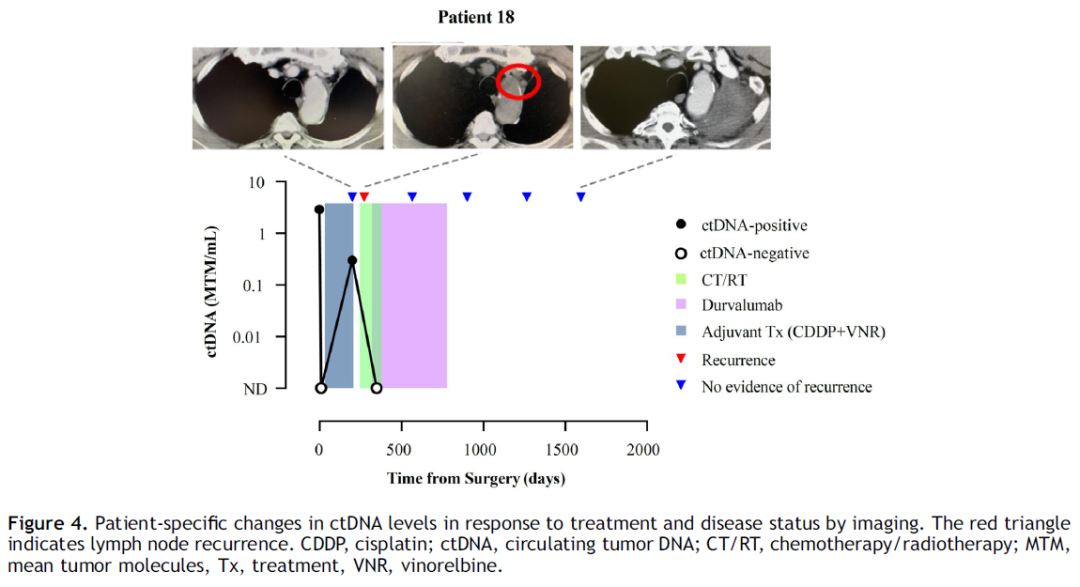
图4
讨 论
研究评估了一种tumor-informed的 ctDNA 检测方法,将其作为肺切除术后检测MRD的工具(标志性分析)以及早期检测疾病复发的工具(切除术后的任何时间)。最近Chen 等人的一项研究 指出,术后一天在血浆样本中检测到的 ctDNA 可能无法预测肿瘤复发,这可能是因为术前存在的 ctDNA 尚未完全降解,但术后三天检测到的 ctDNA 则具有预测性。本研究结果与这一观察结果一致;在术后 51 天内的标志性时间点 ctDNA 呈阳性的所有 6 名患者均出现了疾病复发。在标志性分析和纵向分析中,阳性预测值和特异性均为 100%。即使是 IA3 期的患者,有 1 名在标志性时间点 ctDNA 呈阳性的患者也出现了复发,这表明辅助化疗可能适用于 I 期患者。从纵向来看,7 例颅外远处复发中有 6 例可通过ctDNA 检测到,而 3 例仅脑转移复发和 2 例局部复发的情况未被检测到。换句话说,这表明使用 Signatera 检测法进行的标志性 ctDNA 分析的灵敏度为 31.6%。这一数值与已报道的接受手术切除的非小细胞肺癌患者的数据大致相符;预测复发的灵敏度范围在 33%- 100%。观察到的灵敏度低于我们的预期。无论如何,目前可用平台进行的标志性ctDNA 检测,即使采用tumor-informed的方法,其灵敏度也不足以将仅通过手术就能治愈的患者排除在辅助治疗的候选人群之外。在 Impower 010 的一项探索性研究中,辅助使用阿替利珠单抗延长了 II 至 III 期手术切除的非小细胞肺癌患者的DFS,通过 Signatera 检测法检测到的 ctDNA 阳性是DFS的不良预后因素;不过,如果PD-L1表达量大于或等于 1%,无论 ctDNA 状态如何,阿替利珠单抗都能带来DFS的获益 。有几个因素可能影响了本研究的灵敏度。在这个队列中,血浆评估的时间点和频率各不相同,从最后一次 ctDNA 检测到随访结束/临床检测到复发的时间间隔也各不相同。与之前的研究相比(本研究中位随访期为 54 个月,而之前的研究为 16 - 36 个月 ),本研究更长的随访期能够捕捉到较晚出现的复发情况。最后,肿瘤向血液中释放 ctDNA 不仅受到肿瘤负荷的影响,还受到肿瘤生物学特性(基因组亚型、增殖和细胞更新率)以及复发的解剖位置的影响。据报道,与鳞状细胞组织学类型的非小细胞肺癌患者相比,腺癌组织学类型的非小细胞肺癌患者的 ctDNA 释放和检测率较低,孤立性局部复发的病例以及受血脑屏障影响的仅中枢神经系统复发的病例也是如此。
本研究结果表明,ctDNA 的存在强烈提示疾病复发,并体现了纵向检测的价值;然而,在能够根据 ctDNA指导做出关于辅助全身治疗个性化的决策之前,还需要进行更多具有明确样本采集时间表和指标的研究。此外,作为局限性之一,应该注意到本研究是在围手术期免疫检查点抑制剂(ICI)或酪氨酸激酶抑制剂(TKI)应用时代之前进行的。因此,在涉及接受围手术期 ICI 或 TKI 治疗的患者这一领域,进一步的数据对于满足当前早期阶段的治疗标准至关重要。尽管如此,本研究数据对于分析接受围手术期 ICI 或 TKI 治疗的非小细胞肺癌患者 MRD 状态的研究而言,仍可作为历史对照数据发挥作用。虽然研究者通过系列检测观察到对于中枢神经系统以外的远处复发的灵敏度为 93%(13/14),但在这种癌症类型中观察到的较低的 ctDNA 释放率反映了其独特的生物学特性,再加上频繁出现的局部复发和仅中枢神经系统复发的情况,使得仅基于一次抽血来做出辅助治疗决策变得更加复杂。随着技术的不断发展,新的方法将有助于进一步完善患者的风险分层并指导辅助治疗决策,包括使用通过全基因组测序确定的更多基因突变的tumor-informed方法 ,此外,纳入其他液体数据,如游离 RNA 或肿瘤诱导血小板 ,或者采用多组学方法 ,可能是在不久的将来提高灵敏度的解决办法。
在纵向分析中,13 名患者的 ctDNA 阳性比影像学检测到的复发提前了中位时间 3.2 个月。目前尚不清楚对于分子复发更早开始治疗是否会改善预后。在一项比较吉非替尼与含铂双药化疗治疗伴有EGFR突变的非小细胞肺癌患者的 III 期研究(WJTOG3405)的探索性分析中,术后复发的患者(N = 74)与 IIB 至 IV 期的患者(N = 101)相比,生存时间显著更长(中位 44.5 个月对27.5 个月),风险比为 0.43(p = 0.0014),尽管两组患者均有转移性疾病。这可能归因于术后复发患者的肿瘤负荷低于那些确诊为转移性疾病的患者 。因此,更早地检测术后复发并进行早期干预有可能改善生存预后。正在进行的前瞻性研究,例如针对 T1-2N0M0 期非小细胞肺癌或 T3/T4 多灶性非小细胞肺癌患者的 ctDNA 肺癌随机对照试验(NCT04966663),可能会揭示在完全手术切除前后血浆中可检测到 ctDNA 的患者接受治疗的益处。
总之,这项对患者进行的长期随访分析报告称,在标志性分析和纵向监测分析中 ctDNA 呈阳性的所有患者均出现了疾病复发,且预后明显更差。本研究还报告了系列 ctDNA 监测相较于单一时间点检测在检测术后复发方面的价值。对于这些患者而言,无论是在术后阶段,还是在基于分子复发的监测阶段,利用ctDNA来强化辅助治疗都是一个极具吸引力的契机。有必要进一步开展研究,探索在辅助治疗和监测阶段利用 ctDNA 指导非小细胞肺癌全身治疗的方法。
参考文献:
Ohara S, Suda K, Sudhaman S, Hamada A, Chiba M, Shimoji M, Takemoto T, Kalashnikova E, Cheung SK, Krainock M, Feeney J, Sethi H, Liu MC, Soh J, Tsutani Y, Mitsudomi T. Clinical Significance of Perioperative Minimal Residual Disease Detected by Circulating Tumor DNA in Patients With Lung Cancer With a Long Follow-up Data: An Exploratory Study. JTO Clin Res Rep. 2024 Nov 12;6(3):100762. doi: 10.1016/j.jtocrr.2024.100762. PMID: 39990137; PMCID: PMC11847260.


本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#非小细胞肺癌# #ctDNA#
5