【麻海新知】阿片类药物用于治疗和未治疗的阻塞性睡眠呼吸暂停:成年志愿者中瑞芬太尼的药代动力学和药效学
2025-03-28 古麻今醉网 古麻今醉网 发表于陕西省
本文通过一项前瞻性临床队列研究,探讨OSA患者对阿片类药物的反应敏感性是否高于无OSA 患者,并评估持续气道正压通气或双水平气道正压通气治疗,是否会影响OSA患者对阿片类药物的反应敏感性。
仅在美国,每年就有约200万诊断为“阻塞性睡眠呼吸暂停(OSA)”的患者接受手术。相关围手术期临床指南指出,OSA患者使用阿片类药物发生呼吸抑制的风险增加。但这一结论的证据有限且相关研究质量较低,主要依据专家意见;同时使用阿片类药物是否会加重OSA也不清楚;OSA的治疗,如持续气道正压通气(CPAP)或双水平气道正压通气(BIPAP)等,对阿片类药物所致呼吸抑制风险的影响也并未明确。由于缺乏高质量的证据来指导OSA 患者合理使用阿片类药物, 医务人员可能会考虑避免呼吸抑制的风险而牺牲充分的镇痛管理。
本文通过一项前瞻性临床队列研究,探讨OSA患者对阿片类药物的反应敏感性是否高于无OSA 患者,并评估持续气道正压通气(CPAP)或双水平气道正压通气(BIPAP)治疗,是否会影响OSA患者对阿片类药物的反应敏感性。结果发表在2025年3月的BJA杂志。

一、具体研究方法
设计:前瞻性、单中心、开放标签队列研究。
本研究的目的是确定OSA是否改变了瑞芬太尼的药物代谢(PK,生物相药物浓度—时间过程)或药效学(PD,浓度—效应关系)。通过将受试者分为三组:无OSA、未治疗OSA、已治疗OSA,靶控阶梯泵注瑞芬太尼,检测血浆瑞芬太尼浓度和测量相对应药物直接效应指标(缩瞳、热镇痛、呼吸抑制)。如果OSA影响瑞芬太尼PK以增加药物敏感性,则预期研究结果将是清除率或分布容积降低。如果OSA增加了瑞芬太尼的PD,则预期结果将是更小的EC 50(半数最大效应药物浓度)或更大的阿片类缩瞳Emax(最大药物效应),更大的热疼痛耐受性斜率和曲率/陡度(温度与药物浓度),以及OSA受试者呼吸抑制的更大斜率(呼气末CO2与药物浓度)。如果OSA治疗逆转了OSA受试者的敏感性,预期的结果是这些变化将正常化。
研究人群:74名成年志愿者分为三组:无OSA(20人)、未治疗OSA(33人)、已治疗OSA(21人)。
干预方法:靶控阶梯泵注瑞芬太尼(0、0.5、1、2、3、4 ng/ml),在基线(输注前)和每次阶梯剂量输注改变前8 min,测量瞳孔面积(miosis)、前臂掌侧热痛耐受度(热镇痛)和呼气末CO2(呼吸抑制)等直接效应指标。在给药前、每次剂量递增后约15 min以及瑞芬太尼输注完成后0、2、5、10、15、30、60和90 min采集静脉血,用于定量检测血浆瑞芬太尼浓度。
测量瞳孔面积通过安装在遮光护目镜中的暗适应瞳孔计以100 Hz采样。为使受试者舒适,在瑞芬太尼输注停止后立即取下护目镜。瞳孔面积的变化以基线面积的分数表示。通过热刺激评价镇痛水平。使用计算机控制的Peltier型热刺激器施加于前臂掌侧,温度逐渐升⾼直⾄受试者⽆法耐受时记录温度,测量三次,结果取三个温度的平均值。在稳定通气期间,使用鼻唇联合导管和Capnostream 20床旁监护仪测量呼气末CO2。
分析方法:
基于群体药代动力学(PopPK)和药效学(PopPD)模型,评估OSA对瑞芬太尼PK/PD参数的影响,并评估了患者特定协变量(年龄、性别、体重、瘦体重、去脂体重、体重指数)对于参数的影响。
首先建立群体药代动力学(PopPK)基础模型,并探索二室和三室模型,旨在描述瑞芬太尼血浆浓度与时间之间的关系;然后分别建立了瞳孔面积、热镇痛和呼气末CO2的群体药效学(PopPD)基础模型,描述瑞芬太尼浓度与效应(即瞳孔面积、镇痛、呼气末CO2)之间的关系。由于瑞芬太尼代谢快,效应测量使用直接效应模型,在预测效应位点(中枢神经系统)的药物浓度达到平衡的时间段测量药物效应。
进一步评估了患者特异性对PK和PD模型参数的影响,连续协变量包括年龄、体重、瘦体重、去脂体重和体重指数,分类协变量包括分组和性别。作为药效学分析的一部分,还额外探讨了基线血清碳酸氢盐和呼吸暂停低通气指数的影响。纳入上述协变量检验后,确定了最终的PopPK和PopPD模型,并使用非参数自举法评价模型的参数精度,生成参数估计值的95%置信区间。
利用PopPK模型,个体化生成了清除率(CL)和稳态分布容积(Vss)估计值。利用PopPD模型,预测每个个体在瑞芬太尼血浆浓度为4 ng/ml时的特异性预测效应值(瞳孔面积、热镇痛、呼气末CO2)。采用KruskaleWallis检验,评价OSA组之间每个个体的PK效应预测值和效应测量值的差异。P<0.05时具有统计学意义。
二、关键结果
1、受试者基本情况
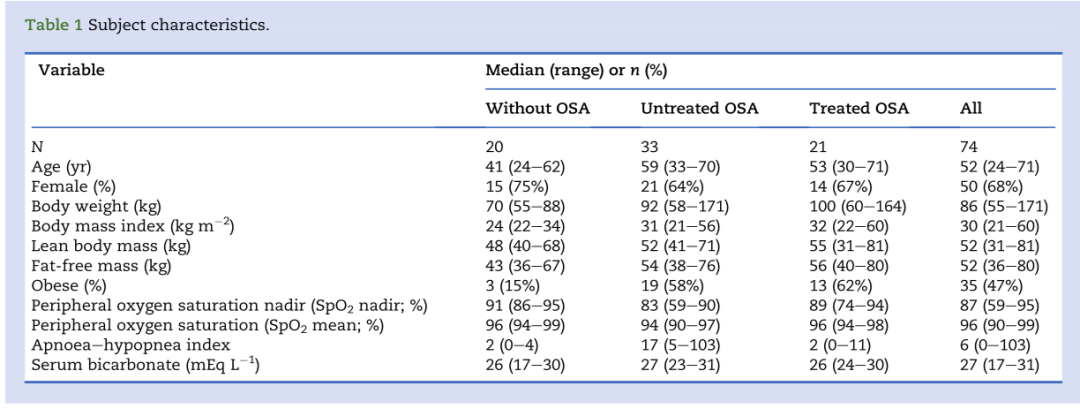
包括74名受试者参与实验,中位年龄52岁(范围24 - 71岁)。其中一名受试者因不适要求取下瞳孔计护目镜,因此瞳孔缩小分析纳入了73名受试者(表1)。
表1:受试者基本情况
2、药代动力学(PK)研究
在0.5、1、2、3和4 ng/ml效应部位靶浓度输注时,中位血浆浓度为0.4、0.9、1.7、2.7和3.9ng/ml。血浆与效应部位靶浓度差异为-18%、-9%、-13%、-10%、-3%,绝对差值预测误差中位数分别为24%、21%、22%、21%、21%。
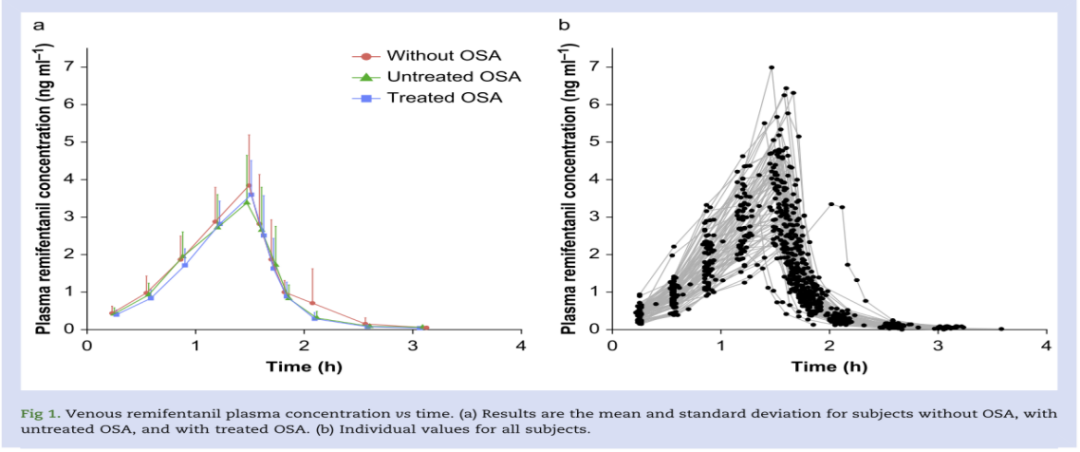
图1:瑞芬太尼药代动力学瑞芬太尼输注期间和输注后的瑞芬太尼静脉血药浓度。中位数见图1a,个体受试者浓度见图1b。
具有线性清除率的二室结构模型与测得的数据拟合较好,三房室模型估计的Vss不精确(估计的Vss >1000L)。瑞芬太尼的药代动力学采用二室模型描述(表2),清除率(CL):无OSA组(147 L/h)、未治疗OSA组(143 L/h)、已治疗OSA组(155 L/h),无统计学差异(P=0.472)。分布容积(Vss):各组间无显著差异(P=0.473)。
表2:静脉注射瑞芬太尼群体药代动力学模型的参数估计值

在纳入校正的协变量(年龄、体重、瘦体重、去脂体重、BMI和性别、OSA分组)中,总体重对清除率(CL)和中央室分布容积(V1)有影响,是药代动力学模型的协变量。除体重外,最终群体药代模型还包含CL和V1随机效应之间的协方差项。将体重标准化后比较不同组间药代动力学模型,药代动力学参数在肥胖比例较高的OSA组中较低(非线性关系)。
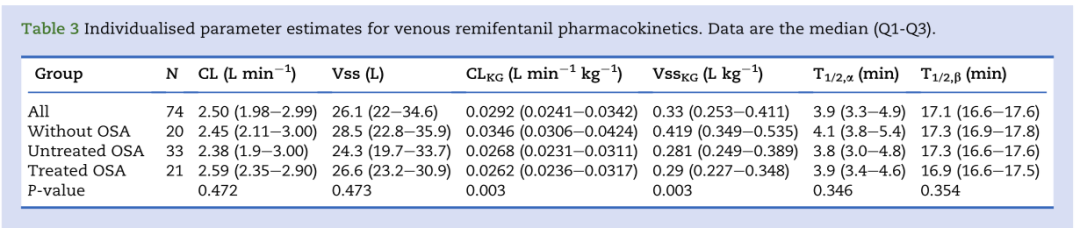
无OSA、未接受治疗的OSA或接受治疗的OSA受试者的PK参数在CL(P=0.472)和Vss(P=0.473)方面无统计学差异(表3)。各组间瑞芬太尼分布或消除半衰期(分别为T1/2α和T1/2β)也无差异。
表3:静脉注射瑞芬太尼药代动力学的特异性参数估计值比较
3、药效学(PD)研究
分别针对瞳孔直径、热耐受阈值和呼气末CO2建立了血浆浓度—效应的PD模型(图2)。瑞芬太尼浓度依赖性瞳孔缩小(瞳孔面积减少)、镇痛(热耐受阈值)和呼吸抑制(呼气末CO2增加)是显而易见的(图3)。主要PD结局是OSA(未治疗或治疗)对PD模型参数的影响,主要包括瞳孔直径与药物浓度关系中的Emax和EC50、热耐受温度与药物浓度关系中的斜率和曲率/陡度(热疼痛耐受性)以及呼气末CO2 与药物浓度关系中的斜率(呼吸抑制)。
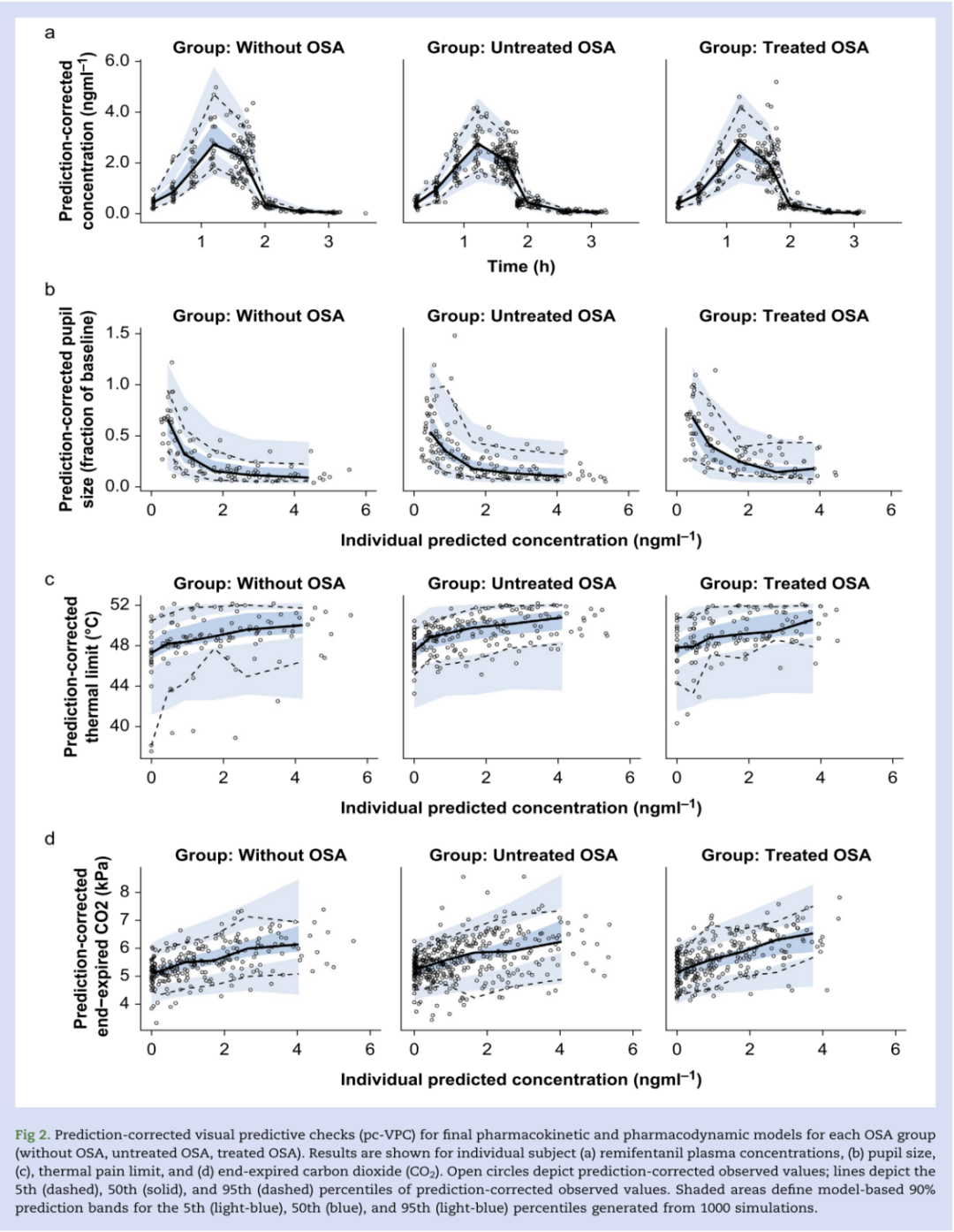
图2:各组药代、药效模型的预测值与实际观测值。a是血药浓度;b是瞳孔大小;c是热痛耐受度;d是呼气末CO2。的空心圆是每个个体的测量值,上虚线为实际测量值的5%分位数,实线为为实际测量值的50%分位数,下虚线为实际测量值的90%分位数。阴影部分为预测值的90%区间,上浅蓝为预测值的5%分位数,深蓝为预测值的50%分位数,下浅蓝为预测值的95%分位数。
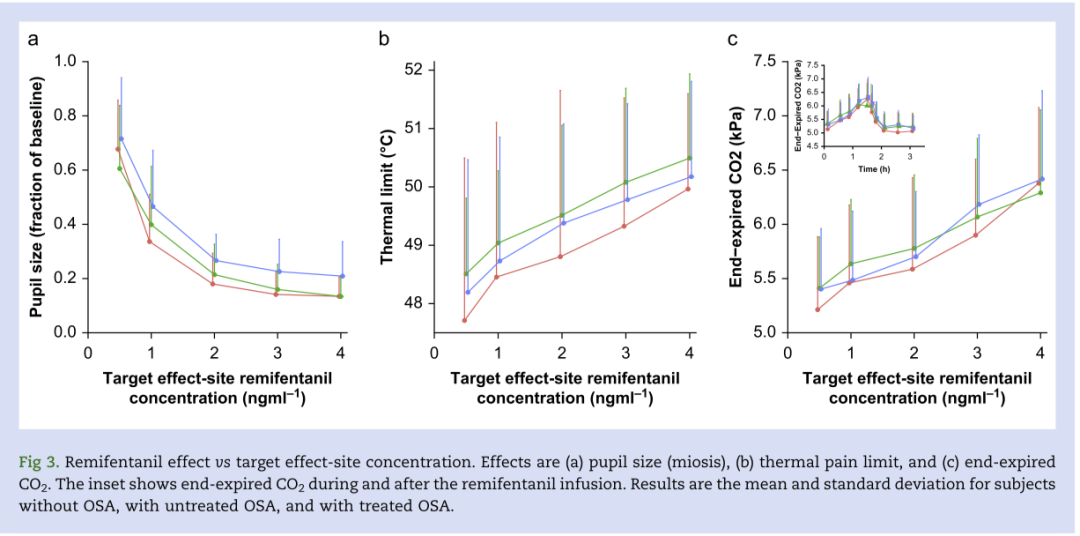
图3:药物效应与药物靶浓度之间的关系。a瞳孔缩小;b热痛耐受度;c呼气末CO2
瞳孔缩小
S形最大效应(即Emax)模型可恰当描述瞳孔面积(以基线分数表示)与瑞芬太尼血浆浓度之间的关系。模型无任何协变量影响(最终模型OFV=-1371)。三组间EC50和Emax无显著差异(P=0.973)。在血浆瑞芬太尼浓度为4 ng/ml时,无OSA、未治疗的OSA和治疗的OSA模型得到的瞳孔面积(基线分数)分别为12%、13%和17%(P <0.086;图4a)。
热痛耐受度
最终镇痛PopPD模型描述了瑞芬太尼血浆浓度与热耐受性之间的关系(最终模型OFV=379),模型参数估计值见表4。无OSA、未治疗OSA和治疗OSA的参与者的PD参数在温度耐受性与药物浓度的斜率方面没有统计学差异。在血浆瑞芬太尼浓度为4 ng/ml时,模型估计的无OSA、未治疗OSA和治疗OSA的参与者的热耐受性分别为49.9℃,50.9℃、50.8℃(P=0.208;图4 b)。
呼气末CO2
最终呼气末CO2 PopPD模型的模型参数估计值见表4,描述了瑞芬太尼血浆浓度与呼气末CO2之间的关系。血清碳酸氢盐(基线)为模型的协变量。无OSA、未治疗OSA和治疗OSA的参与者的PD参数在呼气末CO2与药物浓度的斜率方面无统计学差异。在血浆瑞芬太尼浓度为4 ng/ml时,无OSA、未治疗OSA和治疗OSA的受试者的中位模型估计呼气末CO2分别为6.3、6.4和6.7 kPa。
表4:最终的药物效应模型的参数
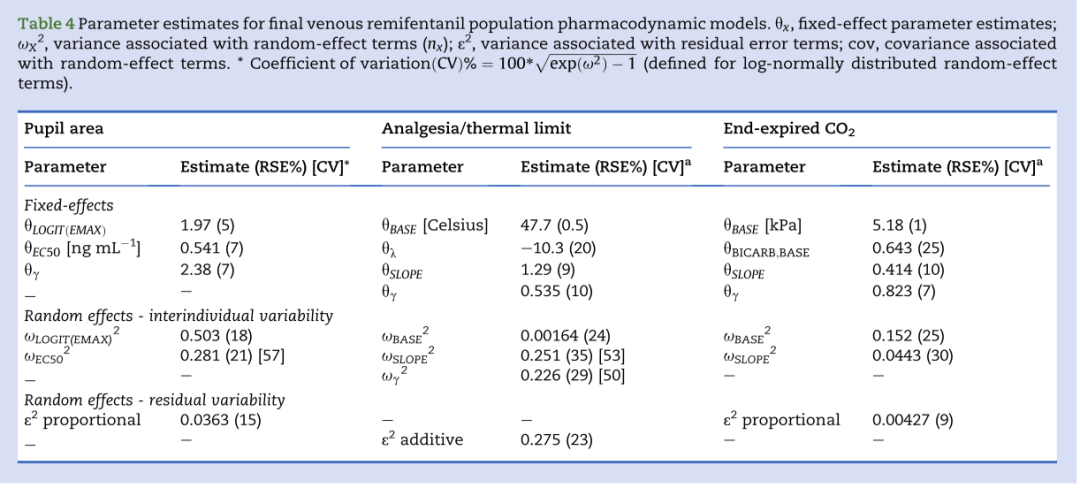
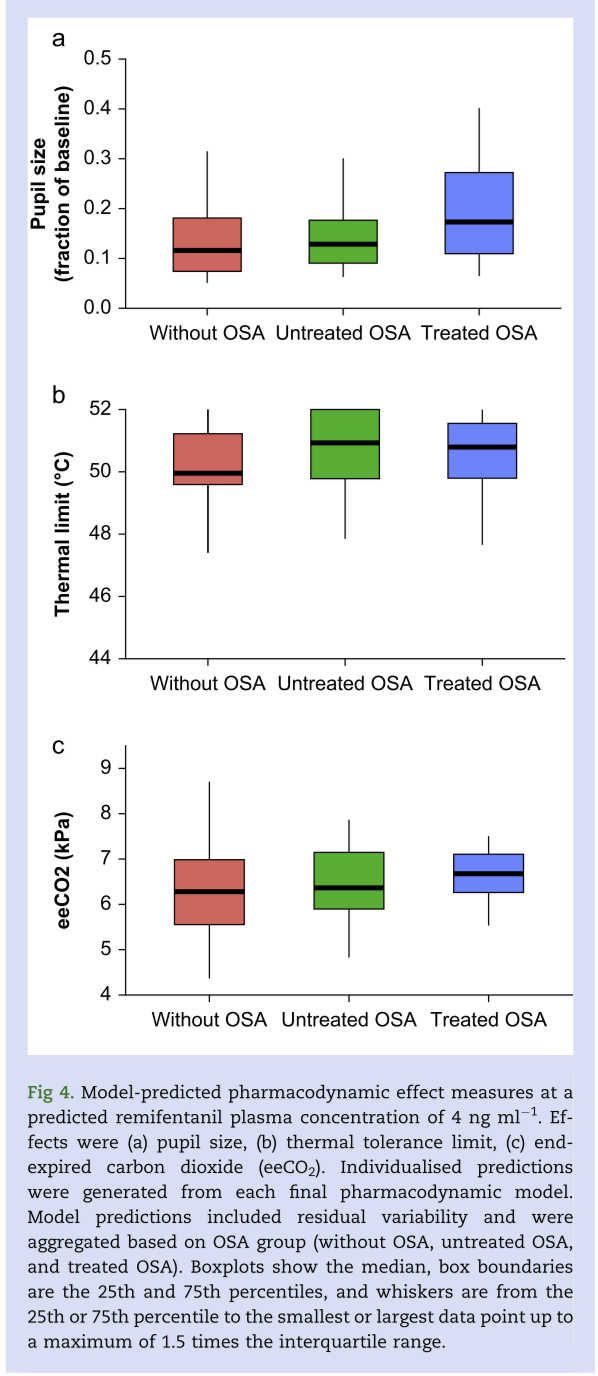
图4:血浆瑞芬太尼浓度为4 ng/ml时模型预测从效应指标
三、结论
OSA(无论是否治疗)不影响瑞芬太尼的PK或PD(呼吸抑制、镇痛、瞳孔缩小)。
本文的研究结果显示无OSA的人群、未经治疗的以及接受治疗的OSA人群的药代动力学参数(清除率、分布容积)和药效学指标(瞳孔缩小、热耐受能力、呼气末二氧化碳)均未有明显差异。
麻海新知·述评
相关围手术期临床指南指出,OSA患者使用阿片类药物发生呼吸抑制的风险增加,本研究结果对这个传统观念提出了挑战。作者认为OSA成年患者在清醒状态下对阿片类药物的反应敏感性并不高于无OSA 成年患者,患者是否合并OSA不会改变其对阿片类药物的敏感性。因此在药代动力学或药效学方面可能无需调整阿片类药物的剂量,避免因限制阿片药物使用而导致镇痛不足的风险。此外,该研究结果也表明OSA的治疗(CPAP或BIPAP)不会显著改变瑞芬太尼的药代动力学或药效学,未经治疗或已治疗的阻塞性睡眠呼吸暂停(OSA)均未影响瑞芬太尼的药代动力学或药效学(瞳孔缩小、镇痛、呼吸抑制)。
但该研究还存在一些局限性:1、研究在清醒状态下进行,未覆盖睡眠状态;2、本研究瑞芬太尼浓度范围有限(0.5–4 ng/ml);麻醉诱导等对血药浓度要求更高,瑞芬太尼可能导致剂量依赖性的呼吸抑制;3、样本量较小(74人)。
最后,本研究的结论还有值得探讨的地方。本研究结果在校正体重后,肥胖患者瑞芬的清除率和分布容积显著降低,作者认为瑞芬太尼的分布和清除可能更多地依赖于瘦体重,脂肪组织对瑞芬太尼的分布和清除贡献较小。许多阻塞性睡眠呼吸暂停(OSA)患者还伴有肥胖症,作者认为对于肥胖患者,基于总体重的瑞芬太尼剂量可能导致过量,应根据瘦体重或理想体重调整瑞芬太尼剂量,以实现安全有效的治疗。但本研究按照总体重给药,药效学方面没有差异,如果根据根据瘦体重或理想体重调整瑞芬太尼剂量是否导致镇痛效果不足也值得进一步探讨。
另一方面,芬太尼是脂溶性药物,容易在脂肪中蓄积,本研究结果提示的脂肪组织对瑞芬太尼的分布和清除贡献较小,并不能简单的推广到所有阿片类药物。同时有观点认为肥胖患者的瑞芬太尼的分布容积可能增加,但清除率相对不变,这也与我们对于阿片药物的认知是一致的。以往有研究显示瑞芬代谢呈现三室模型,本研究采用二室模型描述药代动力学,作者认为瑞芬太尼的分布和消除过程相对简单,二室模型已足以准确预测其血药浓度变化,同时使用三室模型估计的Vss不精确(估计的Vss >1000 L)。作者分析原因可能与采样时间不一致有关。本研究在输注后90分钟采样,而认为瑞芬代谢为三室模型的研究是在输注后 240 分钟采样。因此,采样时间偏短,同时瑞芬太尼泵注浓度偏小是否是造成瑞芬太尼药代动力学结论与以往研究不一致的原因也值得进一步探讨。
原始文献:
Anil R Maharaj, Michael C Montana, Christoph P Hornik, Evan D Kharasch. Opioid use in treated and untreated obstructive sleep apnoea: remifentanil pharmacokinetics and pharmacodynamics in adult volunteers. Br J Anaesth. 2025 Mar;134(3):681-692. Doi: 10.1016/j.bja.2024.10.042.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















阿片类药物治疗阻塞性睡眠呼吸暂停
4
#阻塞性睡眠呼吸暂停# #阿片类药物#
7