Translational Psychiatry:多组学视角揭示精神障碍相关基因通路在炎症性肠病发病机制中的作用
昨天 xiongjy MedSci原创 发表于陕西省
四个关键基因及其下游通路中,QDPR和HP与IBD风险增加相关,而DBI和MAX则对UC具有保护作用。这些发现为未来肠-脑轴疾病的干预和治疗提供了潜在的靶点。
炎症性肠病(IBD)是一组主要影响胃肠道的慢性系统性炎症性疾病,包括克罗恩病(CD)和溃疡性结肠炎(UC)两种临床亚型。近年来,精神障碍(如重度抑郁症、焦虑症、自闭症谱系障碍和精神分裂症)与IBD之间的共病关系引起了广泛关注。尽管流行病学研究和孟德尔随机化(MR)分析已经揭示了精神障碍与IBD发病之间的关联,但其遗传病理机制仍未完全阐明。本研究通过整合多组学数据,利用基于摘要数据的孟德尔随机化(SMR)和共定位分析,探讨了精神障碍相关基因的甲基化、表达和蛋白质水平与IBD风险之间的因果关系及其共享的因果遗传变异。

研究首先从GeneCards数据库中筛选出与六种主要精神障碍(重度抑郁症、双相情感障碍、精神分裂症、自闭症谱系障碍、注意力缺陷多动障碍和焦虑症)相关的基因,共获得4516个候选基因。随后,利用来自欧洲人群的甲基化定量性状位点(mQTL)、表达定量性状位点(eQTL)和蛋白质定量性状位点(pQTL)数据,结合IBD的全基因组关联研究(GWAS)摘要数据,进行了SMR和共定位分析。研究还通过英国生物银行(UK Biobank)和芬兰基因组研究(FinnGen)的数据进行了验证,并在GTEx数据库中对肠道组织中的基因表达进行了验证。
研究结果显示,QDPR、DBI、MAX和HP四个基因在IBD及其亚型的发病机制中起到了关键作用。QDPR基因的甲基化(cg08808571和cg26689483)与表达呈负相关,表明其在UC中的有害作用。DBI基因的甲基化(cg11066750)通过增强基因表达对UC具有保护作用。DBI和MAX编码的蛋白质水平与UC风险呈负相关,而QDPR和HP的蛋白质水平则与UC和IBD风险呈正相关。特别是在UC中,DBI和MAX的蛋白质水平分别降低了21%和26%的风险,而QDPR的蛋白质水平增加了17%的风险。HP基因的低甲基化(cg04162276和cg23815491)和高表达与IBD风险增加相关,且HP蛋白质水平与IBD风险呈正相关。
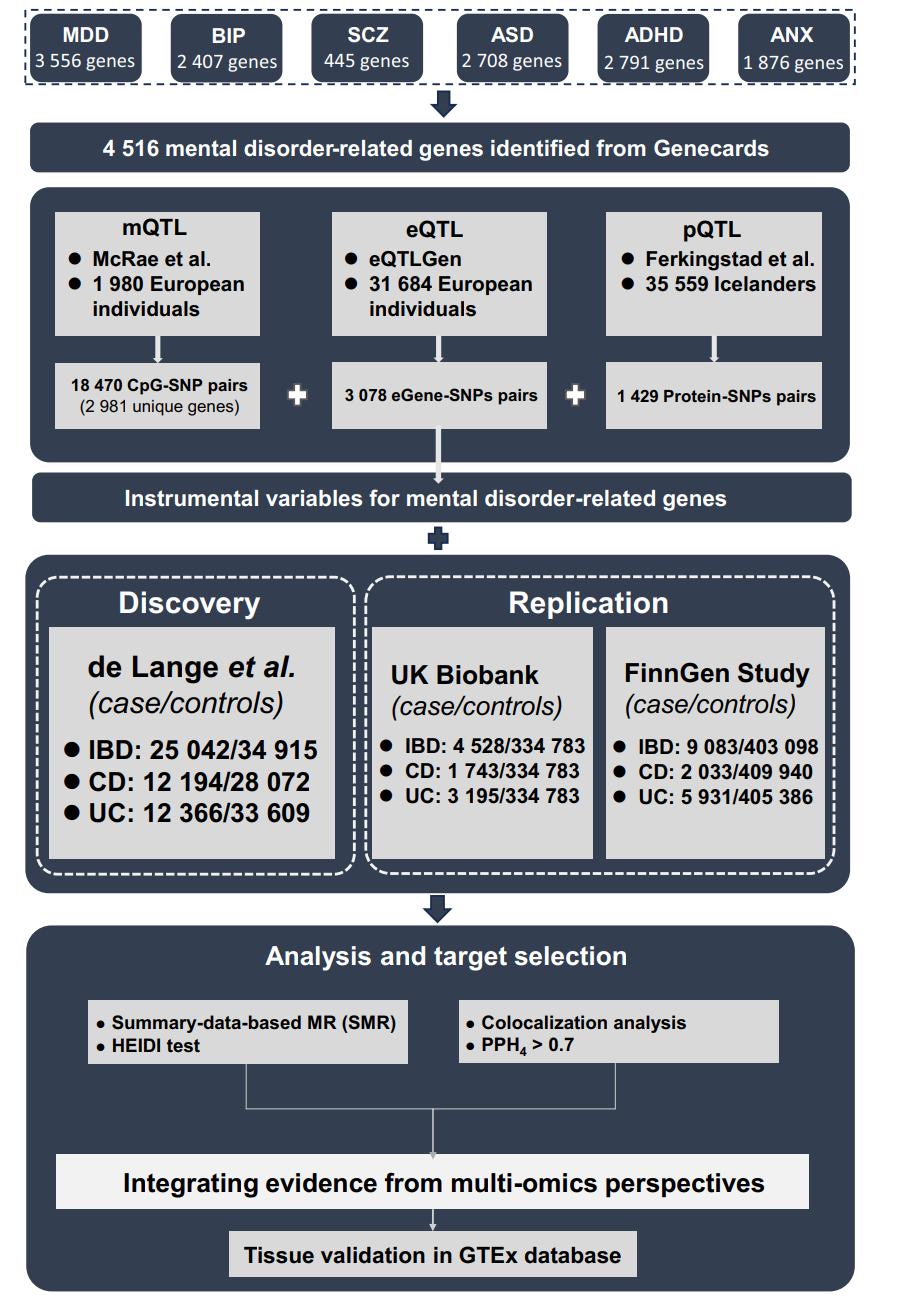
图1:研究设计流程图
QDPR基因编码的二氢蝶呤还原酶(DHPR)在神经递质(如多巴胺和血清素)的合成中起关键作用,其与UC的关联尚不明确,但研究表明QDPR在UC的发病机制中具有重要作用。DBI基因编码的酰基辅酶A结合蛋白(ACBP)与焦虑症和自闭症谱系障碍相关,研究显示DBI通过调节自噬在UC中发挥保护作用。HP基因编码的触珠蛋白(Haptoglobin)及其相关蛋白Zonulin通过调节肠道通透性在IBD的发病机制中起重要作用。MAX基因编码的Myc相关因子X在细胞增殖、分化和凋亡中起关键作用,研究表明MAX通过调节免疫反应在UC中发挥保护作用。
本研究的优势在于整合了mQTL、eQTL和pQTL的多组学证据,显著增强了结论的可靠性,并揭示了可能的生物学通路。此外,MR设计和共定位分析的使用减少了混杂、反向因果关系和连锁不平衡带来的偏差,有助于识别因果关联和因果变异。然而,研究也存在一些局限性,例如仅分析了六种主要精神障碍相关的基因,可能忽略了其他与肠-脑轴相关的关键基因。此外,pQTL数据集中精神障碍相关蛋白质的数量有限,部分基因无法在蛋白质水平上进行验证。研究的发现主要基于欧洲人群,可能限制了其在不同种族中的普适性。
总之,本研究通过多组学视角揭示了精神障碍相关基因在IBD发病机制中的作用,识别了QDPR、DBI、MAX和HP四个关键基因及其下游通路,表明它们在IBD和UC的易感性中起重要作用。这些发现为未来肠-脑轴疾病的干预和治疗提供了潜在的靶点。
原始出处:

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#炎症性肠病# #精神障碍# #孟德尔随机# #肠-脑轴#
6