南洋理工赵彦利JACS:基于第二近红外窗口响应性金属-有机框架的光敏剂可通过协同铁死亡和STING激活用于肿瘤免疫治疗
2025-01-31 BioMed科技 BioMed科技 发表于陕西省
光动力疗法(PDT)有望用于癌症治疗,为解决肿瘤微环境缺氧阻碍其疗效的问题,南洋理工大学赵彦利等开发纳米平台 Fe - THBQ/SR,结合多种机制协同增强治疗效果,相关成果发表于 JACS。
光动力疗法(PDT)有望成为癌症的一种治疗方式,因为它具有提高治疗精度和安全性的潜力。为了增强深层组织渗透并最大限度地减少组织吸附和光毒性,开发由第二近红外窗口(NIR-II)光激活的光敏剂显示出巨大的潜力。然而,PDT的疗效往往受到肿瘤微环境缺氧的阻碍,而这主要是由不规则的肿瘤血管系统引起的。
以免疫激活而闻名的干扰素基因刺激物(STING)途径与血管系统正常化有关。有鉴于此,南洋理工大学赵彦利教授和太原市中心医院Xuping Niu等人通过将STING激动剂(SR-717)负载到铁-四羟基-1,4-苯醌(Fe-THBQ)金属-有机框架中,开发了一种纳米平台(Fe-THBQ/SR)。Fe-THBQ被证明是一种有效的NIR-II光敏剂,可在1064 nm激光照射下产生大量活性氧(ROS)。这些ROS下调了热休克蛋白的表达,从而促进了轻度光热治疗(轻度PTT),并通过消耗谷胱甘肽(GSH)/谷胱甘肽过氧化物酶4促进了铁死亡。此外,Fe-THBQ/SR在GSH刺激下释放SR-717,与ROS介导的双链DNA泄漏协同作用,增强STING激活。这一过程有助于肿瘤血管系统正常化和缺氧缓解,从而增强PDT的疗效。总体而言,作者提出了一种用于NIR-II PDT和NIR-II轻度PTT的多功能单激光触发纳米平台(Fe-THBQ/SR),并将其与STING的有效激活同时结合,形成一个增强循环过程。这些协同增强提高了肿瘤细胞的免疫原性,重塑了免疫抑制肿瘤微环境,增加了T淋巴细胞浸润,改善了治疗结果。相关工作以“A Second Near-Infrared Window-Responsive Metal–Organic-Framework-Based Photosensitizer for Tumor Immunotherapy via Synergistic Ferroptosis and STING Activation”为题发表在JACS。

【文章要点】
作者开发了一种负载SR-717(一种STING激动剂)的铁-四羟基-1,4-苯醌(Fe-THBQ)金属-有机骨架(MOF),Fe-THBQ/SR(图1)。研究发现,适当的能带位置和窄带隙使Fe-THBQs在1064 nm激光照射下热力学上有利于氧气(O2)还原为超氧阴离子(•O2-)。这一事实证明了Fe-THBQ作为NIR-II光敏剂的巨大潜力。而NIR-II PDT产生的ROS破坏了肿瘤细胞的氧化还原平衡,导致线粒体损伤和三磷酸腺苷(ATP)供应减少。ATP产生不足和氧化应激增加则进一步破坏了HSP,从而促进了Fe-THBQ介导的NIR-II轻度PTT。
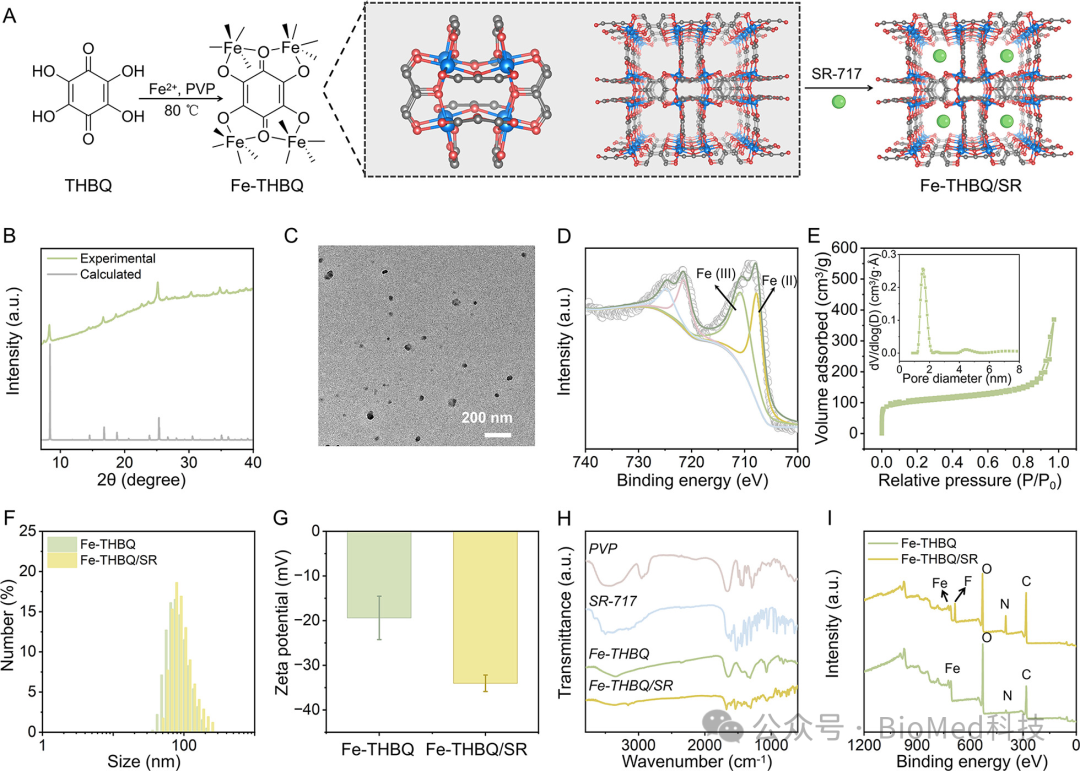
图1 Fe-THBQ/SR
同时,多种ROS的产生和谷胱甘肽(GSH)/谷胱甘肽过氧化物酶4(GPX4)的耗竭诱导了脂质过氧化(LPO),并引发了铁死亡。此外,ROS风暴诱导了肿瘤细胞中与损伤相关的dsDNA的泄漏,这些dsDNA与响应GSH释放的SR-717一起激活了STING通路。此外,这一过程还可使肿瘤血管系统正常化,进一步缓解了TME中的缺氧,并有助于提高PDT效率。总体而言,Fe-THBQ/SR可作为NIR-II PDT和NIR-II轻度PTT的多功能单激光触发纳米平台,有效诱导铁死亡、STING激活和血管正常化(图2)。这些协同过程显著增强了肿瘤细胞的免疫原性,逆转了免疫抑制性TME,并改善了T淋巴细胞浸润,有效增强对肿瘤的抑制作用。
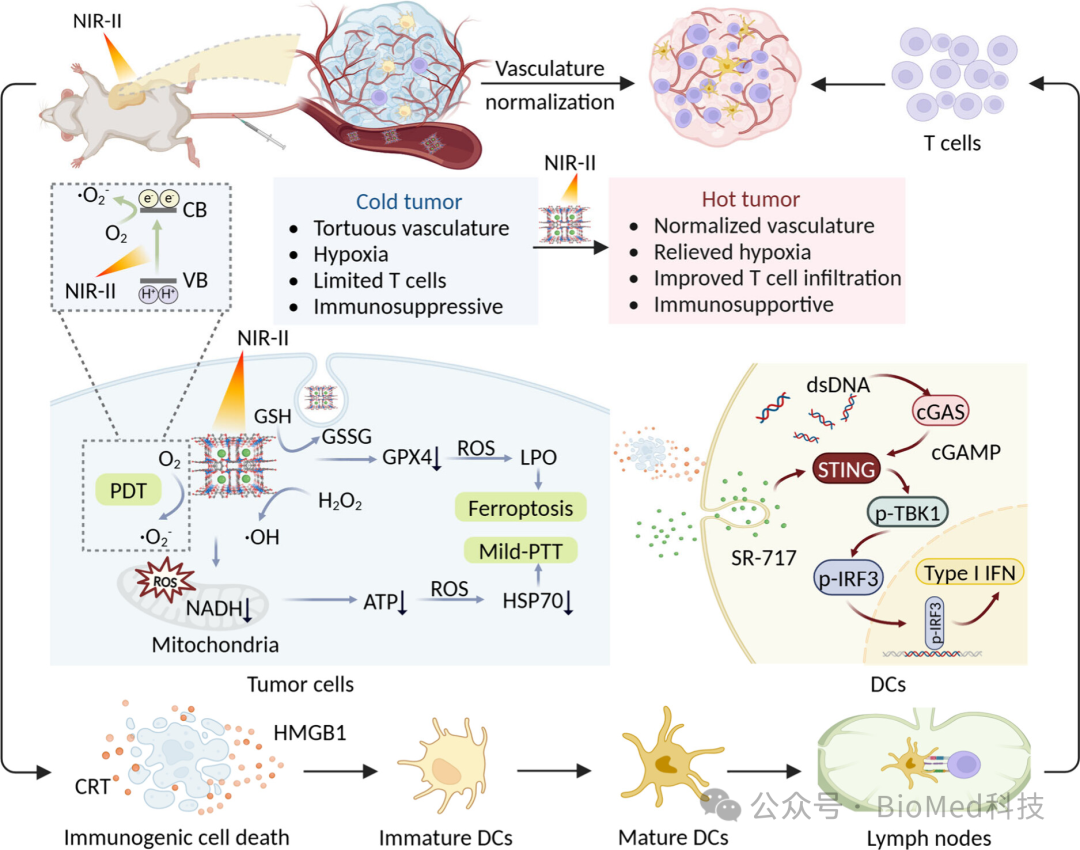
图2 OPC细胞基药物递送系统及其骨疾病治疗机制
原文链接:
https://pubs.acs.org/doi/10.1021/jacs.4c13241?articleRef=control
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















#光动力疗法# #铁死亡#
0