癌症治疗新突破:近红外二区成像引导精准光动力疗法增强肿瘤饥饿治疗的重要突破
2024-06-21 BioMed科技 BioMed科技 发表于上海
研究揭示了一种由NIR-II成像引导的精准光动力疗法(PDT)增强肿瘤饥饿疗法的新策略,为该领域带来了前所未有的突破。
2024年5月,上海十院秦环龙教授和张扬教授团队在顶级学术期刊《Science Bulletin》上发表了一项具有里程碑意义的研究成果,题目为NIR-ll imaging-guided precise photodynamic therapy for augmentingtumor-starvation therapy by glucose metabolism reprogramming interference,揭示了一种由NIR-II成像引导的精准光动力疗法(PDT)增强肿瘤饥饿疗法的新策略,为该领域带来了前所未有的突破。
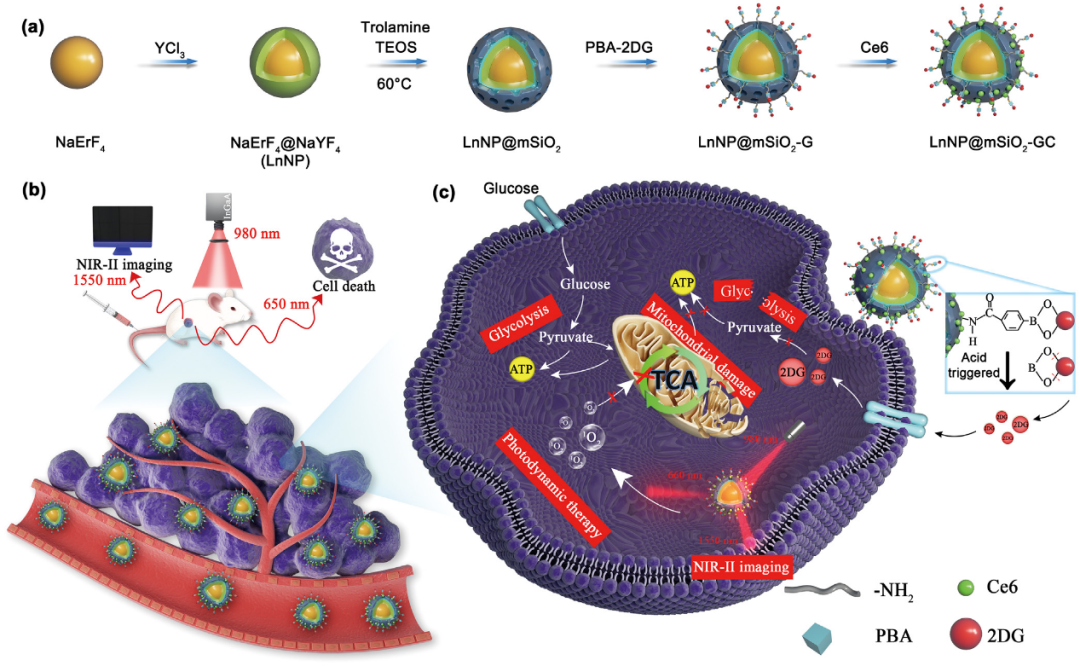
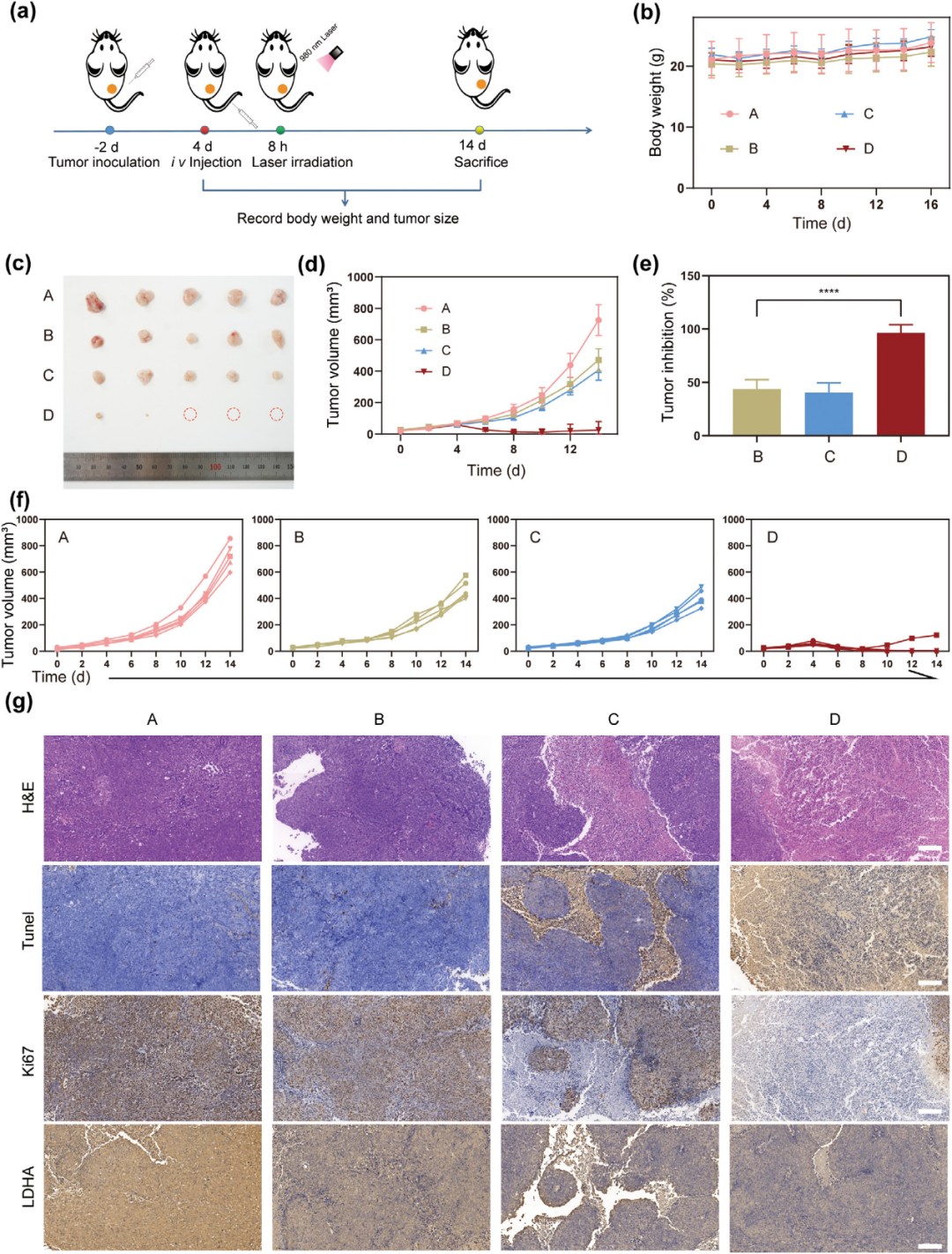
该研究中,该团队开发了一种多功能纳米平台,该平台基于掺杂了镧系元素的纳米颗粒(LnNPs)核心,并结合了多孔硅壳层,用于运载2-脱氧-D-葡萄糖(2DG)和光敏剂二氢卟吩e6(Chlorin e6,Ce6)。这一纳米平台通过2DG抑制糖酵解从而剥夺癌细胞的能量,同时,PDT能够通过产生活性氧(ROS)损害线粒体功能,通过代谢组学和转录组学的实验结果进一步证明,PDT增强肿瘤饥饿疗法有效抑制了肿瘤细胞的代谢重编程。此外,该纳米平台在第二近红外窗口(NIR-II,1000-1700 nm)的荧光成像能力,为肿瘤的精准定位和治疗效果的实时监测提供了前所未有的视角,使得研究者能够实时监测纳米药物在肿瘤中的积累情况,并确定最佳的治疗触发时间,从而实现对肿瘤的精准打击。在体外和体内实验中,这种新型纳米平台都展现出了优异的治疗效果。实验结果表明,经过治疗,LnNP@mSiO2-GC在980 nm激发下,在体内显示出最佳的肿瘤治疗效果,联合治疗方案具有显著优势。此外,该纳米平台还显示出良好的生物相容性和低毒性,为癌症治疗提供了一个安全有效的新选择。
这项研究不仅为癌症治疗提供了新的视角,同时也为临床医学转化提供了有力的科学依据。通过这种创新的纳米平台,我们能够更精准地定位肿瘤并实时监测治疗效果,这将极大地推动个性化医疗的发展。未来,这种技术有望在临床上得到广泛应用,为癌症患者提供更为精确和个性化的治疗方案。随着进一步的研究和临床试验,我们期待这种纳米平台能够成为癌症治疗领域的一个重要里程碑,为患者带来更大的生存希望和康复机会,同时也为临床医学转化开辟新的道路。
在癌症治疗领域取得的这一突破性进展,不仅标志着秦环龙教授和张扬教授团队在精准医疗技术方面的卓越成就,也展现了该团队在跨学科研究中的创新精神和深远视野。基于在跨学科研究的夯实基础和独特见解,该团队在肠道微生态与肠道疾病治疗领域同样取得了突破性进展。近三年中,秦环龙教授和张扬教授团队首次提出通过破坏菌瘤共生关系抑制肿瘤生长的学术构想,相关成果发表在Signal Transduction and Targeted Therapy、ACS nano等国际顶级期刊,这为利用破坏菌瘤共生关系阻断肿瘤内病原体与肿瘤相互作用进行抗肿瘤治疗提供了一个可行的范式。同时,该团队创造性地提出纳米工程菌的概念,开发了以活菌为载体的口服递送系统,实现了延长药物在肠道的停留时间,进一步缓解肠道炎症和菌群失衡,相关成果发表在Nano Today。这代表了纳米医学与微生物学交叉融合的新方向,为治疗慢性肠道疾病提供了全新的策略和希望。随着进一步的研究和开发,这一突破性成果有望引领肠道健康管理的新潮流,为人类健康事业贡献出革命性的力量。研究团队在未来将会继续深入探索纳米技术和微生物功能化在肿瘤和炎症性肠病治疗中的实际应用,进一步着力于临床研究和功能化益生菌的产业化,期望临床研究能够进一步证明以上科研成果的科学价值和临床实用性。
原文链接:
https://linkinghub.elsevier.com/retrieve/pii/S209592732400077X
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















#光动力疗法# #肿瘤饥饿疗法#
47