四川大学最新JACS:协同超声可激活人工酶和精确基因治疗抑制氧化还原稳态和恶性表型以对抗肝细胞癌
2024-12-30 BioMed科技 BioMed科技 发表于陕西省
研究结果表明, US协同的P-Por-Os显示出优越、多方面和可控的ROS生成活性。该系统不仅可颠覆HCC细胞内的氧化还原平衡,而且可在非常低的浓度下实现精确和可控的肿瘤消融。
肝细胞癌(HCC)仍然是最致命的恶性肿瘤之一。具有协同作用的治疗HCC的多模式疗法引起了越来越多的关注,例如,设计可仿酶和超声(US)激活产生活性氧(ROS)的生物相容性卟啉基纳米药物。
有鉴于此,四川大学程冲教授、Tian Lan和吴泓教授等人提出了一种π共轭、锇(Os)配位的聚卟啉(P-Por-Os)纳米囊泡,其可作为超声激活的人工酶,用于协同治疗以抑制氧化还原稳态和恶性表型,从而对抗HCC。研究结果表明, US协同的P-Por-Os显示出优越、多方面和可控的ROS生成活性。该系统不仅可颠覆HCC细胞内的氧化还原平衡,而且可在非常低的浓度下实现精确和可控的肿瘤消融。在肝脏原位模型中,US不仅激活了人工酶以催化ROS,而且通过精确的US定位促进HCC的远程消融。此外,P-Por-Os+US可以通过敲除ROS抗性因子MT2A并下调其下游癌基因IGFBP2来帮助精确的基因治疗,从而有效地减弱HCC的ROS抗性、增殖和迁移。该研究认为,这种可超声激活的人工酶的设计为创新杀瘤材料的工程化提供了一条有前景的途径,为HCC治疗提供了一种具有高生物安全性的协同治疗方法。相关工作以“Synergistic Ultrasound-Activable Artificial Enzyme and Precision Gene Therapy to Suppress Redox Homeostasis and Malignant Phenotypes for Controllably Combating Hepatocellular Carcinoma”为题发表在JACS。

【文章要点】
如图1所示,π共轭、锇(Os)配位的聚卟啉(P-Por-Os)纳米囊泡可作为超声激活的人工酶。该研究基于双重动机:首先,P-Por-Os具有高金属性和窄带隙,表现出可超声激活的生物催化特性,能够快速同时提高ROS和氧水平,以增强CDT和SDT。其次, US协同的P-Por-Os能够通过靶向ROS抗性因子金属硫蛋白-2A(MT2A)来加强基因治疗,从而有效抑制HCC的耐药性、增殖和转移潜力。值得注意的是,实验研究和理论计算表明,P-Por-Os+US显示出优越、多方面和可控的ROS生成活性。该系统不仅扰乱了氧化还原平衡,而且以约25μg/mL的极低剂量促进了HCC的精确消融,在细胞和组织水平上都显示出显著的抗肿瘤功效。在肝脏原位模型中,US激活人工酶催化ROS,同时通过空间精确的US定位确保精确靶向和消除HCC。
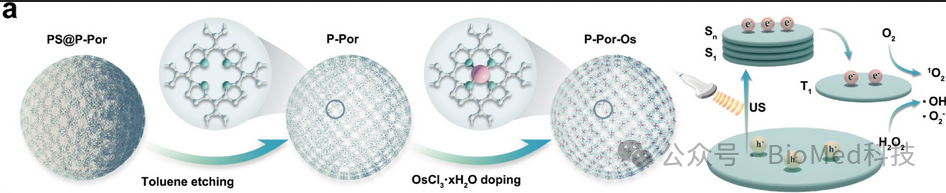
图1 P-Por-Os纳米囊泡的合成
根据转录组学和蛋白质组学数据,研究发现P-Por-Os显著上调MT2A的表达,MT2A是赋予ROS抗性的关键基因。为了通过减少所需剂量的P-Por-Os来增强治疗效果并提高生物安全性,作者使用小干扰RNA(siRNA)敲除HCC细胞中的MT2A。这种基因治疗与P-Por-Os和US联合使用,显著降低了HCC细胞对P-Por-Os产生的ROS的抵抗力,进一步阻碍了肿瘤的进展,因此可称之为精准基因治疗(PGT)(图2)。
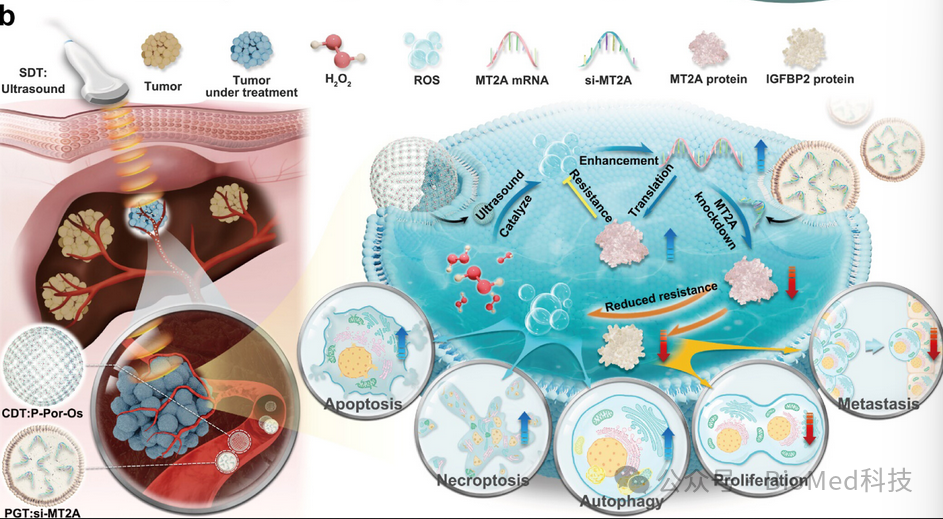
图2 抑制氧化还原稳态和恶性表型的协同治疗策略以对抗HCC
原文链接:
https://pubs.acs.org/doi/10.1021/jacs.4c10997
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










P-Por-Os显著上调MT2A的表达,MT2A是赋予ROS抗性的关键基因#MT2A#
4
#肝细胞癌# #基因治疗#
6