Autophagy:华中科技大学张必翔等团队研究揭示CKAP4在肝癌中的作用
2024-12-24 iNature iNature 发表于陕西省
该研究揭示了 RETREG1 与 CKAP4 和 TRIM21 的相互作用。
RETREG1/FAM134B 是已知的内质网自噬受体。作者之前的研究表明,RETREG1 在肝细胞癌(HCC)中上调,并通过激活 AKT 信号通路促进疾病进展。然而,RETREG1 在 HCC 中表达升高的具体机制尚不明确。
2024年12月17日,华中科技大学张必翔,陈孝平和Jin Chen共同通讯在Autophagy在线发表题为 “CKAP4 in hepatocellular carcinoma: competitive RETREG1/FAM134B binding, reticulophagy regulation, and cancer progression” 的研究论文。该研究揭示了 RETREG1 与 CKAP4 和 TRIM21 的相互作用。
作者证明了 TRIM21 在 K247 和 K252 位点对 RETREG1 进行泛素化,从而促进其蛋白酶体降解。相反,CKAP4 通过竞争性结合 RETREG1,保护其免受降解,揭示了一种新的 RETREG1 后转录修饰机制。通过调控 RETREG1 的表达,CKAP4 和 TRIM21 精细地调控内质网自噬。此外,作者观察到应激诱导下 TRIM21 的上调通过减弱 RETREG1 的功能来恢复内质网应激平衡。使用多种动物模型验证了 CKAP4 在 HCC 中的致癌潜力。临床样本分析提示,CKAP4 是 HCC 预后和诊断的潜在生物标志物。

肝细胞癌(HCC)是全球第六大常见恶性肿瘤,也是肿瘤相关死亡的主要原因。尽管在HCC治疗方面取得了显著进展,但其预后仍然较差。因此,深入研究驱动HCC增殖和转移的分子机制,并确定有效的分子靶点,对于改善治疗效果至关重要。
RETREG1/FAM134B/JK1(内质网自噬调节因子1)被认为在内质网自噬(reticulophagy)过程中充当受体。RETREG1包含两个主要结构域:内质网同源域(RHD)和LC3结合区域(LIR)。它通过RHD锚定在内质网膜上。在内质网自噬过程中,RETREG1通过RHD域引发内质网膜弯曲,并通过LIR直接与自噬小体结合,从而介导内质网自噬,过程中RETREG1被输送至溶酶体进行降解。RETREG1还在癌症进展中发挥着重要作用。
作者之前的研究表明,RETREG1在HCC中上调,并通过激活AKT/RAC-α丝氨酸/苏氨酸蛋白激酶通路促进细胞增殖、侵袭和转移。然而,RETREG1在HCC中高表达的机制尚不明确。近期研究揭示了调控RETREG1表达的多种机制,主要发生在转录前水平。例如,在软骨细胞中,FGF(成纤维生长因子)通过激活转录因子TFEB(转录因子EB)和TFE3(转录因子E3)促进RETREG1的表达。在小鼠肝脏中,饥饿诱导RETREG1-2(一个N端截短的同种异构体)表达,这与CEBPB(CCAAT/增强子结合蛋白β)介导的转录后蛋白水解切割有关。
在猪中,RETREG1的m6A缺失通过m6A-YTHDF2(YTH N6-甲基腺苷RNA结合蛋白2)依赖机制促进脂肪生成。此外,RETREG1的mRNA还受到多种微小RNA的调控。在后转录修饰水平,RETREG1的调控机制更加复杂。RETREG1在Ser151位点上被CAMK2B(钙/钙调蛋白依赖性蛋白激酶IIβ)磷酸化,促进RETREG1的寡聚化。此外,E3连接酶AMFR(自分泌运动因子受体)催化RETREG1在RHD域的泛素化,增加RETREG1簇的大小并促进内质网自噬流量。相反,在椎间盘退变(IDD)中,OGT(O-链接N-乙酰氨基葡萄糖转移酶)通过O-GlcNAc化修饰RETREG1,抑制泛素化介导的蛋白酶体降解,从而增强其蛋白稳定性。另有研究显示,在MTOR(机械靶标雷帕霉素激酶)抑制后,CSNK2/CK2(酪蛋白激酶2)磷酸化RETREG1和RETREG3(内质网自噬调节因子家族成员3),并通过磷酸化依赖的泛素化促进RETREG1和RETREG3的聚集。迄今为止,RETREG1在HCC中的后转录修饰机制尚未被探索,RETREG1的蛋白降解途径仍需进一步阐明。
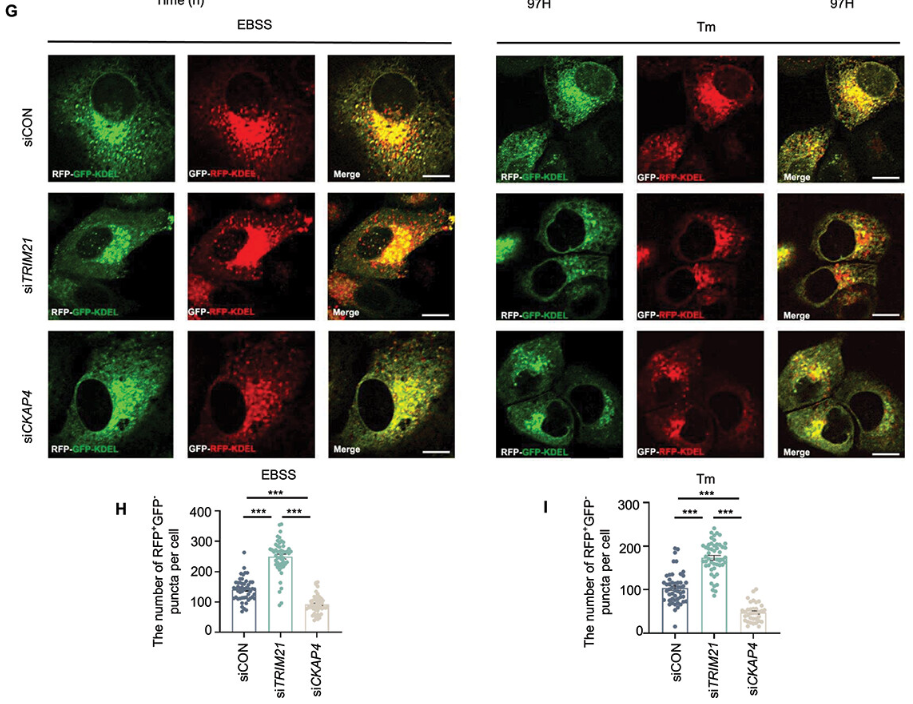
CKAP4和TRIM21通过调控RETREG1调控网状吞噬(图片源自Autophagy)
CKAP4/p63/CLIMP-63(细胞骨架相关蛋白4)是一种位于细胞膜和内质网的蛋白。CKAP4通常作为内质网标志物和内质网自噬的底物。关于CKAP4的大多数研究集中在其在肿瘤生物学中的作用。研究表明,在肺癌、胰腺癌和食管癌中,分泌性蛋白DKK1(Dickkopf WNT信号通路抑制因子1)与CKAP4结合,导致其从细胞膜内化。CKAP4与磷脂酰肌醇3激酶/PI3K SRC同源3域相互作用,激活AKT通路并促进肿瘤进展。在食管癌细胞中,DKK3(Dickkopf WNT信号通路抑制因子3)也可以与CKAP4结合,独立于DKK1-CKAP4通路激活AKT。在胰腺癌中,CKAP4通过DKK1依赖的内吞作用通过外泌体分泌,并可能作为生物标志物。此外,CKAP4已被证明通过多种机制促进肾透明细胞癌、膀胱癌和神经胶质瘤的进展。这些研究表明,CKAP4在许多肿瘤中具有致癌作用,但其在HCC中的具体作用及机制尚未明确。
在该研究中,作者证明了CKAP4与RETREG1相互作用,并通过抑制其K48-多泛素化,促进内质网自噬和HCC进展。作者还确认了E3连接酶TRIM21(含三部分结构域的21号蛋白)在K247和K252位点对RETREG1进行泛素化。CKAP4与TRIM21竞争调控RETREG1的蛋白酶体降解。此外,作者展示了在内质网应激过程中,TRIM21上调RETREG1并促进其蛋白酶体降解,揭示了一种新的调节内质网自噬的机制。最后,作者强调了CKAP4在HCC中的致癌作用及其治疗潜力。
原文链接:
https://doi.org/10.1080/15548627.2024.2435236
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#肝细胞癌# #CKAP4#
12