【衡道丨病例】病理诊断——复合性血管内皮瘤
2025-04-15 衡道病理 衡道病理
非典型子宫内膜增生 / 子宫内膜样上皮内瘤变(AH/EIN)需与子宫内膜息肉、化生、分泌性子宫内膜及子宫内膜样癌鉴别。还介绍 AH/EIN 生物标志物应用进展,通过病例展示其诊断与鉴别要点。
AH/EIN的鉴别诊断
鉴别诊断1:子宫内膜息肉
二者均有腺体的拥挤,分支,囊状扩张。但息肉的改变为局灶性,腺体轻度致密和结构不规则,腺体与表面上皮平行,间质为纤维性的,扩张的厚壁血管。在子宫内膜息肉中,拥挤的腺体类似于背景的非拥挤腺体。如果拥挤的腺体显示核增大、核复层化和极性丧失,则可以诊断为非典型子宫内膜增生/子宫内膜样上皮内瘤变。
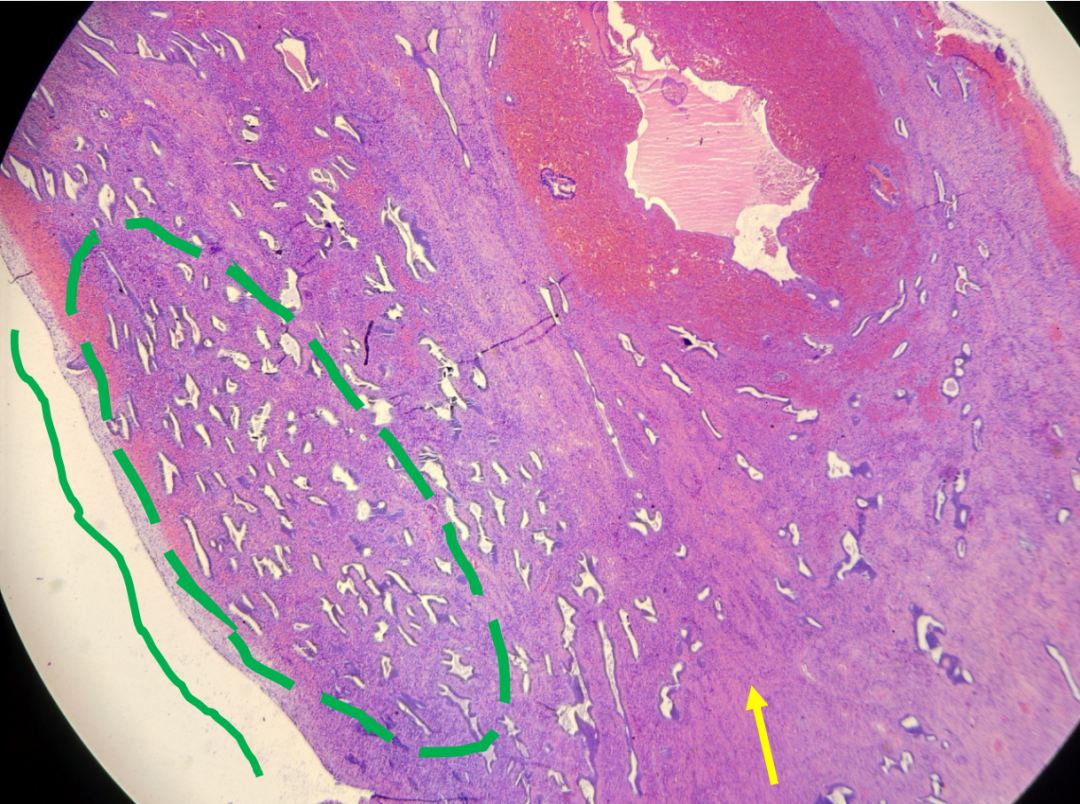
子宫内膜息肉,腺体拥挤,分支,形态不规则,走向与表面平行(绿色虚线),纤维性的间质(黄色箭头)。
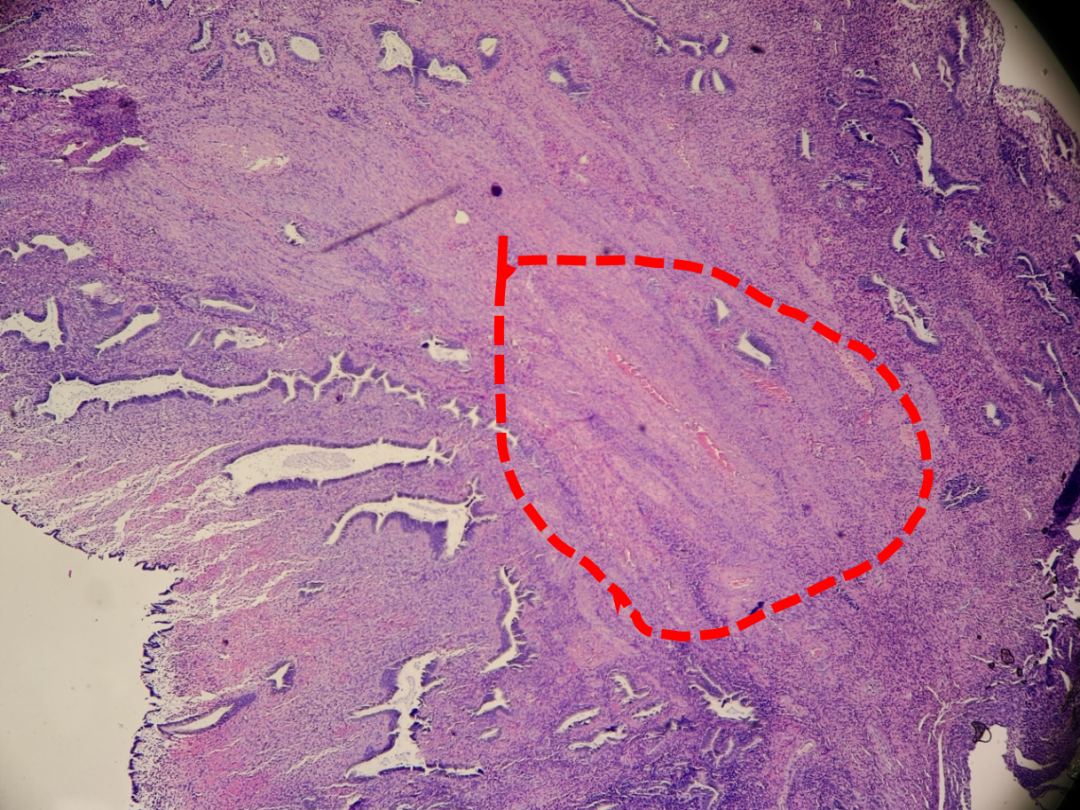
子宫内膜息肉,厚壁血管簇(红色虚线)
鉴别诊断2:子宫内膜化生
各种化生可能涉及正常子宫内膜以及增生性/肿瘤性子宫内膜,并可能使子宫内膜活检的诊断复杂化。化生病灶与背景子宫内膜不同,可以模仿肿瘤。最常见的化生类型包括纤毛(输卵管)、嗜酸细胞性、鳞状、粘液性、靴钉状、透明细胞和乳头状合体细胞化生。应评估整个子宫内膜标本并确定是否存在化生。如果存在,应注意化生的分布(散在、弥漫、局部)。比较化生性和非化生性区域的腺体的细胞学和结构特征。孤立的化生不会显示腺体过度拥挤。当在拥挤的腺体病灶中观察到明显不同于非拥挤腺体的化生变化时,可以考虑诊断为非典型子宫内膜增生/子宫内膜样上皮内瘤变伴有化生性改变。
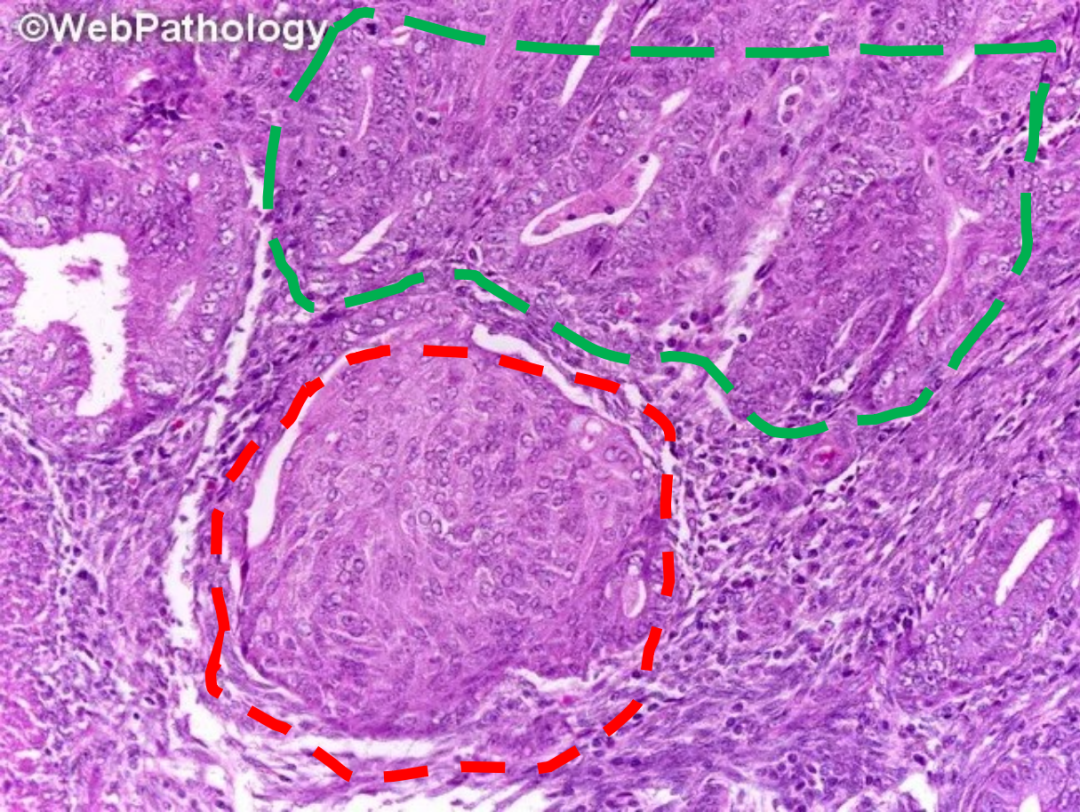
子宫内膜非典型增生(绿色虚线:腺体密集拥挤,核圆,空泡状,可见核仁,极向紊乱)背景下的鳞状化生(红色虚线:桑葚状化生)。
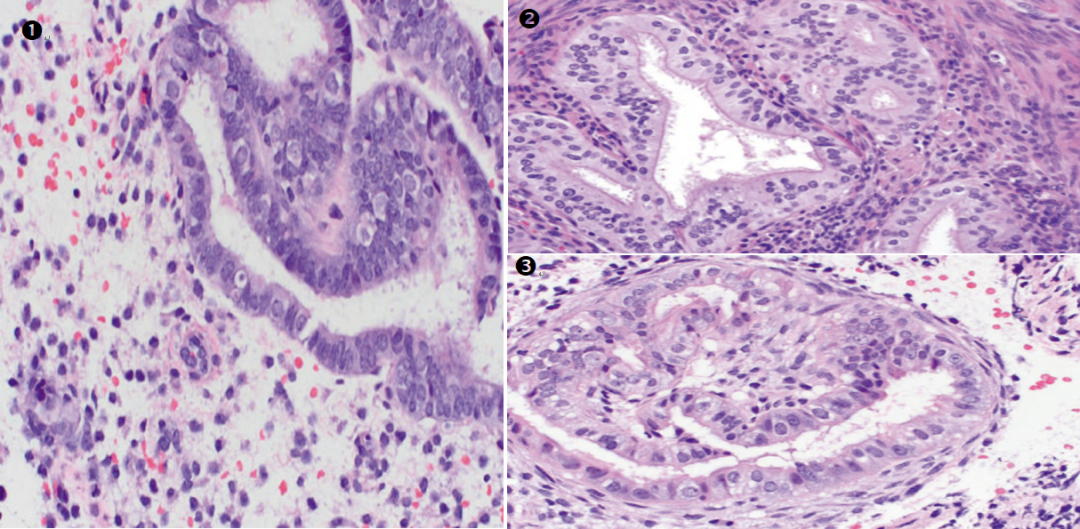
①纤毛(输卵管)化生,含有纤毛细胞及透明细胞的双相细胞群。②③灶状增生的腺体伴纤毛(输卵管)化生。子宫内膜增生或子宫内膜样癌中经常发现纤毛(输卵管)化生。在评估具有输卵管化生的特定病灶时,腺体结构的复杂性是主要决定因素,而应忽略输卵管化生。
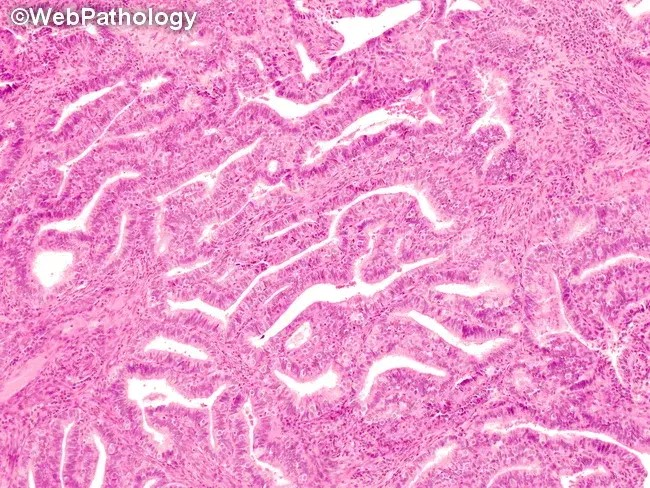
子宫内膜非典型增生背景下的输卵管化生。拥挤的、结构复杂的腺体由具有嗜酸性细胞质的纤毛细胞构成。
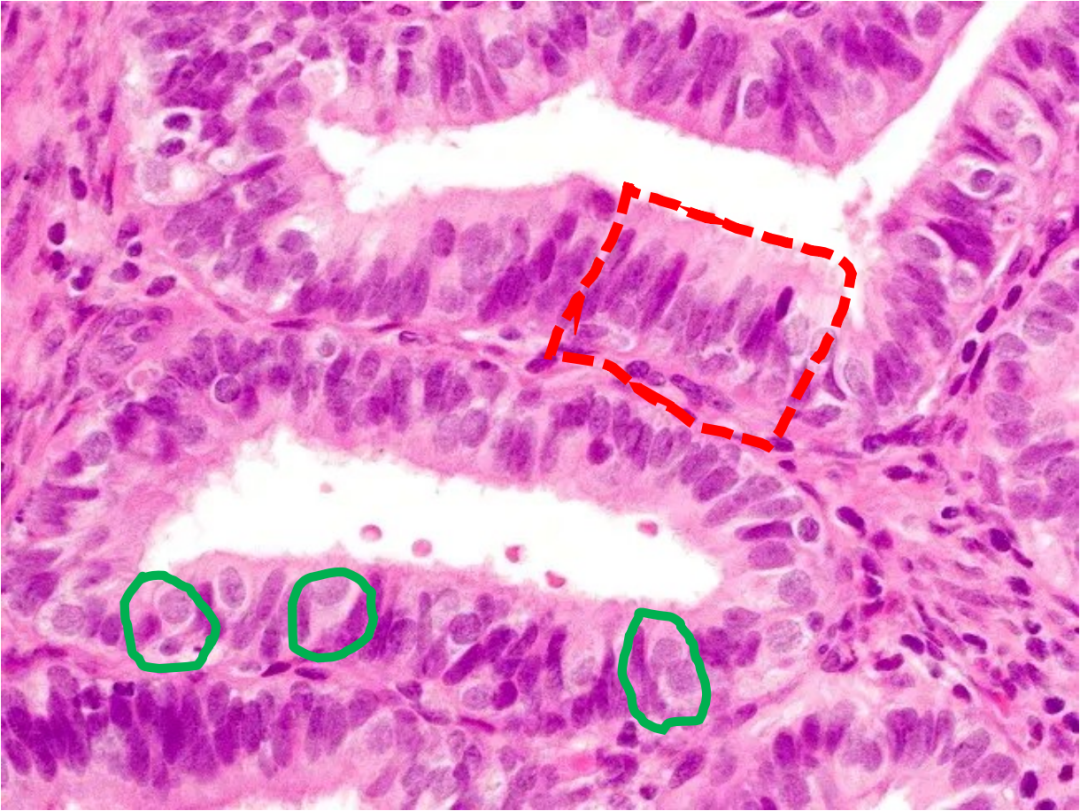
高倍镜下可见纤毛细胞(红色虚线)间散布着圆形透明细胞(绿色实线),细胞非典型性似乎不明显,但层次多,极向乱。
鉴别诊断3:分泌性子宫内膜与分泌型AH/EIN
AH/EIN偶尔伴有腺上皮的分泌性改变,被称为分泌型AH/EIN,分泌型EIN 在组织学上仍保留经典EIN 的一些特征,如腺体排列杂乱、复杂的腺体腔缘等,高倍镜下可见胞质丰富透明、核上或核下空泡、腺体腔缘顶端褶皱及圆形泡状核等。
分泌期子宫内膜呈现整体的腺体密度增加、拥挤,腺体弯曲、扩张,可形成锯齿状结构,但腺体的排列是规则的、有极向。分泌型AH/EIN的腺体则更加密集,结构复杂,排列不规则。免疫组化Ki-67有一定鉴别意义,分泌型AH/EIN的Ki-67表达明显高于背景分泌性内膜。
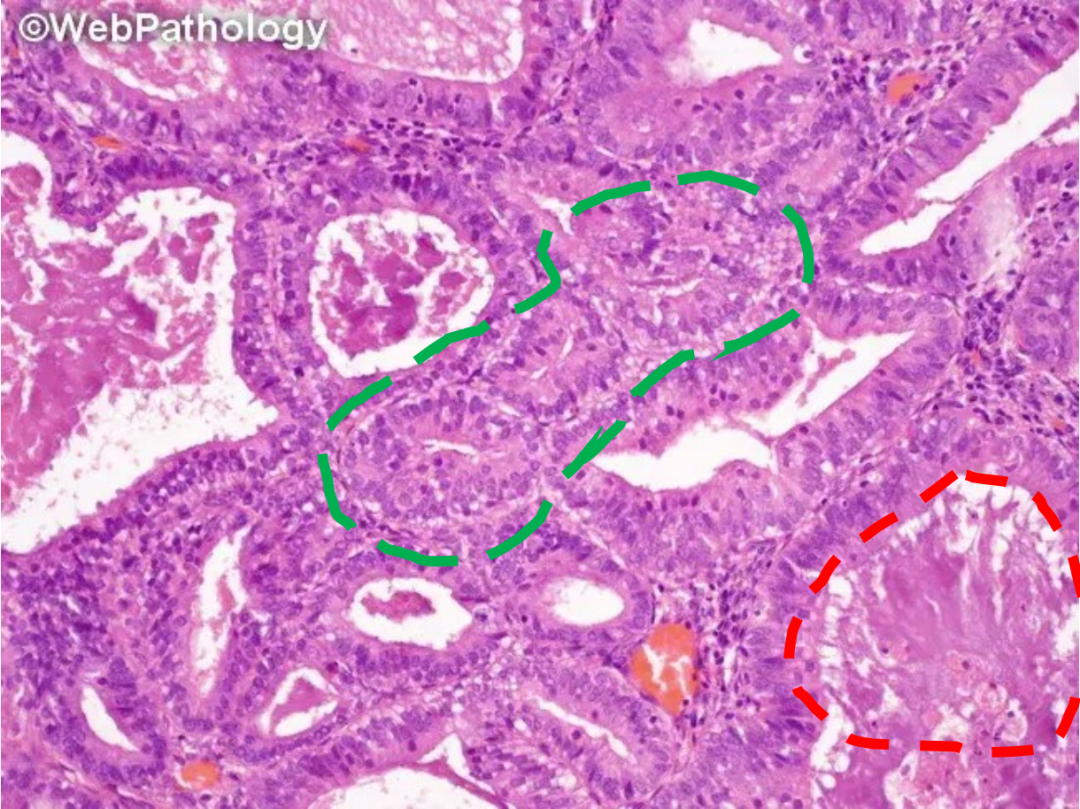
伴有分泌改变的AH/EIN,腺体密集,拥挤,排列不规则,核下空泡(绿色虚线)和管腔分泌物(红色虚线)类似于分泌性子宫内膜,但腺体上皮细胞层次多,极向乱,核的非典型性支持AH/EIN的诊断。
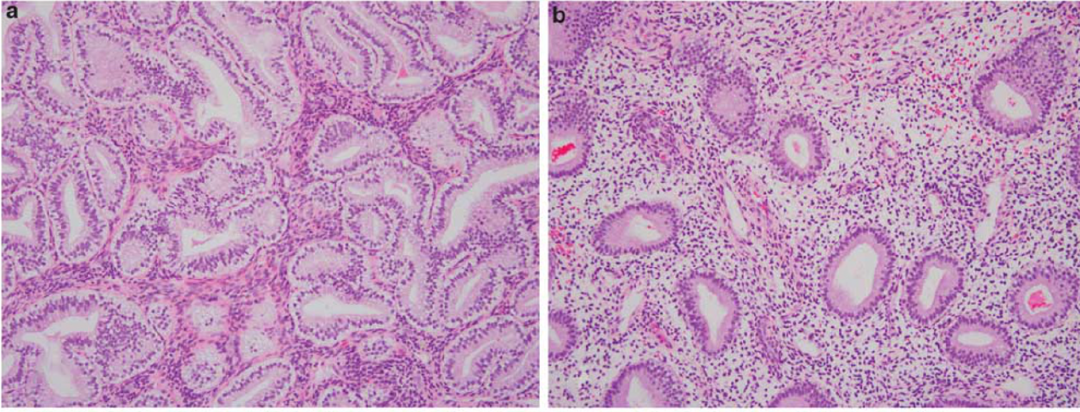
a:分泌型AH/EIN,腺体过于密集拥挤,细胞层次多,极向乱; b:背景中的分泌性子宫内膜,腺体稀疏,细胞单层,排列整齐
鉴别诊断4:子宫内膜样癌
|
AH/EIN |
子宫内膜样癌 |
|
腺体拥挤,但无搭桥,缺少筛状结构或绒毛腺管状结构; 腺体之间保留正常内膜间质 |
腺体结构更加复杂,呈搭桥或腺体内乳头形成、筛网状、迷路状、绒毛管状甚至小灶实性区; 正常内膜样间质消失或变为纤维样间质 |
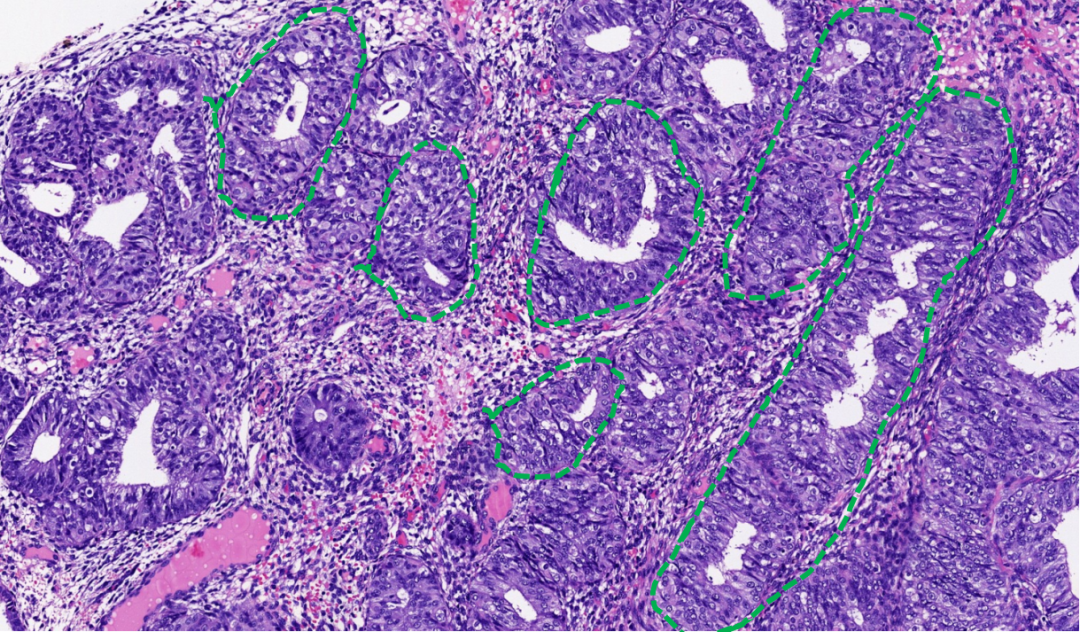
AH/EIN:腺体拥挤,但仍保持独立的结构(绿色虚线能勾勒出腺体独立的轮廓),中间有子宫内膜间质分隔
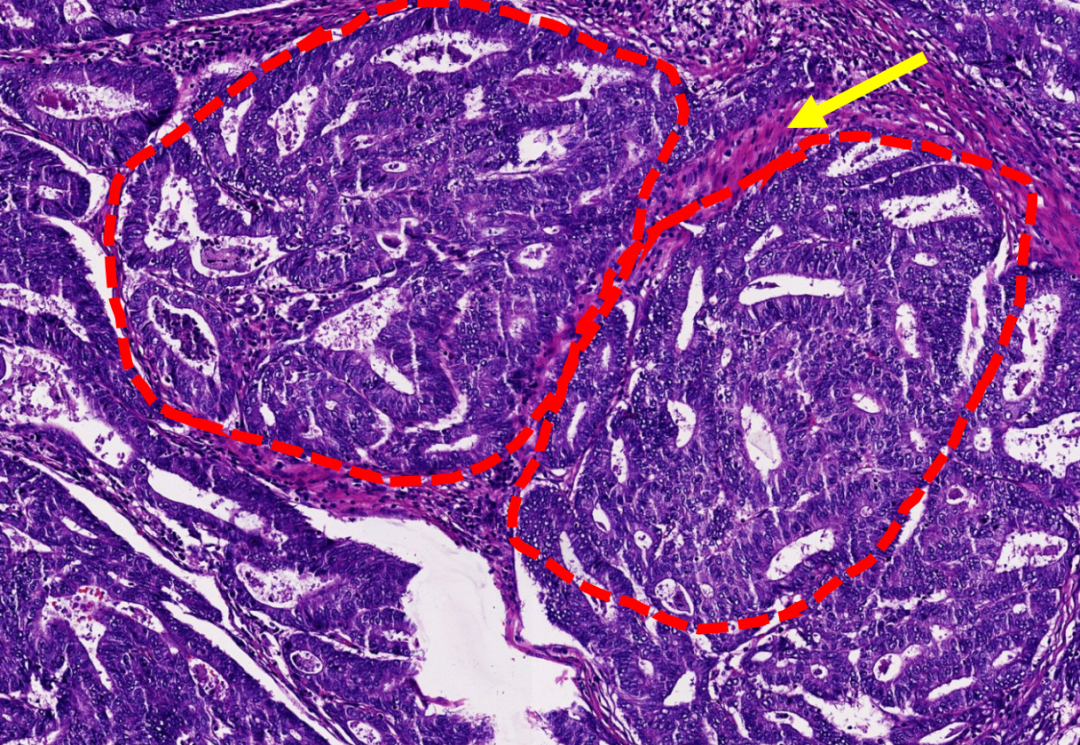
子宫内膜样癌,腺体结构更加复杂,背靠背,融合,呈搭桥、筛网状结构(红色虚线),纤维性的间质(黄色箭头)。
AH/EIN生物标志物应用的最新进展(以下内容源自参考资料1)
在过去的十年中,寻找可能有助于准确诊断AH/EIN的生物标志物一直是妇科病理学研究的热门领域。许多标记物来自TCGA子宫内膜癌的研究。通过比较正常子宫内膜和AH/EIN之间的表达模式,不断努力完善个体生物标志物的解释标准。下表列出了正常子宫内膜中单个生物标志物的表达模式的详细信息,以及AH/EIN异常表达的解释标准。
|
表达特征 |
|||
|
标记物 |
正常模式 |
在AH/EIN中的异常模式 |
AH/EIN中异常表达的概率 |
|
PAX2 |
强烈、均匀的细胞核染色。 注:散在腺体中的核染色丢失在正常子宫内膜中很常见,通常小于整个样本的5%,但子宫内膜息肉除外,约10-20%的病例显示PAX2明显丢失。
|
•较大或弥漫性病变:超过5%的腺体表达缺失(背景正常腺体中强烈而均匀的表达作为内部对照)。 •小病变:>50%的具有细胞学改变的腺体表达缺失。 •在子宫内膜息肉的背景下:应谨慎解释PAX2缺失,并结合形态学和其他标志物 |
70–80% |
|
PTEN |
主要是细胞质染色。散在腺体中的表达缺失在正常子宫内膜中很常见,通常小于整个样本的5% |
•较大或弥漫性病变:超过5%的腺体表达缺失(背景正常腺体中的可变细胞质表达作为内部对照)。 •小病变:>50%的具有细胞学改变的腺体表达缺失。 |
40–50% |
|
β-catenin |
普遍的膜染色,除了在某些间期子宫内膜可以看到弱的核染色。 |
•强烈的核表达(与细胞膜强度相同),可能表现为弥漫性或局灶性。在AH/EIN腺体内,可以是所有细胞均匀一致的核染色,也可是分散的细胞核表达。 |
50% |
|
ARID1A |
弥漫的核染色 |
核染色缺失 |
10% |
|
MMR蛋白 |
弥漫的核染色 |
核染色缺失 |
<5% |
|
p53 |
可变比例、可变强度的细胞核染色 |
•过表达(涉及至少80%的肿瘤细胞核染色)。 •完全缺失 •细胞质(明确的细胞质染色伴随着可变的核染色)。 |
<3% |
注:从文献中学到的有助于日常诊断的重要信息。
-
目前的文献中推荐联合应用PAX2、PTEN和β-catenin三种标记物组合来提高AH/EIN诊断的准确性,灵敏度为92.8%。将其他已知的候选标记物(包括ARID1A、MMR或p53)纳入该组并没有增加超过三个标记物组合的敏感性,表明该标记物组合已达到检测上限。
-
桑葚状化生被认为是独特的形态特征,表现为大小不等的实性巢,由梭形或卵圆形细胞组成,细胞边界模糊,通常与恶性肿瘤或癌前病变相关。桑葚状化生的存在与CTNNB1突变密切相关,普遍表现出异常的β-catenin表达。同时,超过50%具有β-catenin异常表达的AH/EIN病例含有桑葚状化生。这些发现强调了桑葚状化生是子宫内膜样腺癌和AH/EIN中CTNNB1突变的可靠指标,特别是在常规实践中β-catenin检测可能不易获得的情况下,可作为诊断AH/EIN有价值的线索。
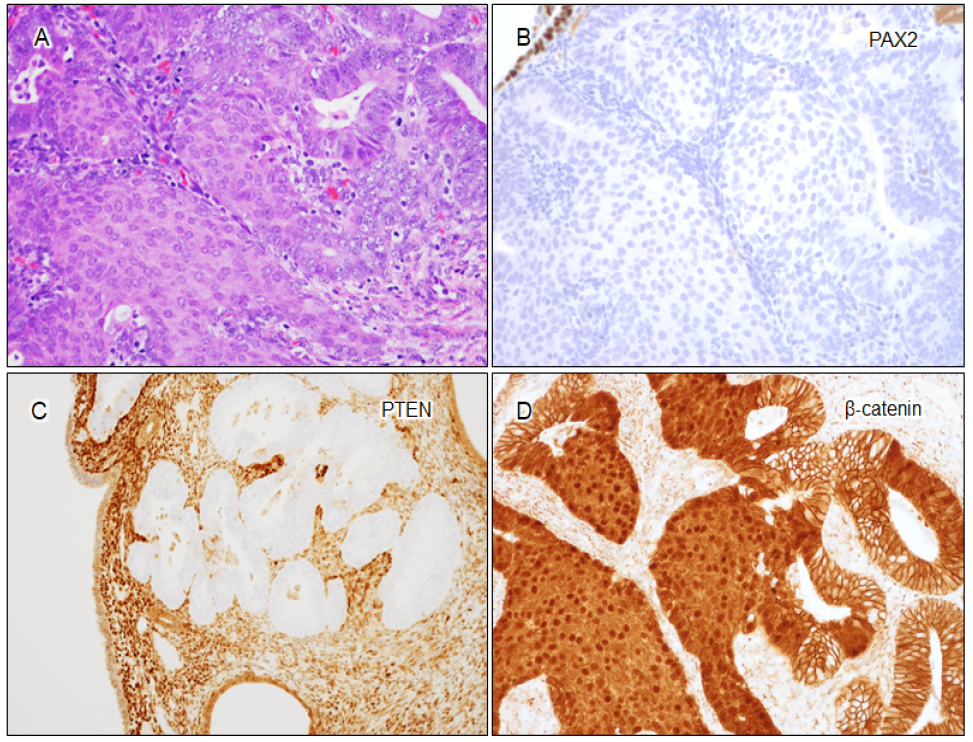
AH/EIN病例中的桑葚状化生和生物标志物异常。(A)AH/EIN伴桑葚状化生;(B)PAX2表达缺失;(C)PTEN表达缺失;(D)β-catenin核染色异常,桑葚状化生显示β-catenin弥漫性核阳性。
-
PAX2和PTEN在正常子宫内膜中经常发生零星的表达缺失,异常的标准侧重于5%以上腺体的完全缺失。但在微小病变及孕激素治疗的子宫内膜残留病变时,病灶大小可能不到所有组织的5%,此时,应用“50%的病变表达缺失”标准可能会有所帮助。
-
PTEN在正常子宫内膜腺体中的表达强度从强到弱不等,不要将弱表达视为表达缺失。
-
良性息肉通常表现出PTEN和β-catenin的正常表达,但在高达15%的息肉中可以观察到PAX2的异常表达,在子宫内膜息肉的背景下,应谨慎解释PAX2缺失,并结合形态学和其他标志物。
回顾上期第3个病例,子宫内膜内膜息肉背景中少量腺体略显拥挤,细胞形态与背景内膜略有差异,PAX-2表达丢失,PTEN弱表达,结合当前文献,考虑为没有非典型增生/EIN。该病例2家上级医院会诊认为没有非典型增生/EIN,一家医院会诊认为存在非典型增生/EIN。
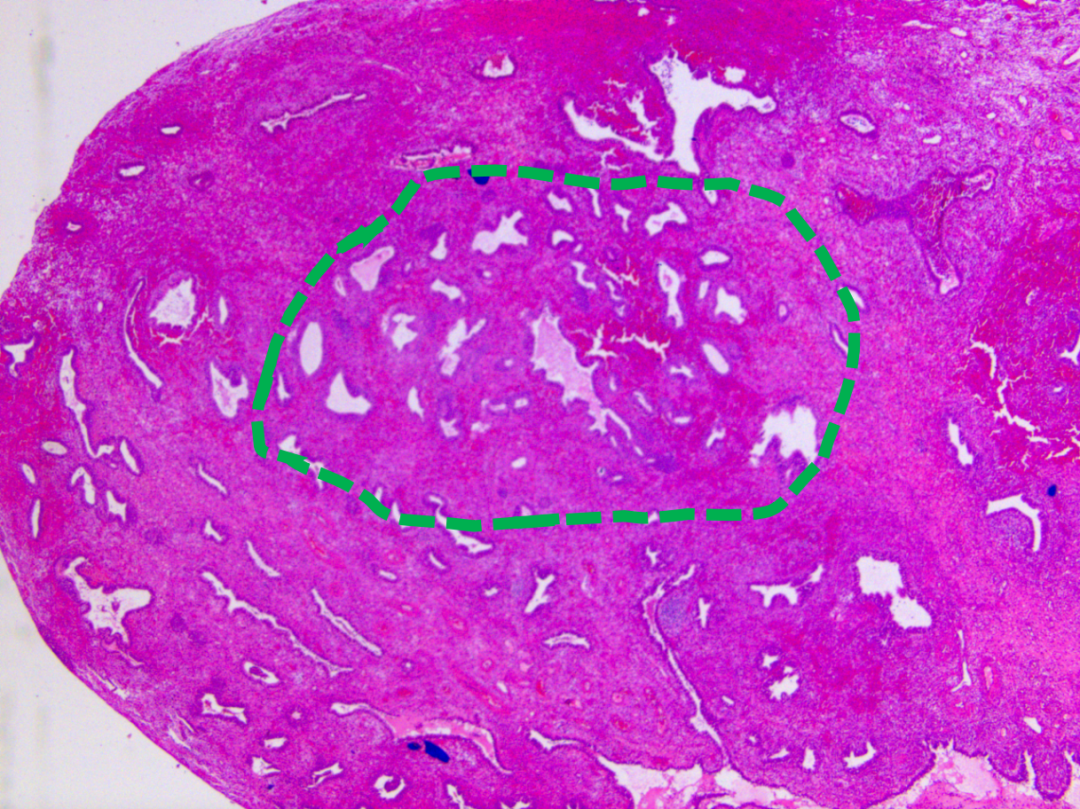
低倍镜下局部腺体略显拥挤,腺体形态不规则
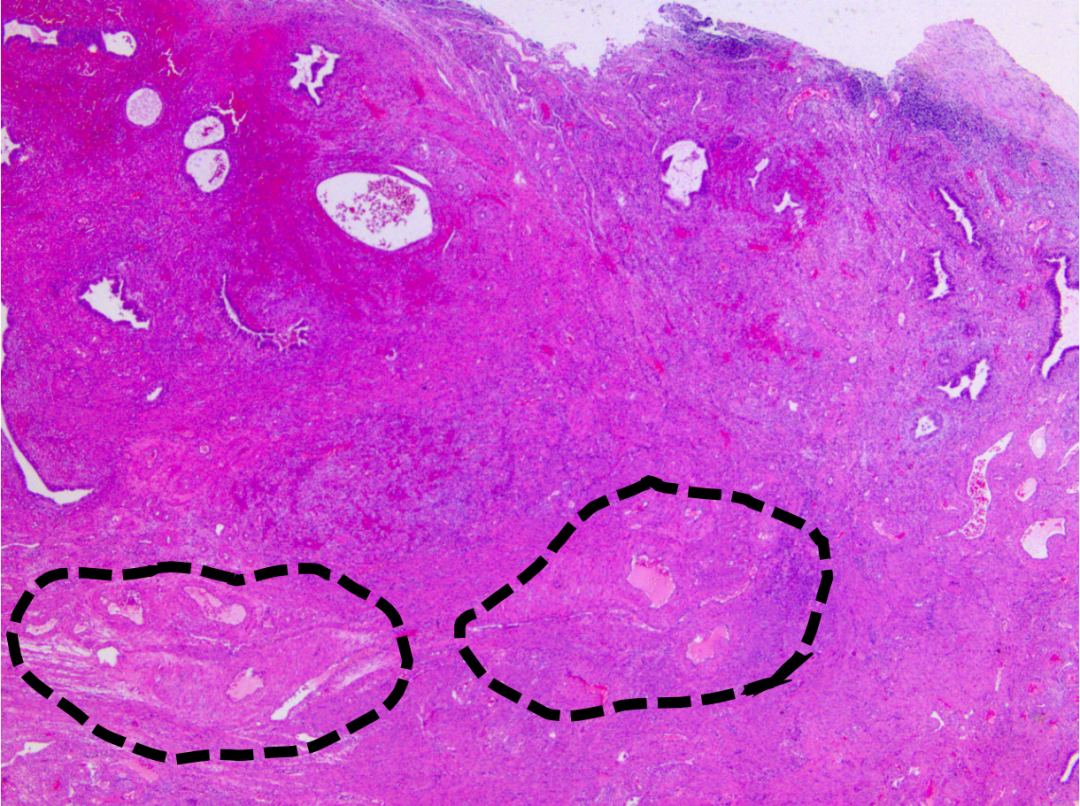
间质纤维化,可见不规则厚壁血管(黑色虚线),腺体形态不规则,符合子宫内膜息肉改变
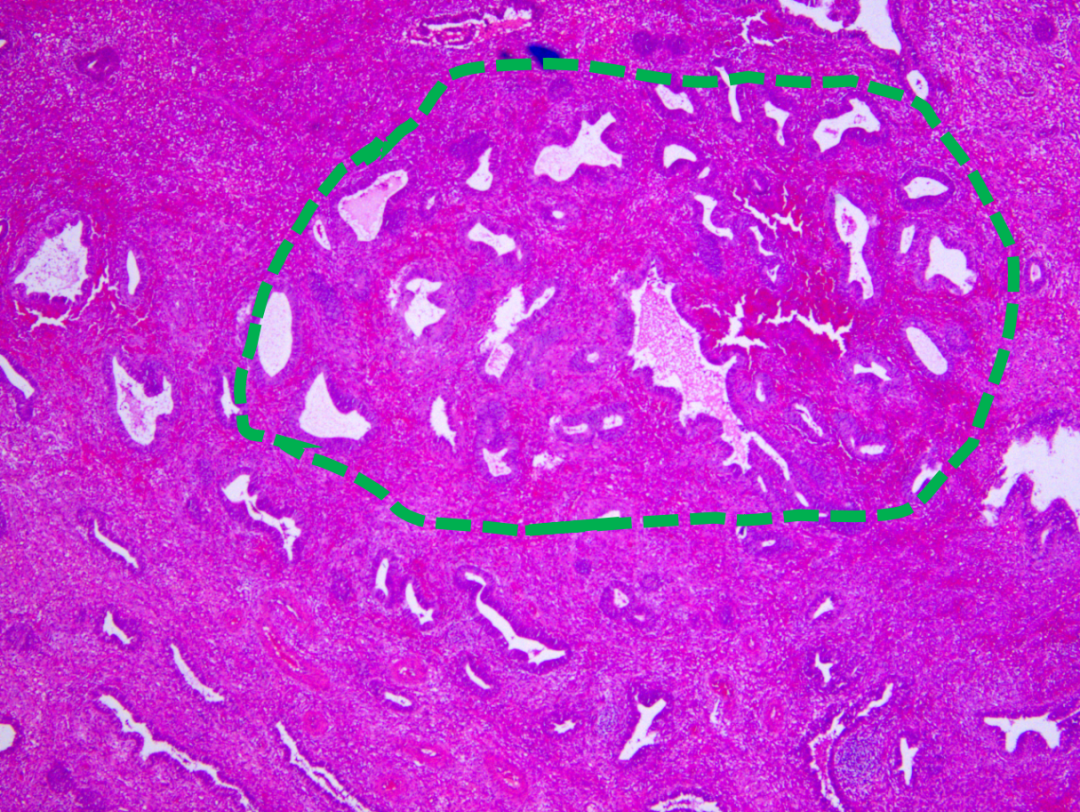
息肉内部局部腺体略显密集,不规则,腺体比例略大于间质比例(绿色虚线)
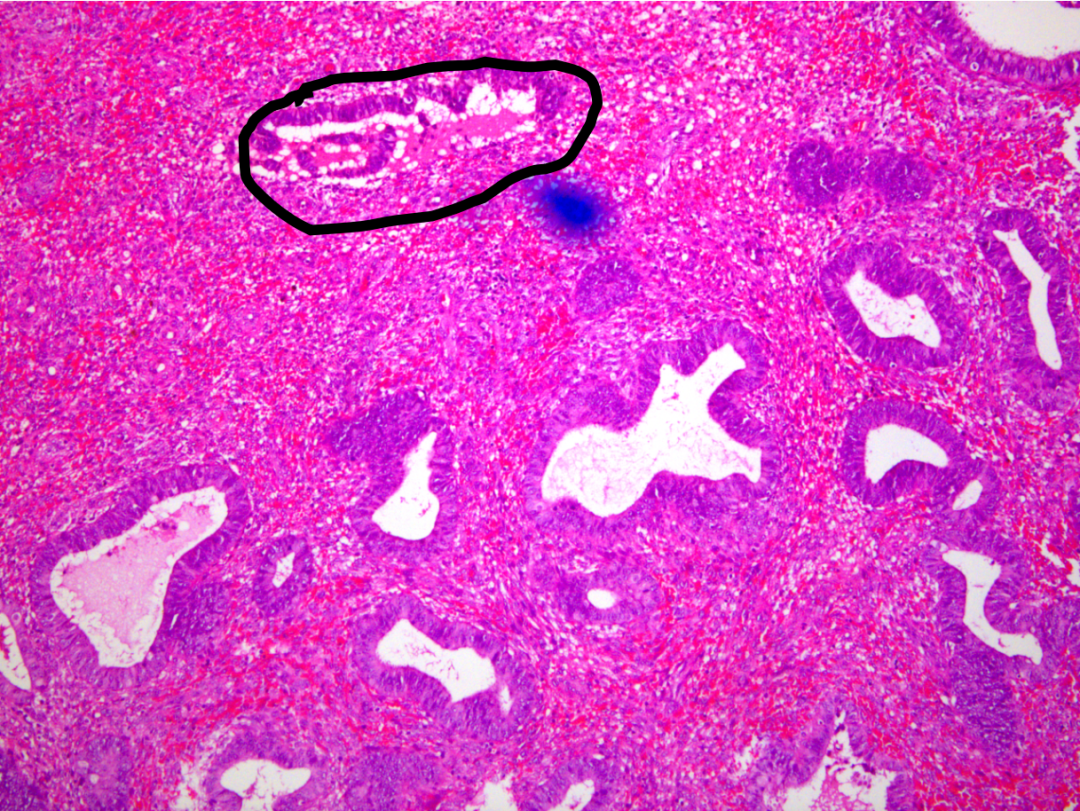
密集区域腺体细胞学与背景一个腺体(黑色实线)有差异
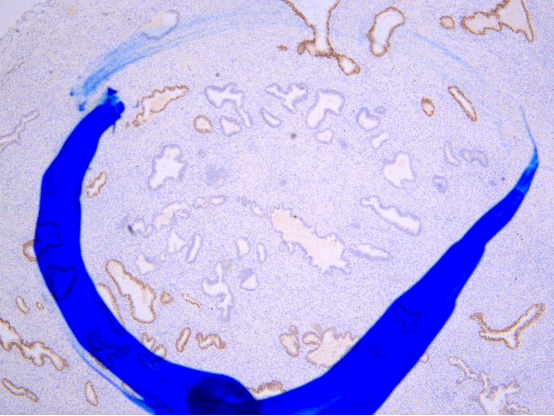
密集区域腺体PAX-2表达缺失
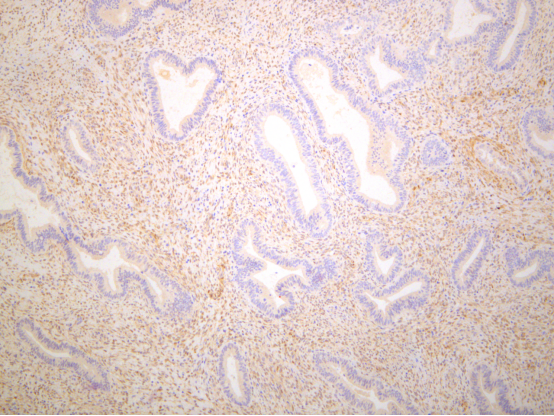
PTEN弱表达,通过阅读文献,认为这种与背景内膜表达一致的PTEN弱阳性视为阳性表达。
病例讨论
49岁女性,阴道不规则出血,诊刮标本
HE:
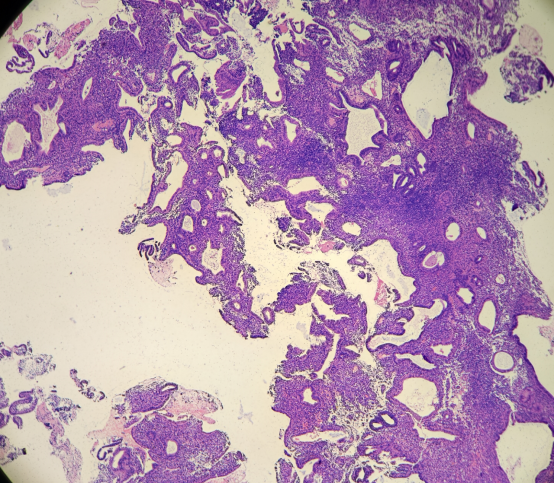
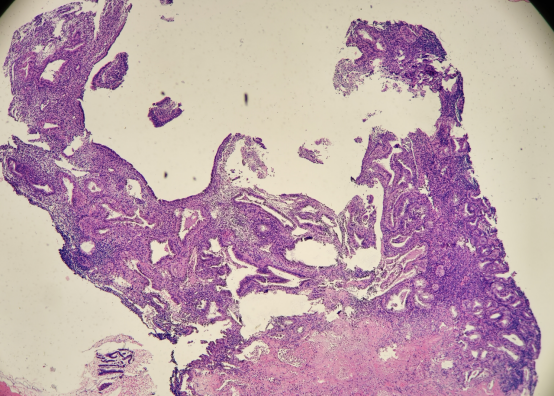
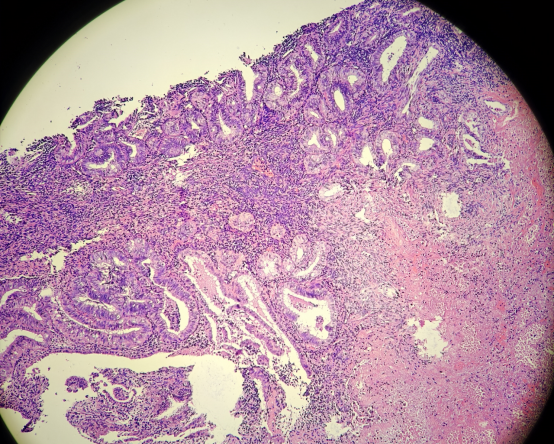
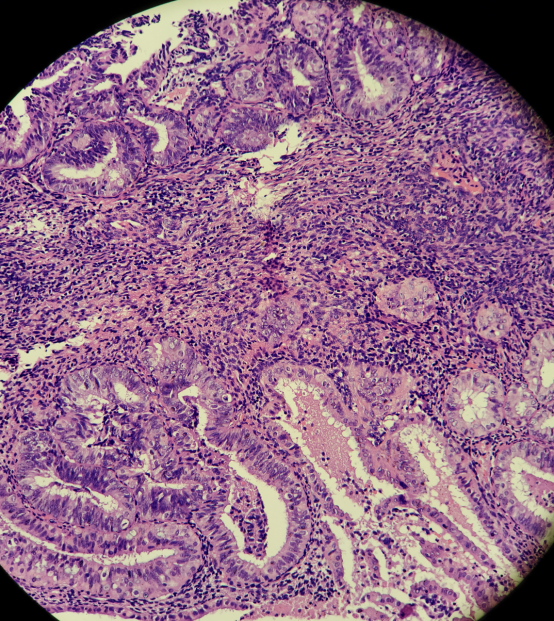
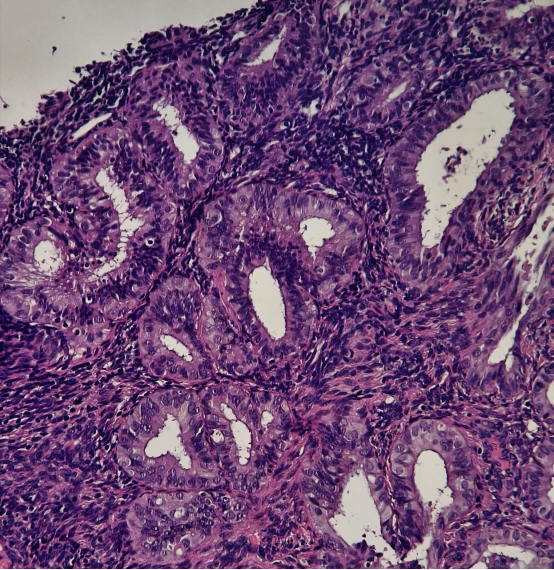
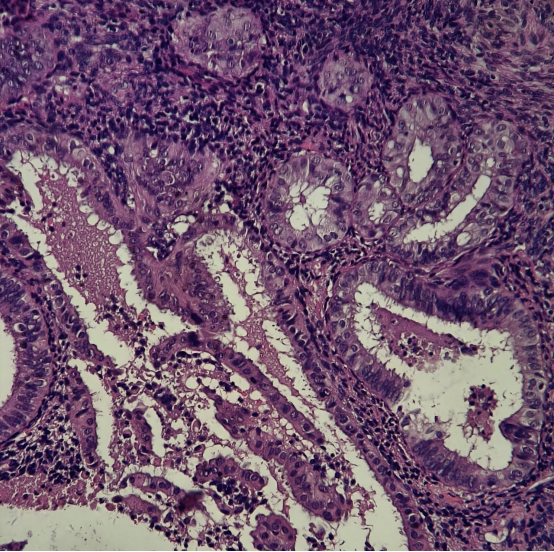
免疫组化:
PTEN:
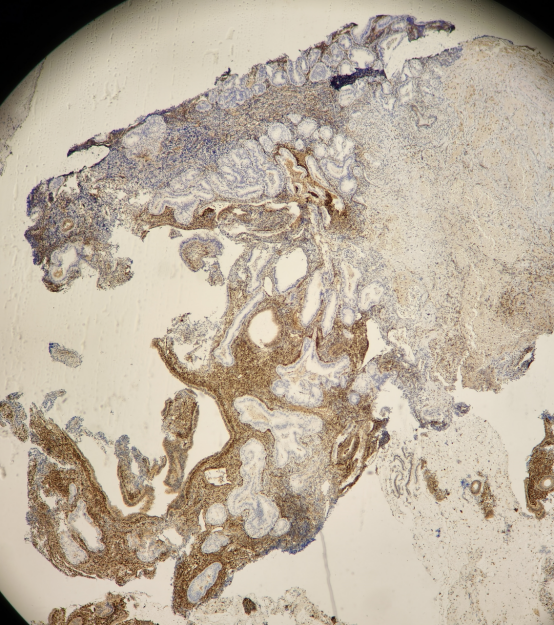
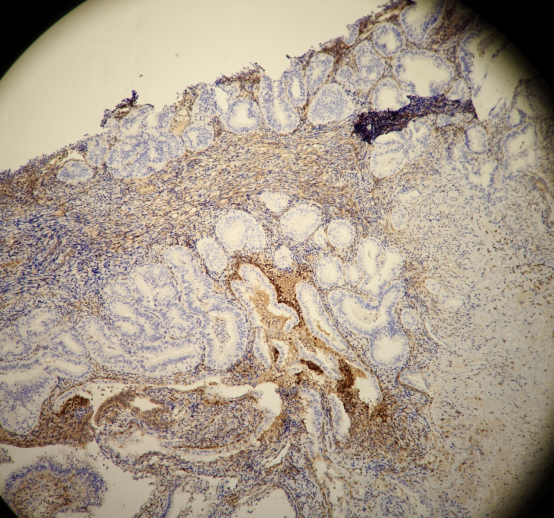
PAX-2:
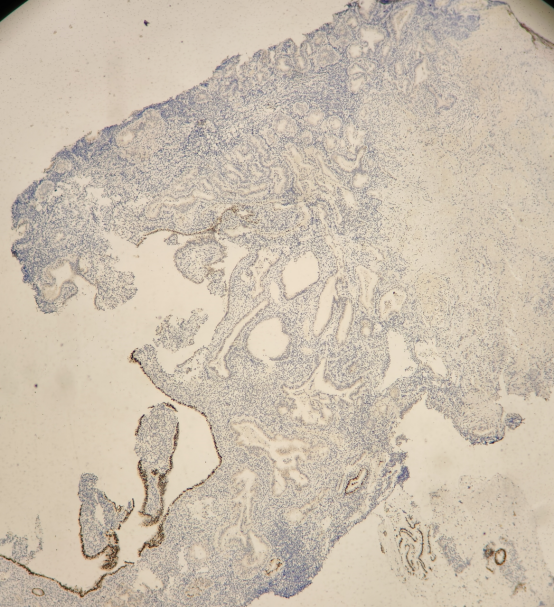
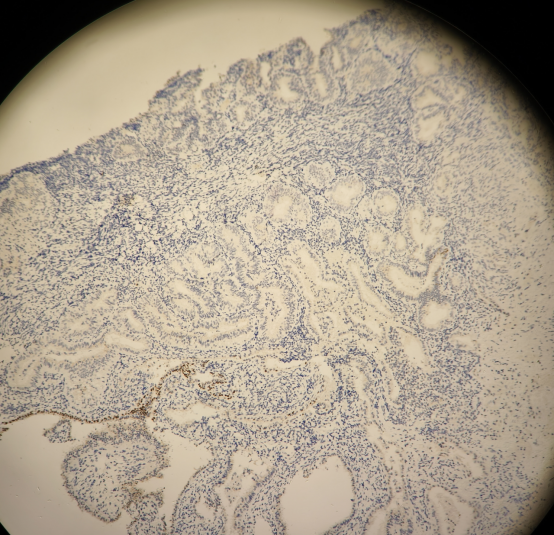
所有组织中有多灶的PTEN,PAX-2表达缺失的病灶。
参考资料
[1] Niu S, Molberg K, Castrillon D H, et al. Biomarkers in the Diagnosis of Endometrial Precancers. Molecular Characteristics, Candidate Immunohistochemical Markers, and Promising Results of Three-Marker Panel: Current Status and Future Directions[J]. Cancers (Basel), 2024,16(6).
[2] 《妇产科病理学》第2版。
[3] Blaustein’s Pathology of the Female Genital Tract. Seventh Edition
[4] Color Atlas of Female Genital Tract Pathology.
[5] Atlas of Uterine Pathology.
[6] Lucas et al. Endometrial intraepithelial neoplasia with secretory differentiation: diagnostic features and underlying mechanisms. Modern Pathology (2013) 26, 868–873.
[7] Elena Lucas, Shuang Niu, et al. Utility of a PAX2, PTEN, and β-catenin Panel in the Diagnosis of Atypical Hyperplasia/Endometrioid Intraepithelial Neoplasia in Endometrial Polyps. Am J Surg Pathol 2023;47:1019–1026.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#鉴别诊断# #AH/EIN#
13