液体活检再突破!吴一龙教授牵头中国成果登陆国际顶刊Nature Medicine
2025-03-28 测序中国 测序中国 发表于陕西省
吴一龙团队研究评估脑脊液ctDNA在NSCLC合并CNS转移患者中的临床价值,发现其可反映肿瘤负荷、提示预后,构建的多指标预后模型能精准分层,动态监测可指导治疗决策,解决CNS转移取样难题。


导语
在非小细胞肺癌(NSCLC)患者中,中枢神经系统(CNS)转移的发病率逐年攀升,包括脑转移(BMs)和脑膜转移(LMs),其临床表现高度异质化,严重影响患者的诊疗及生存。传统组织活检因侵入性高、样本获取困难等问题,严重制约CNS转移的分子特征研究与个体化治疗探索。近年来,脑脊液(CSF)ctDNA作为液体活检的一种新策略,在CNS转移瘤诊断和分子特征研究中的价值日益凸显,但其临床应用价值仍需进一步研究确认。
近日,世和基因参与了一项由广东省人民医院吴一龙教授团队主导的大型队列研究。研究采用世和一号®大Panel、百迈康®等NGS产品,系统性评估了脑脊液ctDNA在肿瘤负荷监测、预后预测及指导治疗中的临床价值,并整合基因组及临床特征构建了一款基于脑脊液ctDNA的CNS转移预后模型。研究成果发表于Nature Medicine。
研究亮点
1、创新性:构建脑脊液ctDNA多指标预后模型,实现CNS转移患者精准风险分层
2、突破性:发现脑脊液ctDNA独有突变与预后较差相关,可揭示CNS特异性耐药机制,为CNS转移患者精准诊疗提供全新视角
3、可行性:脑脊液ctDNA阳性率高达84.8%,单次及动态监测可实现CNS转移患者的全程精准管理
研究内容
研究纳入了584例合并CNS转移NSCLC患者,共收集779份脑脊液样本和302份配对肿瘤组织样本进行NGS检测,以分析CNS转移基因组特征,并结合临床数据评估脑脊液ctDNA动态监测在预后、风险分层和治疗指导中的临床应用价值。
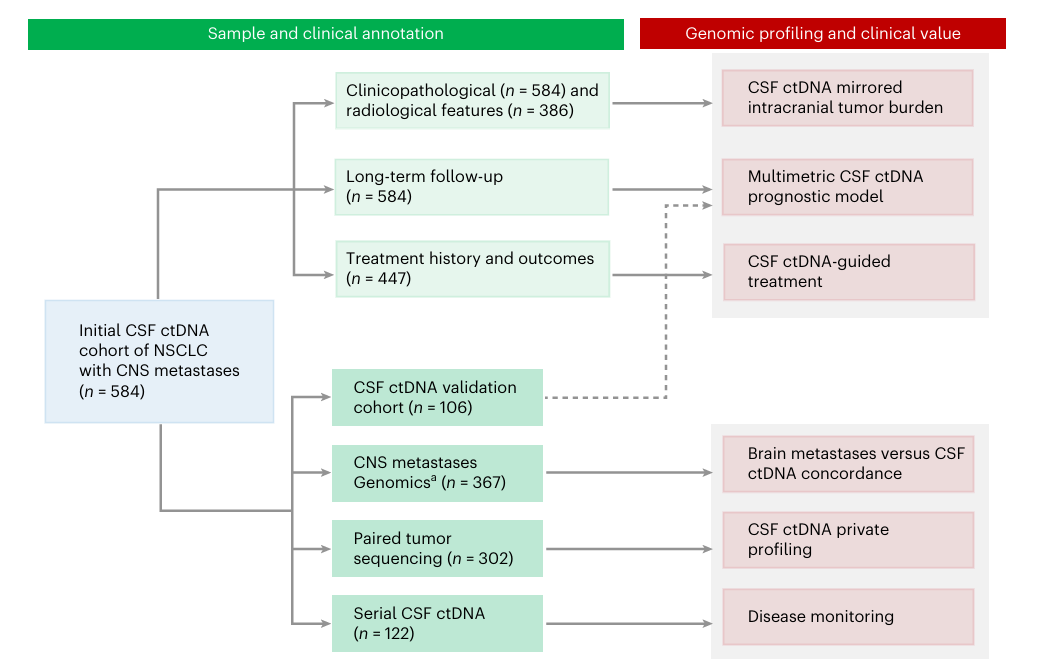
图1. 研究设计流程图
脑脊液ctDNA反映脑转移肿瘤负荷,为早期预警提供可靠依据
在脑转移患者中,ctDNA检出率为46.2%;与脑转移病灶数<5个或仅存在非靶向病灶的患者相比,具有≥5个可评估脑转移病灶数的患者,ctDNA检出率明显更高(64.7% vs. 33.3%,图2c),且ctDNA阳性组的脑病灶最长直径总和(SLD, Sum of the longest diameters)显著高于阴性组(698.9 mm² vs. 357.8 mm²,p=0.0045,图2d),且ctDNA最大变异等位基因频率(VAF)与肿瘤大小呈正相关(斯皮尔曼系数R=0.286,p=0.0018,图2e)。
在脑膜转移患者中,ctDNA检出率高达84.8%,且与脑脊液肿瘤细胞阳性率显著相关(p<0.001),在脑脊液细胞学阳性患者中ctDNA阳性率90.5% (209/231),脑脊液细胞学阴性患者中ctDNA阳性率72.7% (80/110)(图2b)。
在通过MRI和脑脊液细胞学确认为仅脑转移(BM)的患者中,脑脊液ctDNA阳性患者2年内进展为脑膜(LM)转移比例高达48.5%(vs. 23.5%,p=0.03),提示脑脊液ctDNA检测可作为影像学的有力补充,早期识别脑膜转移高风险患者。

图2. 脑脊液ctDNA与肿瘤负荷的关系
脑脊液ctDNA独立提示预后,基于脑脊液 ctDNA构建脑转移多指标预后模型
ctDNA阴性患者的中位生存期(OS)显著长于阳性患者(21.4 vs. 11.1个月,p<0.0001, 图3a)。在初治、经治、脑转移及脑膜转移亚组中均得到了类似的结果,ctDNA阴性患者中位OS显著长于阳性患者(图3b、c)。即使在脑脊液细胞学阳性患者中,ctDNA阴性亚组仍表现出显著的生存优势(中位OS:19.4 vs. 10.8个月,p=0.001,图3d)。
另外,研究通过对比302例患者的配对肿瘤组织与脑脊液样本,首次发现68.3%的CNS转移患者脑脊液中存在肿瘤组织未检出的独有突变或拷贝数变异(CNV),且这些变异富集于RTK/RAS、PI3K、细胞周期和TGFβ信号通路,与更差的生存显著相关(中位OS:9.9个月 vs. 15.3个月,HR=1.64,p=0.006, 图3e)。
多因素Cox回归分析证实,脑脊液ctDNA阳性是患者OS的独立预测因子(HR=1.87,p<0.001, 图3f),其预后价值不受体能状态、转移负荷等其他变量干扰。这一结论为CNS转移患者的分层管理提供了分子层面的循证依据。
研究团队通过整合临床特征和脑脊液ctDNA等特征,基因单因素、多因素Cox回归分析,开发了一款脑脊液ctDNA多指标预后模型。模型纳入RB1变异、脑脊液ctDNA状态、ECOG PS评分、肿瘤转移负荷和全身进展等因素,可将患者分为高风险组和低风险组。在训练队列(n=292)、测试队列(n=292)和验证队列(n=106)中,模型均显示出良好的预后分层能力:高风险组中位OS分别为8.9个月、9.9个月和6.0个月,低风险组分别为20.2个月、26.4个月和11.3个月(图3g-i)。该模型在各队列中均能区分高风险与低风险患者,且低风险患者的OS都整体更长,这些结果支持该模型在NSCLC患者CNS转移风险分层中的潜在临床应用价值。这一模型突破了传统依赖影像学或单一生物标志物的局限性,为个体化治疗决策提供了标准化工具。
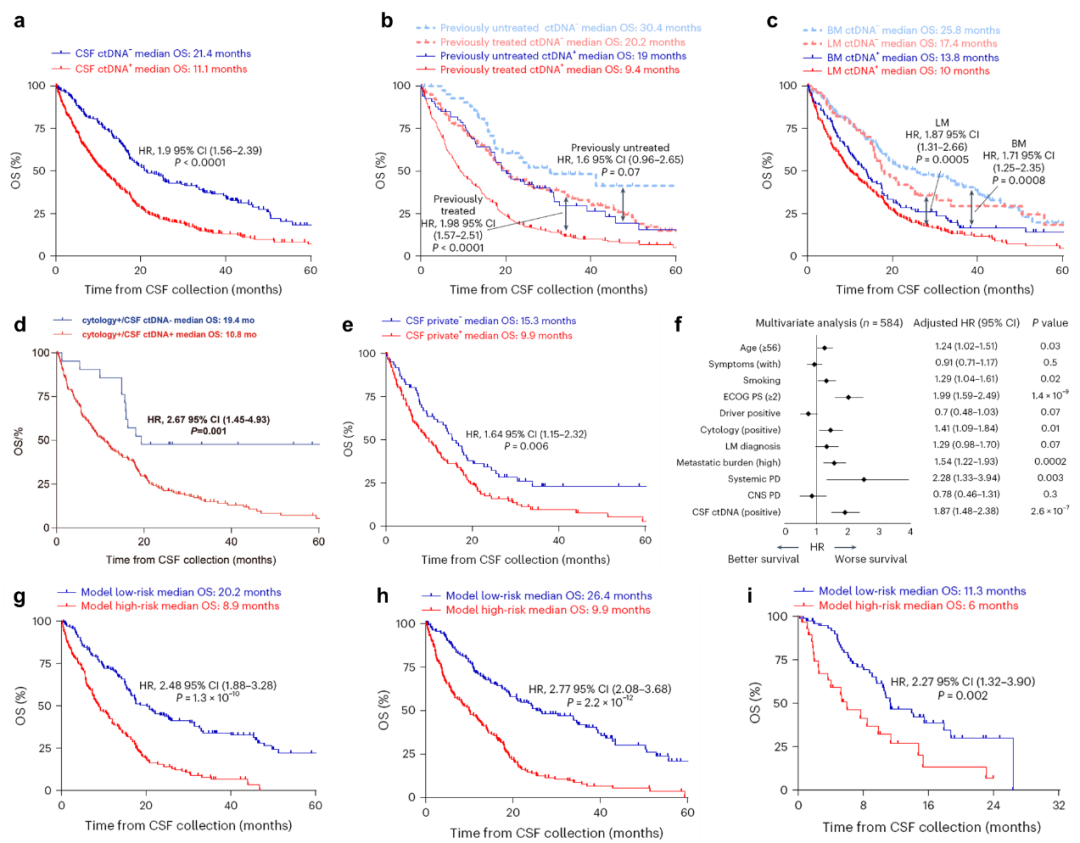
图3. 基于脑脊液ctDNA的预后模型分层生存曲线
脑脊液ctDNA动态监测指导治疗决策,揭示耐药机制
在536例携带可靶向变异的患者中,329例接受了靶向治疗。与传统治疗相比,接受脑脊液ctDNA匹配治疗的患者中位OS达15个月(vs. 8.6个月,p=0.003,图4a)。此外,脑脊液ctDNA检测还能助力免疫治疗策略优化,阳性患者接受免疫治疗后的生存期远高于阴性患者(17.4 vs. 3.9个月,p=0.02,图4b)。
在294名接受TKI治疗的患者中,26.9%(79/294)的耐药机制通过脑脊液ctDNA检测被发现,包括EGFR T790M、C797S和MET、ERBB2扩增等。在22例有配对肿瘤和脑脊液样本的患者中,45.5%(10/22)的耐药机制仅在脑脊液中检出,这一发现为克服CNS转移的靶向治疗耐药提供了全新视角(图4c)。针对耐药突变调整治疗方案的患者(如二次靶向治疗),中位OS显著延长(14.3个月 vs. 6.0个月,p=0.018,图4d)。
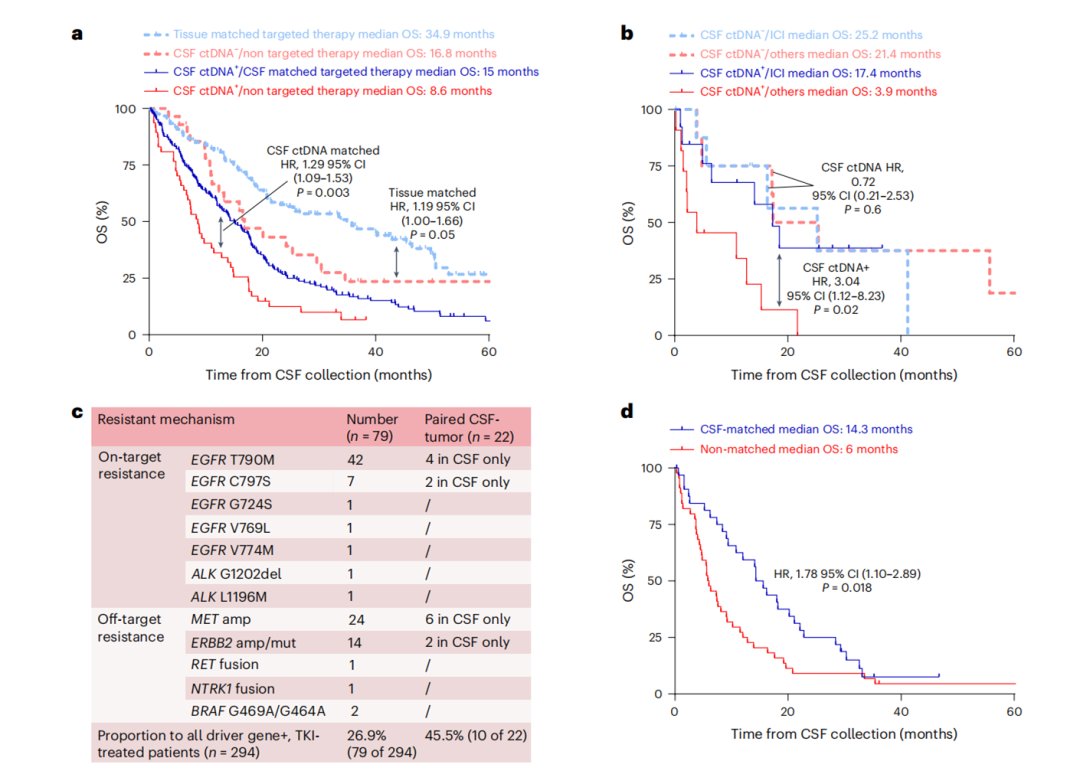
图4. 脑脊液ctDNA指导的靶向治疗生存获益
研究结论
本研究首次系统性建立了脑脊液ctDNA在非小细胞肺癌(NSCLC)中枢神经系统(CNS)转移患者中“精准检测-分层干预-个体化治疗-动态监测”的全链条应用体系,突破性解决CNS转移患者取样困难的临床问题,为CNS转移的全程管理提供了可推广的标准化方案。
2024年11月,FDA发布《ctDNA应用于早期实体瘤药物开发的行业指南》,鼓励将ctDNA检测纳入临床实践和临床试验中,用于筛选、富集患者及评价疗效。本研究发现脑脊液ctDNA对CNS转移风险分层和指导治疗有重要的临床价值。未来,随着临床研究的深入推进,这一技术有望成为CNS肿瘤精准医疗的核心工具,进一步改善NSCLC患者的生存结局。
参考文献
Zheng M M, Zhou Q, Chen H J, et al. Cerebrospinal fluid circulating tumor DNA profiling for risk stratification and matched treatment of central nervous system metastases[J]. Nature Medicine, 2025: 1-10.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#非小细胞肺癌# #液体活检#
7