Nat Genet:基于WGS数据绘制癌症进展过程中ecDNA扩增图谱,揭示抗癌新靶点
2024-11-03 测序中国 测序中国 发表于上海
该研究表明ecDNA在癌症进展和转移过程中为肿瘤提供了竞争优势。
癌症的进展和转移是治疗失败和患者死亡的主要原因,对未经治疗原发性肿瘤及经治疗转移性肿瘤的基因组特征进行表征,可提高人们对癌症进展的理解。癌症的进展涉及基因组改变,包括局灶性DNA扩增,其可通过与染色体相连形成均质染色区域,或通过切除和环化DNA片段形成染色体外DNA(ecDNA)实现。其中,ecDNA在大多数癌症类型中被检测到,特别是在预后较差的癌症中。
ecDNA携带或激活的基因包括一些常用抗癌抑制剂靶点基因和“不可成药”致癌基因;在肿瘤细胞中,ecDNA还参与癌基因扩增、基因转录调控和肿瘤异质性,这些特点表明ecDNA在癌症中扮演着重要角色,调控ecDNA相关过程的蛋白质可能是潜在的药物靶点。因此,深入解析ecDNA在癌症进展中的作用机制,可促进人们对肿瘤发病机制的了解,并为癌症治疗提供新的研究方向。
近期,耶鲁大学医学院的科研团队及其合作者在Nature Genetics上发表了题为“Mapping extrachromosomal DNA amplifications during cancer progression ”的文章。研究团队检测并分类了8,060例新诊断的原发性癌症、未经治疗的转移瘤和接受治疗的肿瘤中的局灶性扩增。与新诊断的癌症相比,未经治疗的转移瘤和接受治疗的肿瘤中检测到ecDNA的频率显著更高;接受过治疗的患者肿瘤中ecDNA频率也高于未经治疗患者。特别地,微管蛋白抑制与ecDNA增加相关,ecDNA相较染色体扩增更有可能被保留。此外,与特有ecDNA和新诊断肿瘤的ecDNA相比,共享ecDNA和晚期癌症中的ecDNA更有可能发生局部高突变事件。总之,该研究表明ecDNA在癌症进展和转移过程中为肿瘤提供了竞争优势。

文章发表在Nature Genetics上
01 晚期肿瘤样本中可频繁检测到ecDNA
研究团队分析了TCGA、HMF及GLASS队列中8,060个肿瘤样本的全基因组测序(WGS)数据,包括接受治疗/未治疗/治疗状态未知肿瘤患者、新诊断肿瘤患者和原发性-复发性肿瘤患者。首先计算了进展期肿瘤中ecDNA的发生率、检测了局灶性扩增的基因组位点,从8,060个样本的全基因组序列中重建扩增子结构并根据结构特征进行分类。结果显示,共检测到2,602个ecDNA扩增子和8,594个ChrAmp扩增子,其可进一步细分为ecDNA、ChrAmp和NoAmp(无局灶性体细胞拷贝数扩增)3类。
经质量筛选,研究团队构建了原发性癌症队列(由TCGA-ICGC中新诊断和未治疗的肿瘤组成),晚期癌症队列(由TCGA-ICGC和HMF中转移性和/或接受治疗肿瘤组成) 以及由153名患者的306个多时间点样本组成的纵向队列。
相较原发性癌症队列,晚期癌症队列中携带ecDNA和ChrAmp扩增子的肿瘤比例显著更高,但两队列扩增子的复杂性、拷贝数和大小无显著差异。原发性癌症队列中,胶质母细胞瘤、食管癌和膀胱癌样本含有ecDNA扩增子的频率较高;在晚期癌症队列中,肾透明细胞癌、食管癌等癌症类型中ecDNA样本比例和每个样本中ecDNA平均数量显著增加。上述结果表明,ecDNA和染色体扩增子频率的增加与肿瘤谱系无关,但其驱动作用可能因肿瘤谱系而异。
在原发性癌症肿瘤中,ecDNA和ChrAmp扩增子经常共同出现局部超突变(kataegis);在晚期癌症队列中,含癌基因ecDNA发生kataegis聚类突变事件频率明显高于非癌基因ecDNA。这表明含有癌基因和kataegis的ecDNA在肿瘤进展时更易被检测到。
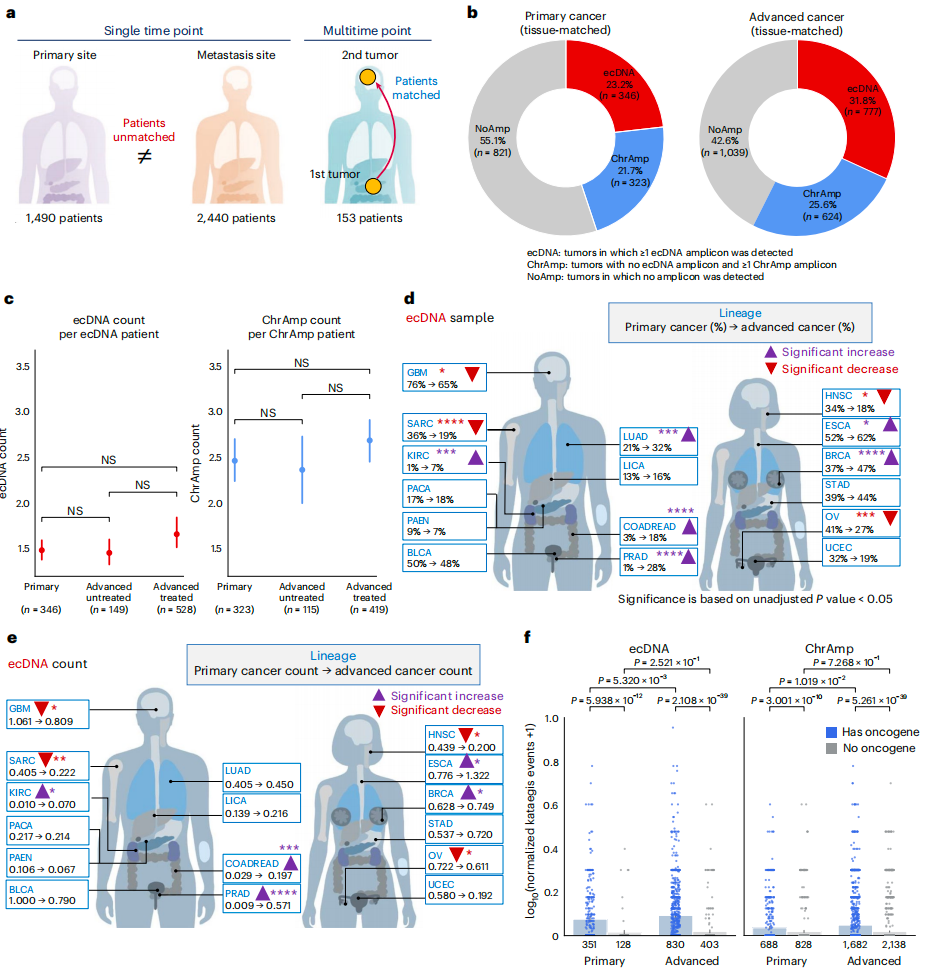
图1. 样本分类概述
02 ecDNA在癌症中的临床关联
通过对原发性和晚期癌症队列样本进行分析,研究团队证实新诊断肿瘤中ecDNA扩增子的存在与不良预后相关。与原发性癌症队列相比,未经治疗HMF患者肿瘤中ecDNA数量显著较高;在经治疗HMF患者肿瘤中,ecDNA数量进一步增加。
原发癌症队列、未治疗和接受治疗的晚期癌症队列的重采样分析显示,治疗暴露后的ecDNA频率增加与肿瘤类型无关,但与接受治疗次数相关。相较其他治疗方法,化疗与ecDNA频率的关联性最强。与晚期队列中未治疗的肿瘤相比,接受靶向治疗的患者肿瘤含有更少的ecDNA;此外,使用在ecDNA上扩增的癌基因抑制剂进行治疗不会导致ChrAmp的形成。
为研究不同类型的化疗是否与ecDNA数量有不同关联,研究团队将化疗药物根据机制分为抗代谢物、DNA损伤剂和微管蛋白抑制剂三种类型。结果显示,接受微管蛋白抑制剂治疗的患者具有更高ecDNA频率,表明抗微管蛋白治疗可能会导致基因组不稳定,从而促进新扩增子的形成。上述结果揭示,新获得的局灶性扩增可作为治疗反应标志物,并表明特定的抗癌治疗可能是扩增子形成的驱动因素。
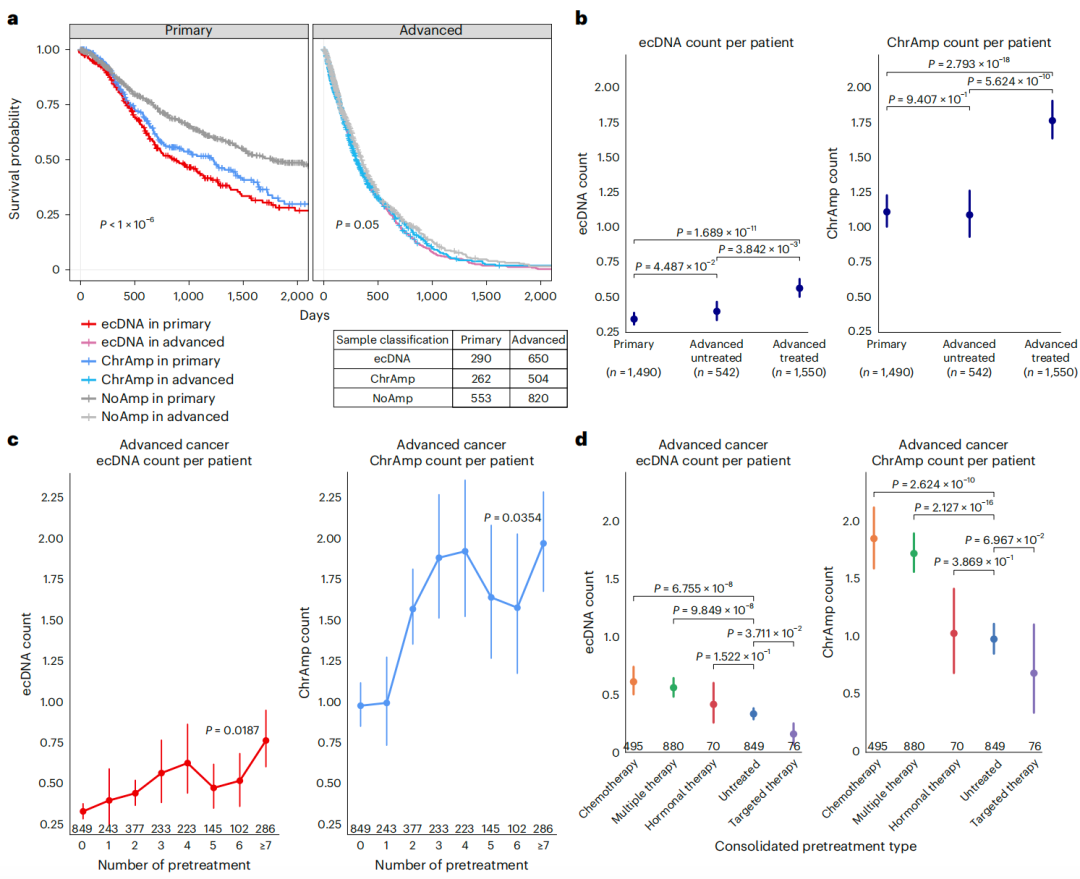
图2. ecDNA在癌症中的临床关联
03 ecDNA随着时间的推移被优先保留
研究团队分析了由TCGA、GLASS和HMF队列中153名患者组成的纵向队列,其包含多个时间点的WGS图谱。该队列包括70个胶质母细胞瘤和胶质瘤、18个前列腺癌、16个乳腺癌以及来自其他肿瘤类型的49个匹配样本。在第一个时间点(T1)检测到343个扩增子,其中55个为ecDNA;在T2检测到258个扩增子,其中61个为ecDNA。
为确定扩增子随时间而保持稳定的频率,研究团队以成对的方式确定了扩增子的相似性,并基于共享的断点和基因组内容,计算了两个具有重叠区域的扩增子之间的相似度指标。结果显示,T1中54.5% ecDNA扩增子和16% ChrAmp T1扩增子与T2扩增子相匹配。在多数情况下,被归类为ecDNA或ChrAmp的扩增子在T2保持其原有类别。
此外,研究团队还发现少数ecDNA会在癌症进展的过程中被ChrAmps取代,这一变化更可能是克隆选择的结果而非基因组重整合。具体而言,ecDNA克隆在T1肿瘤中占主导地位,但在T2肿瘤中被ChrAmp扩增子驱动的克隆所取代。在两个T1、T2时间点上,ecDNA扩增子在对应肿瘤中的匹配比例显著高于ChrAmp扩增子,表明ecDNA扩增子随着时间推移更有可能被保留。
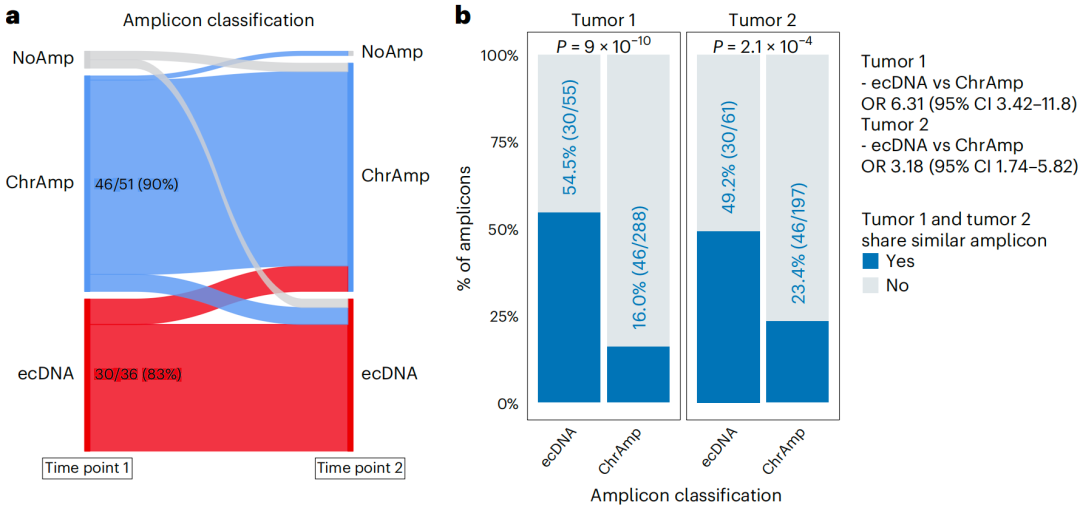
图3. 纵向扩增子分析
鉴于晚期癌症队列中ecDNA比原发性癌症队列中ecDNA有更高的kataegis发生率,研究团队评估了聚类突变事件频率。结果显示,ecDNA中的聚类突变事件数量显著多于ChrAmp;与单时间点扩增子相比,ecDNA和ChrAmp共享扩增子中含有一个或多个聚类突变事件的扩增子比例明显更高。
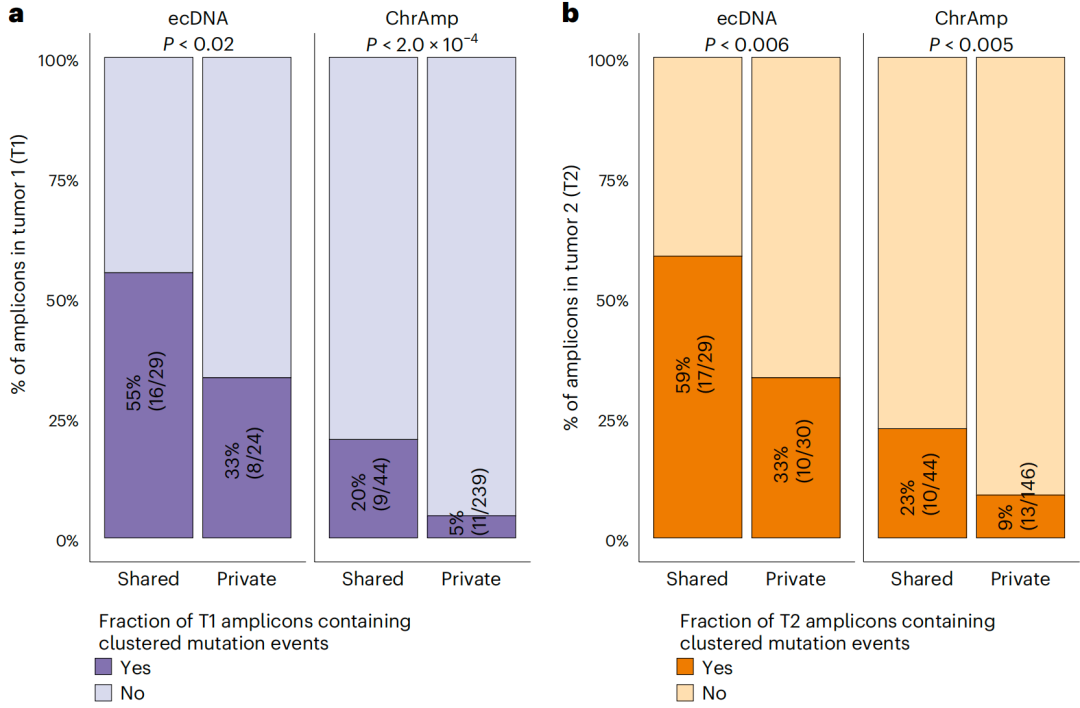
图4. 按扩增子类别划分的聚类突变事件
最后,研究团队评估了ecDNA和ChrAmp扩增子上聚类和非聚类突变的变异等位基因分数。在T1和T2时,聚类突变的变异等位基因分数显著高于非聚类突变;共享和特有(仅在一个时间点出现)ecDNA中聚类突变的变异等位基因分数无显著差异。
研究团队还推断了突变癌细胞比例,发现共享ecDNA上的突变癌细胞比例高于特有ecDNA;与非聚类突变相比,共享和特有T2聚类突变事件的癌细胞比例更高;ChrAmp扩增子也观察到类似模式。共享和特有ecDNA及ChrAmp在变异等位基因和癌细胞比例水平上的差异表明,共享的ecDNA经历了更长时间的选择。此外,相对于非聚类突变,聚类突变的变异等位基因和癌细胞比例更高,这表明聚类突变通常在扩增子早期发生。
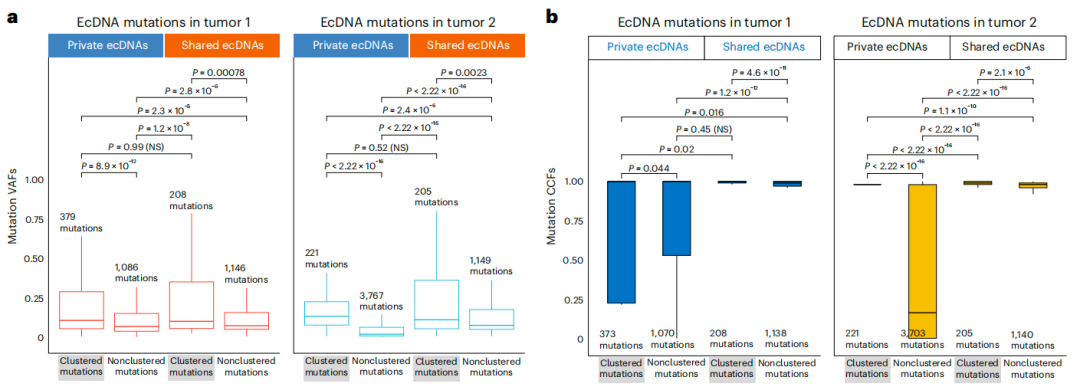
图5. 按突变类别划分的变异等位基因比例
综上所述,研究团队通过一个计算密集且标准化的分析流程,统一处理了来自8,060个不同癌症患者的WGS数据,比较了癌症诊断时和疾病晚期的ecDNA频率和特性。该研究发现ecDNA上的局灶性扩增在癌症中普遍存在,且在转移瘤和治疗过的肿瘤中的检出频率显著更高;染色体局灶性扩增外显率也随着肿瘤进展而增加;微管蛋白抑制剂对ecDNA和chramp的增加贡献最大。总之,该研究结果为开发针对ecDNA的抗癌治疗策略提供了支持。
参考文献:
Kim H, Kim S, Wade T, et al. Mapping extrachromosomal DNA amplifications during cancer progression. Nat Genet. 2024 Oct 14. doi: 10.1038/s41588-024-01949-7.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#抗癌# #ecDNA#
35