Cancer Cell | 淋巴结巨噬细胞 IL-33 信号通路在癌症免疫治疗耐受中的作用机制
2025-03-19 MedSci原创 MedSci原创 发表于陕西省
在癌症治疗中,免疫系统的作用至关重要,但免疫抑制现象常限制治疗效果。该研究揭示了淋巴结巨噬细胞(MSMs)通过分泌免疫调节细胞因子 IL-33,显著影响癌症治疗效果,为癌症治疗提供了新的靶点。
细胞凋亡是组织发育和维持过程中的关键环节,人体每天约有 3.3×10¹¹个细胞发生凋亡。这些凋亡细胞暴露的免疫原性成分需要被迅速清除,以防止自身免疫反应。这一过程诱导了免疫调节回路,使得组织驻留巨噬细胞(Mf)产生调节酶和细胞因子 IL-10,从而抑制炎症反应。然而,这种免疫抑制机制在癌症治疗中可能成为障碍,因为它会限制治疗诱导的抗肿瘤免疫反应。
在癌症治疗中,免疫系统的作用至关重要,但免疫抑制现象常限制治疗效果。近期,Cancer Cell杂志上发表的一项研究揭示了淋巴结巨噬细胞(MSMs)通过分泌免疫调节细胞因子 IL-33,显著影响癌症治疗效果,为癌症治疗提供了新的靶点。题目为“Lymph node macrophages drive immune tolerance and resistance to cancer therapy by induction of the immune-regulatory cytokine IL-33”

研究者使用 B16F10 黑色素瘤模型,通过向小鼠体内注射顺铂(一种化疗药物)来模拟临床化疗场景。他们观察了化疗后肿瘤细胞的凋亡情况,以及凋亡肿瘤细胞在肿瘤引流淋巴结(TDLN)中的分布和被不同免疫细胞亚群吞噬的情况。利用流式细胞术分析了 TDLN 中不同巨噬细胞和树突状细胞(DCs)亚群对肿瘤细胞碎片的吞噬能力,并检测了这些细胞表面免疫调节标志物的表达变化。
结果显示,化疗后,肿瘤细胞凋亡增加,凋亡的肿瘤细胞碎片在 TDLN 中积累,主要被髓窦巨噬细胞(MSMs)吞噬。MSMs 在吞噬凋亡肿瘤细胞后,表现出免疫抑制表型,包括高表达 PD-L1、CD39、CD73、CD36 和 MHCII 等免疫调节标志物。这些变化表明,MSMs 在化疗后被激活,增强了其清除凋亡细胞和诱导免疫耐受的能力。
研究者进一步分析了化疗后 TDLN 中 MSMs 的转录组变化,重点关注与免疫调节相关的基因表达。他们通过 RNA 测序技术比较了化疗处理与未处理小鼠的 TDLN 中 MSMs 的基因表达差异,并利用免疫荧光和流式细胞术检测 IL-33 蛋白的表达。此外,他们还通过体外实验验证了凋亡肿瘤细胞对巨噬细胞 IL-33 产生的影响,并探究了磷脂酰丝氨酸(PS)在其中的作用。
结果显示,化疗显著诱导了 MSMs 中 IL-33 的表达,且这种诱导依赖于 PS 介导的凋亡肿瘤细胞识别。IL-33 是一种具有强免疫调节功能的细胞因子,其在化疗后的表达增加表明它可能参与了化疗诱导的免疫抑制过程。进一步的实验表明,阻断 IL-33 受体(ST2)或在 MSMs 中特异性敲除 Il33 基因可以增强化疗的疗效,减少肿瘤生长。这表明 IL-33 在肿瘤治疗中起到了免疫抑制的关键作用,是限制化疗效果的重要因素。
研究者利用单细胞 RNA 测序技术分析了化疗或靶向治疗后 TDLN 中 ST2+ 免疫细胞的组成和转录组变化。他们重点关注了 CD4+CD25+FoxP3+ Treg 细胞,这些细胞在免疫抑制中起着关键作用。通过对比不同处理条件下的 Treg 细胞转录组数据,研究者揭示了 IL-33 对 Treg 细胞功能和成熟的影响。
结果显示,IL-33 主要激活 TDLN 中的 Treg 细胞,促进其成熟和功能增强。在化疗或靶向治疗后,TDLN 中的 Treg 细胞表现出更强的免疫抑制能力,这与 IL-33 的诱导密切相关。进一步的实验表明,阻断 IL-33 或在 MSMs 中敲除 Il33 基因可以减少 TDLN 中 Treg 细胞的数量和抑制功能,从而增强抗肿瘤免疫反应。这一发现揭示了 IL-33 在肿瘤免疫中的双重作用:一方面通过激活 Treg 细胞抑制抗肿瘤免疫,另一方面为干预肿瘤免疫提供了潜在的靶点。
基于上述发现,研究者探索了联合治疗策略的潜力。他们将 ST2 阻断抗体与化疗、靶向治疗或免疫检查点抑制剂(如抗 PD-1 抗体)联合使用,观察这种联合治疗对肿瘤生长和小鼠生存的影响。此外,他们还通过实验验证了这种联合治疗对肿瘤微环境中免疫细胞组成和功能的影响。
结果显示,联合治疗策略显著增强了抗肿瘤效果。与单独使用化疗或靶向治疗相比,联合 ST2 阻断抗体可以显著减少肿瘤生长,延长小鼠生存时间。这种联合治疗还改变了肿瘤微环境中的免疫细胞组成,增加了 CD8+ T 细胞的活性,减少了 Treg 细胞的抑制功能。这些结果表明,联合治疗能够克服肿瘤治疗中的免疫抑制障碍,为临床癌症治疗提供了新的思路。
综上所述,本研究深入探讨了淋巴结巨噬细胞在肿瘤治疗中的作用,特别是 IL-33 在其中的关键角色。研究揭示了化疗和靶向治疗诱导的免疫抑制机制,并提出了通过阻断 IL-33 信号通路来增强抗肿瘤免疫反应的新策略。这一发现不仅丰富了我们对肿瘤免疫调节机制的理解,也为开发新的癌症治疗手段提供了理论依据。
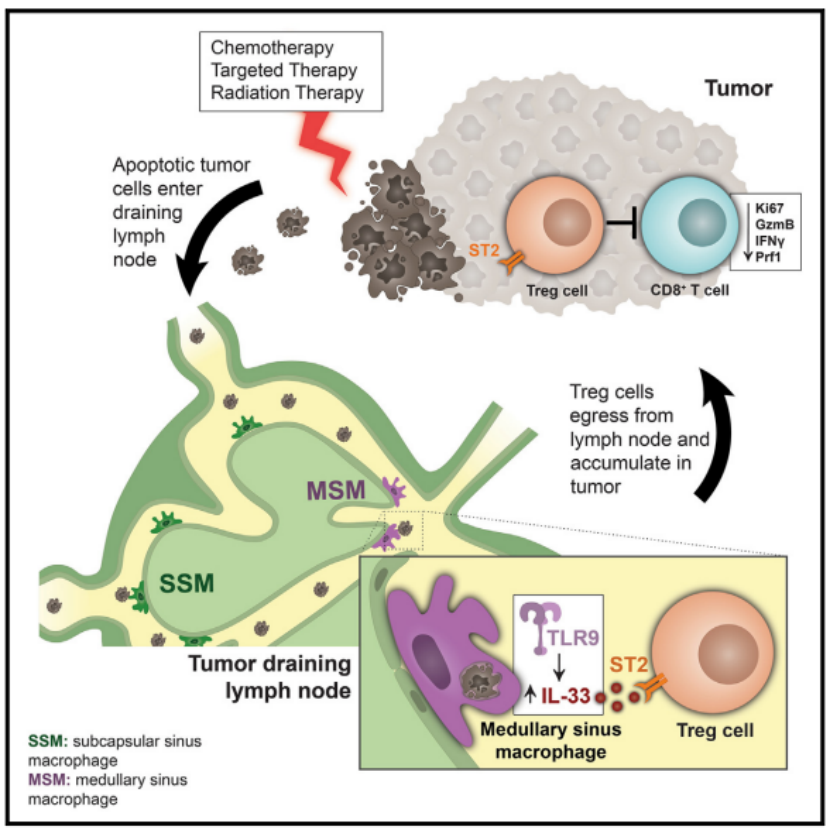
图 本研究模式图
原始出处:
Lymph node macrophages drive immune tolerance and resistance to cancer therapy by induction of the immune-regulatory cytokine IL-33. Cancer Cell. 2025 Mar 5:S1535-6108(25)00069-8. doi: 10.1016/j.ccell.2025.02.017. Epub ahead of print. PMID: 40054466.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言



















#癌症免疫治疗# #IL-33 信号通路#
9