安徽医科大学刘琦/南开大学刘阳AM:双功能溶酶体靶向嵌合体纳米平台用于肿瘤选择性蛋白降解和癌症免疫治疗
2025-02-05 BioMed科技 BioMed科技 发表于陕西省
安徽医科大学刘琦副教授联合南开大学刘阳教授构建了一种可以利用溶酶体降解途径实现细胞外蛋白、膜蛋白降解的新型LYTAC纳米平台(NLTC)。
靶向蛋白降解技术可以利用细胞固有蛋白降解系统,选择性清除目标蛋白,已经成为一种新颖的治疗方式。例如,溶酶体靶向嵌合体(LYTAC)策略,可以将细胞外或膜蛋白转运到溶酶体中进行降解。尽管LYTAC优势明显,但其肿瘤临床应用依然受限。第一,细胞或组织选择性LYTAC体系目前仍然缺乏,脱靶效应会引发严重的毒副作用;第二,现有LYTAC的代谢动力学和肿瘤富集较差;第三,传统LYTAC需要复杂的设计合成,蛋白和溶酶体靶向受体结合配体的固定比例难以调整;第四,实体瘤的复杂性和异质性严重削弱了单一疗法的疗效。
鉴于此,安徽医科大学刘琦副教授联合南开大学刘阳教授构建了一种可以利用溶酶体降解途径实现细胞外蛋白、膜蛋白降解的新型LYTAC纳米平台(NLTC)。该研究近日以“A Bifunctional Lysosome-Targeting Chimera Nanoplatform for Tumor-Selective Protein Degradation and Enhanced Cancer Immunotherapy”为题在线发表在《Advanced Materials》。论文通讯作者为安徽医科大学刘琦副教授和南开大学刘阳教授,安徽医科大学为第一通讯单位,该研究得到了国家自然科学基金,安徽省高校自然科学重点项目,安徽省自然科学基金等项目的支持。

NLTC是一种具有功能表面的聚合物纳米胶囊,通过原位聚合技术在单个蛋白表面整合蛋白靶向配体、溶酶体靶向受体结合配体制备(图1)。研究表明NLTC表面整合丙烯酰化二硝基苯酚(Ac-DNP)和丙烯酰化BMS-8(Ac-BMS)后可以分别靶向细胞外抗DNP抗体和肿瘤细胞表面的PD-L1。区别于现有LYTAC策略,NLTC还能够整合其它免疫调节功能。利用NLTC包载过氧化氢酶可以有效催化肿瘤组织内H2O2分解为O2,从而缓解免疫抑制性肿瘤微环境。为增强肿瘤富集和实现肿瘤选择性蛋白降解,对NLTC表面进行响应性修饰可以避免NLTC在血液循环和正常组织中的非特异性激活。动物实验结果证明,NLTC在静脉注射后能有效降解肿瘤细胞表面的PD-L1并缓解肿瘤免疫抑制性微环境,最终抑制恶性肿瘤的生长、复发和转移。
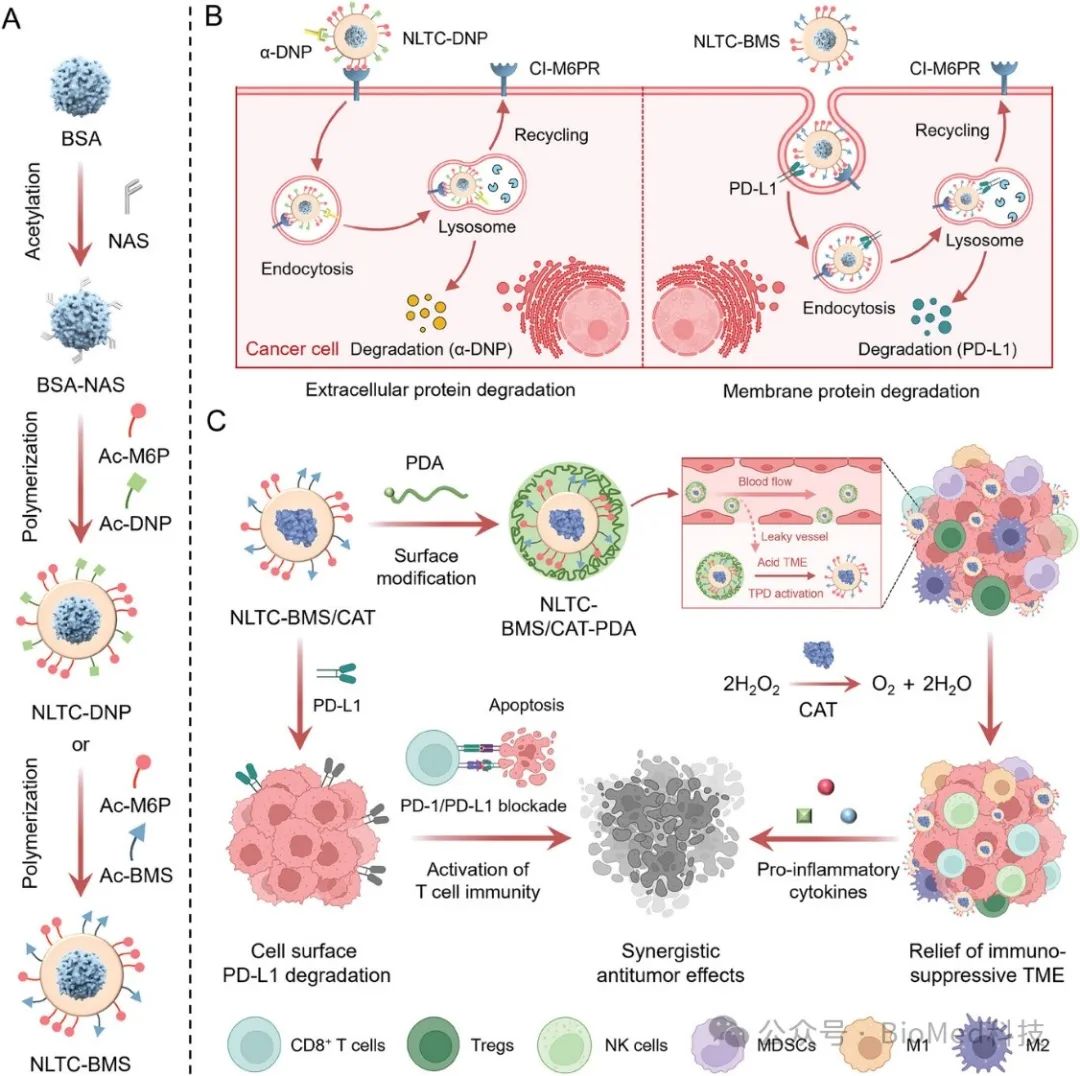
图1. 用于肿瘤选择性蛋白降解和癌症免疫治疗的LYTAC 纳米平台示意图
原文链接:
https://doi.org/10.1002/adma.202417942
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















#癌症免疫治疗# #NLTC#
13