PNAS:南方医科大学毕恩广团队研究表明IFN-γ诱导的I型干扰素应答网络通过IRF7增强th17来源的Th1细胞的抗肿瘤功效
14小时前 iNature iNature 发表于陕西省
南方医科大研究发现肿瘤内 Th171 细胞,具强抗肿瘤力且耗竭少,源于 Th17 后转分化,IFN -γ 经 IRF7 促其低耗竭与高 ECM1 表达,为抗癌策略添思路。
在癌症免疫治疗中,CD4+ T细胞的重要性正逐渐受到重视。特别是同时共表达辅助性T细胞1型(Th1)和Th17标志物的特定CD4+ T细胞亚群展现出了显著的抗肿瘤潜力。然而,这些细胞的分化及其后续抗肿瘤反应的潜在机制尚未完全阐明。
2024年11月14日,南方医科大学毕恩广,徐啊白和Yu Hu共同通讯在PNAS 在线发表题为 “Augmenting antitumor efficacy of Th17-derived Th1 cells through IFN-γ-induced type I interferon response network via IRF7” 的研究论文。该研究通过对单细胞RNA测序(scRNA-seq)数据的再分析,在肿瘤组织中发现了Th171细胞的存在。随后的轨迹分析显示,这些Th171细胞最初在Th17条件下被激活,然后转化为分泌IFN-γ的细胞。
沿着体内Th171细胞的分化轨迹,研究人员成功建立了体外Th171细胞培养体系。转录组分析显示,体外生成的Th171细胞与肿瘤浸润性Th171细胞在基因表达上具有高度相似性。Th171细胞展现出比Th1或Th17细胞更强的抗肿瘤反应。此外,基于Th171的嵌合抗原受体T细胞(Th171 CAR-T)在消灭实体瘤方面表现出更高的效率。值得注意的是,Th171细胞显示出早期耗竭表型,同时保留干性特征。在机制上,Th171细胞通过依赖细胞外基质蛋白1(ECM1)的途径表现出更快的迁移能力,并在肿瘤中更高效地积累。此外,研究表明,IFN-γ通过上调IRF7促进I型干扰素反应网络和ECM1表达,同时降低了Th171细胞的耗竭状态。综上所述,该研究将Th171细胞定位为改进针对实体肿瘤免疫治疗的理想候选者,为开发更有效的癌症治疗策略提供了新思路。

过继性T细胞转移(ACT)在治疗血液系统疾病患者方面展现了显著疗效,目前也在针对实体瘤开展广泛的临床试验。然而,迄今为止,实体瘤的治疗效果仍然有限。主要障碍之一在于体外扩增的T细胞通常表现为终末分化和耗竭状态,主要原因是扩增过程中使用的高浓度白介素-2(IL-2)。转移后的细胞在回输后往往难以长期存活。因此,科学家正积极探索改善体外扩增T细胞质量和功能的策略,以克服这一挑战。
近年来,单细胞RNA测序(scRNA-seq)等新技术揭示了肿瘤浸润T细胞中稀有但独特的亚群,这些亚群在清除癌细胞中具有关键作用。然而,分离这些稀有T细胞或在体外将其分化用于ACT仍面临重大挑战。CD4+ T细胞因其在免疫检查点抑制疗法和过继性T细胞治疗中控制肿瘤生长的能力而备受关注。除帮助CD8+ T细胞外,CD4+ T细胞的其他作用机制也被揭示,例如细胞毒性CD4+ T细胞直接杀死肿瘤(在抗PD-L1治疗的转移性膀胱癌患者中观察到),或向Th1型方向分化的CD4+ T细胞诱导癌细胞的炎症性细胞死亡。
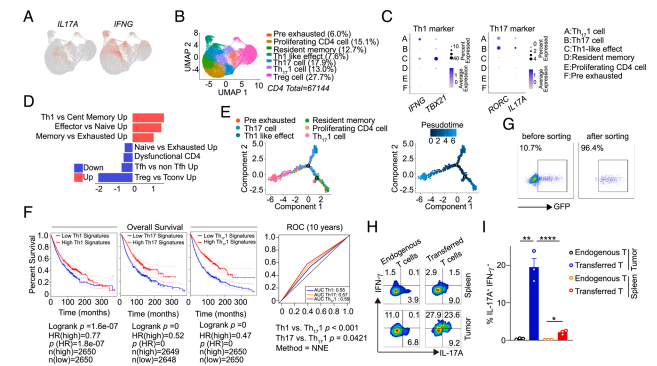
IL-17 +干扰素-γ+细胞存在于肿瘤微环境中,与患者生存呈正相关(图片源自PNAS)
在体内检测到的主要具有抗肿瘤功能的效应CD4+ T细胞亚群中,Th1和Th17细胞尤为突出。Th1细胞高表达T-bet和IFN-γ,具有显著的效应表型,但易于凋亡。Th17细胞高表达RORγt和IL-17,具有塑性并保留干性,但其抗肿瘤功能仍具争议。非典型Th1细胞或Th1/Th17杂合细胞(同时表达IFN-γ和IL-17)已在多种人类炎症性自身免疫疾病和相关小鼠疾病模型中被记录。值得注意的是,这些杂合Th1/Th17细胞表现出较强的疾病相关潜力。此外,体外分化的Th1/Th17细胞在转移至肿瘤小鼠中后显示出增强的抗肿瘤特性。然而,肿瘤微环境中同时表达IFN-γ和IL-17的T细胞的起源及其功能仍未明确,这些细胞卓越抗肿瘤功能的潜在机制也需要进一步研究。
在该研究中,作者报道了一种肿瘤内存在的Th17来源的Th1亚群(称为Th171),其数量与癌症患者的生存状态呈正相关。沿着Th171细胞的体内分化轨迹,作者成功地在体外培养了Th171细胞,并发现体外生成的Th171细胞在基因表达和功能途径上与肿瘤浸润的Th171细胞高度相似。Th171细胞及基于其的Th171 CAR-T细胞展现出卓越的抗肿瘤功能,并表现出更少的耗竭表型。ECM1在Th171细胞中高度表达,这使其在肿瘤中的迁移能力更强,并具有更优异的抗肿瘤效果。此外,作者提供了证据表明,IFN-γ诱导的IRF7是维持Th171细胞低耗竭状态和提高ECM1表达所必需的。
原文链接:
https://doi.org/10.1073/pnas.2412120121
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#癌症免疫治疗# #IFN-γ诱导#
3