肿瘤内战!《科学》揭示癌细胞自我瓦解的奥秘 | 文献时刻
2024-11-04 肿瘤医学论坛 肿瘤医学论坛 发表于上海
Science 论文介绍体内重编程树突状细胞的癌症免疫疗法,通过腺病毒递送转录因子增强其功能,在小鼠模型有效,公司推进临床试验,虽有挑战但具潜力。
《In vivo dendritic cell reprogramming for cancer immunotherapy》这篇发表在《Science》上的论文探讨了一种创新的癌症免疫治疗策略,通过在体内重新编程树突状细胞(DC),增强其抗肿瘤免疫应答能力。以下是对该论文的详细解读:

背景
树突状细胞是免疫系统中的关键抗原呈递细胞,负责捕获和处理抗原,并将其呈递给T细胞,从而启动和调节免疫应答。然而,在肿瘤微环境中,DC的功能常常受到抑制,导致免疫系统无法有效识别和攻击癌细胞。传统的DC疫苗需要体外培养和操作,过程复杂且成本高昂。因此,研究人员希望开发一种在体内直接重新编程DC的方法,以增强其功能。
研究目标
通过腺病毒递送转录因子PU.1、IRF8和BATF3,将肿瘤细胞体内重新编程为第1型常规树突状细胞,以增强抗原提呈能力,克服免疫治疗中常见的障碍。重新编程的肿瘤细胞改变了肿瘤微环境,促进多克隆杀伤性T细胞的招募和扩增,成功诱导肿瘤消退,并在多种小鼠黑色素瘤模型中建立长期免疫记忆。在人类肿瘤球和异种移植中,这一方法独立于通常限制免疫治疗的免疫抑制,为未来的癌症免疫治疗临床试验奠定了基础,展示了通过体内免疫细胞重编程以提高治疗效果的潜力。
研究方法
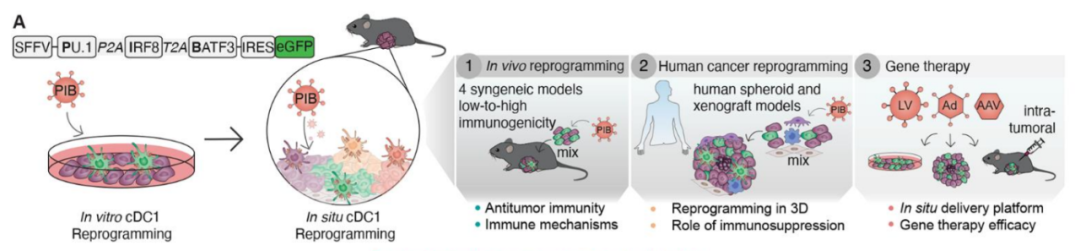
图片来源:参考资料[1]
-
树突状细胞的分离与体外预处理:从小鼠骨髓中提取树突状细胞,并使用荧光激活细胞分选技术确保细胞的纯度。这些树突状细胞在体外进行培养,以便后续处理和分析。
-
树突状细胞的体内重新编程:利用腺病毒载体(AAV)将特定转录因子(PU.1、IRF8和BATF3)导入树突状细胞,以进行体内重编程。通过荧光标记细胞以便追踪其在体内的分布和存活情况。这些转录因子组合能将肿瘤细胞重编程为1型常规树突状细胞(cDC1)。
-
重新编程树突状细胞的功能评估:通过流式细胞术和免疫组化技术,评估重新编程树突状细胞在体内的抗原呈递能力和T细胞激活能力。此外,评估了重编程树突状细胞在小鼠肿瘤模型中的抗肿瘤效果,包括肿瘤生长抑制和小鼠的生存率。
-
分子和基因表达分析:在重新编程的树突状细胞中,研进行了分子层面的分析,包括qRT-PCR和RNA-Seq技术,以探讨基因表达的变化。此外,通过染色质免疫沉淀测序(ChIP-Seq)研究转录因子在基因组中的结合位点及其调控机制。
研究结果
- 树突状细胞功能增强:实验结果显示,经过处理的DC表现出显著增强的抗原呈递能力,并能够更有效地激活T细胞。
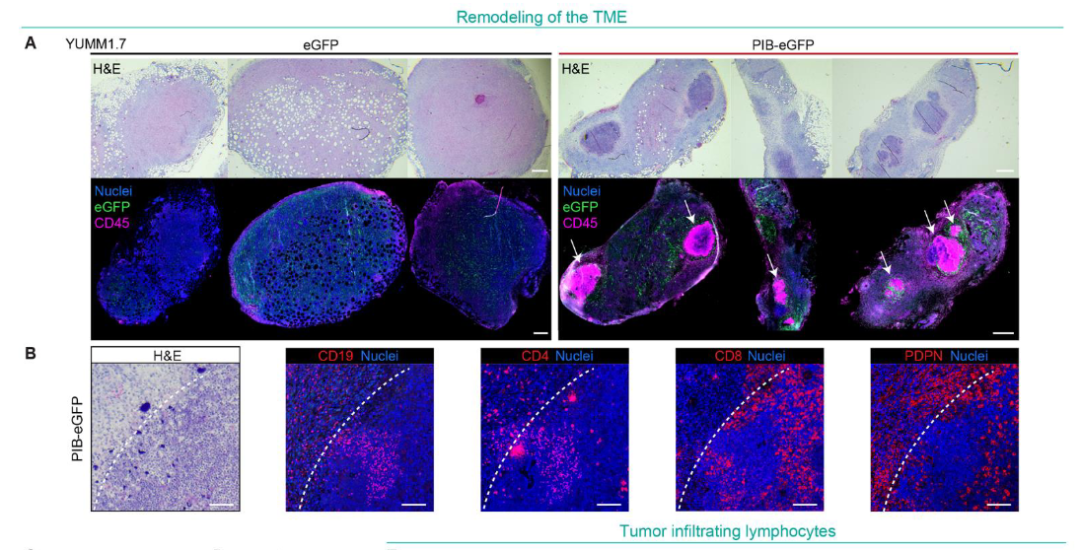
图片来源:参考资料[1]
重编程树突状细胞在抗原呈递和T细胞激活方面表现出显著优势。在体内存活率良好,它们能够有效地迁移到肿瘤部位并呈递癌细胞相关抗原。这些重编程树突状细胞可以激发强烈的T细胞免疫反应,显著抑制肿瘤的生长。
- 抑制肿瘤生长:在小鼠肿瘤模型中,重新编程的DC显著抑制了肿瘤生长,并提高了小鼠的生存率。
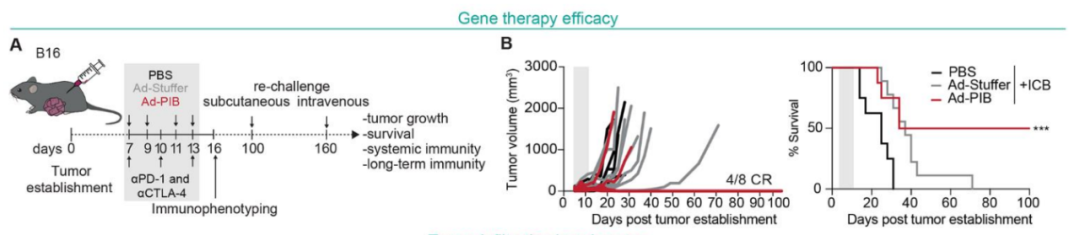
图片来源:参考资料[1]
在小鼠体内,诱导重编程产生了强烈的抗肿瘤免疫反应,包括在单药治疗条件下对难治性非免疫原性肿瘤的完全反应。仅需不到2%的诱导产生的cDC1细胞即可驱动完全反应,这支持了诱导细胞类型具有高度功能特化的观点。第一周的给药剂量足以驱动长期持久的系统性免疫反应,完全反应者在第160天时进行重新肿瘤接种挑战时仍保持无肿瘤状态,实现了防肿瘤复发。
-
安全性和特异性:纳米颗粒递送系统在体内表现出良好的安全性和特异性,未观察到明显的副作用或非靶向细胞的影响。
未来展望
基于这项研究,研究团队创立了一家名为Asgard Therapeutics的生物技术公司,致力于通过其创新疗法AT-108,在患者体内直接将肿瘤细胞重新编程为功能性1型常规树突状细胞(cDC1),以恢复肿瘤的免疫原性。该疗法利用无复制能力的腺病毒载体递送专有转录因子,重塑肿瘤微环境并启动全身抗肿瘤免疫反应,绕过传统细胞治疗的复杂性和局限性。自2021年以来,公司已完成多轮融资,计划将其主要项目AT-108在2026年之前推进到临床试验,旨在为癌症患者提供更安全、有效和个性化的治疗选择,可能彻底改变癌症免疫治疗的格局。
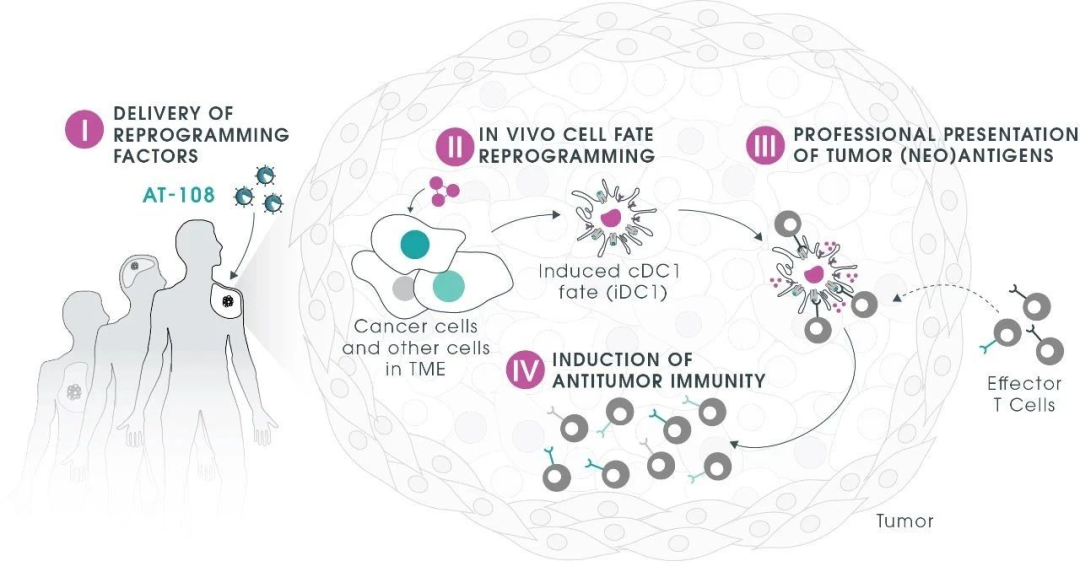
图片来源:参考资料[2]
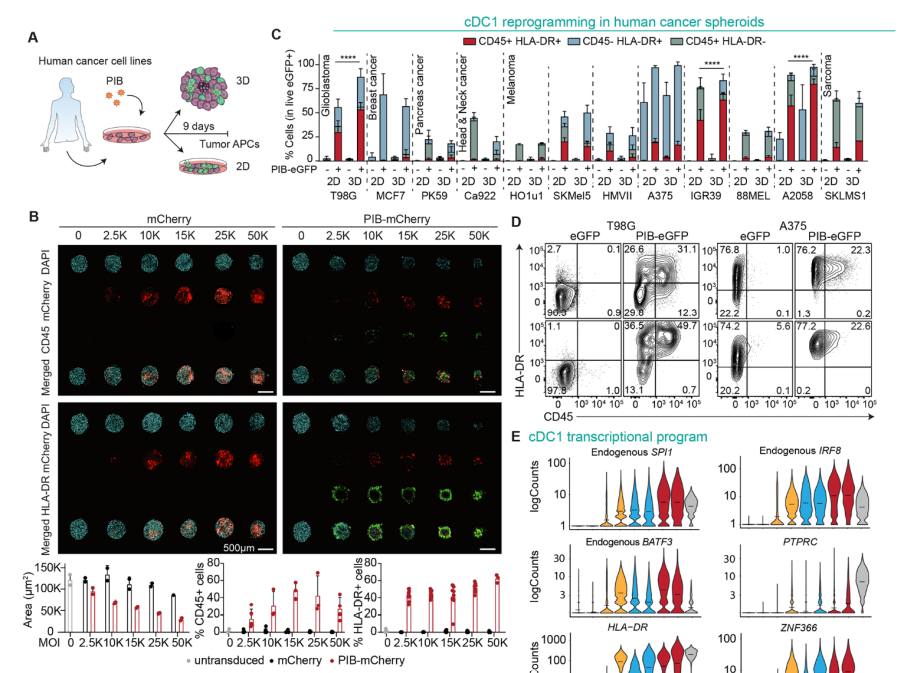
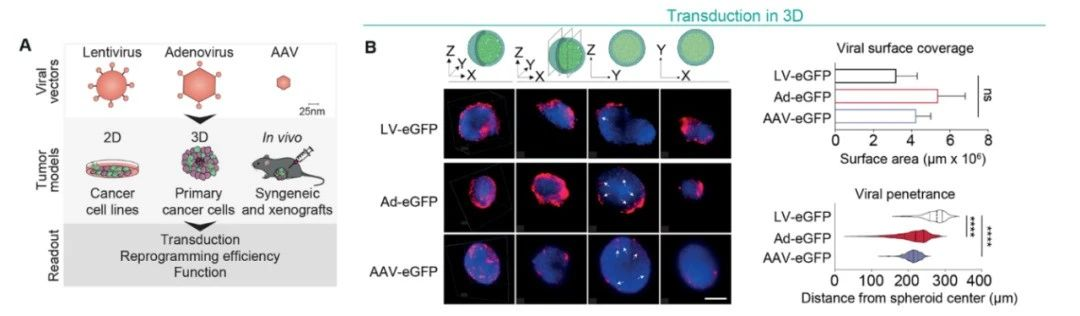
在人类癌细胞形成的球状体模型中,新策略也可以实现肿瘤重编程效果
图片来源:参考资料[1]
总之,重编程树突状细胞在抗癌治疗中展现了显著的潜力,通过增强树突状细胞的抗原呈递和免疫激活功能,提供了新的治疗视角。然而,要将这种方法应用于人类临床,还需克服多项挑战。首先,需要进行大量临床试验来验证其安全性和有效性,因为不同物种的免疫系统存在差异,可能影响结果的转化。此外,使用腺病毒载体可能引发免疫反应,其在人体内的长期表达和潜在副作用需进一步研究。确保高效的基因导入和防止基因毒性也是关键技术难点。尽管如此,这一方法与体外方法结合,可能实现更优的治疗效果。一旦成功应用,将为癌症患者带来新的治疗选择和希望。
参考资料:
[1] In vivo dendritic cell reprogramming for cancer immunotherapy. Science (2024). DOI: 10.1126/science.adn9083
[2] First-in-class immunotherapy reprograms tumor cells. Retrieved September 6, 2024 from https://www.nature.com/articles/d43747-024-00089-5
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#树突状细胞# #癌症免疫治疗#
16