STTT 西安交通大学刘恩岐教授团队发现新型三肽药物DT-109抗动脉粥样硬化的作用及机制
2025-04-13 论道心血管 论道心血管 发表于重庆
该研究揭示了新型三肽药物DT-109治疗AS的作用及机制。
心血管疾病(CVD)是危害人类健康的头号杀手,而动脉粥样硬化(AS)是其核心病理基础。尽管他汀类药物等降脂疗法在临床上广泛应用,但仅能降低约30%的CVD事件,患者仍面临显著的“残留风险”。这一治疗困境使得探索降胆固醇之外的协同干预策略,成为当前抗AS研究领域的重大挑战。
2025年4月7日,西安交通大学实验动物中心刘恩岐教授联合美国密西根大学陈育庆教授、五邑大学范江霖教授等团队开展的一项国际合作研究取得了突破性进展,在Signal Transduction and Targeted Therapy杂志发表了题为“Tripeptide DT-109 (Gly-Gly-Leu) attenuates atherosclerosis and vascular calcification in nonhuman primates”的研究论文,揭示了新型三肽药物DT-109治疗AS的作用及机制。

首先,该研究成功构建了高度模拟人类AS病理特征的非人灵长类动物模型—食蟹猴,在食蟹猴的主动脉和冠状动脉中精准再现了人类AS的典型病理特征,包括脂质条纹、纤维斑块、晚期复杂病变(如坏死核的形成、胆固醇结晶)以及钙化等(图1),相对于传统啮齿类动物模型,该食蟹猴模型首次完整模拟了人类AS的病理演进过程,凸显了该模型在研究人类AS发病机制和药物筛选中的独特价值。
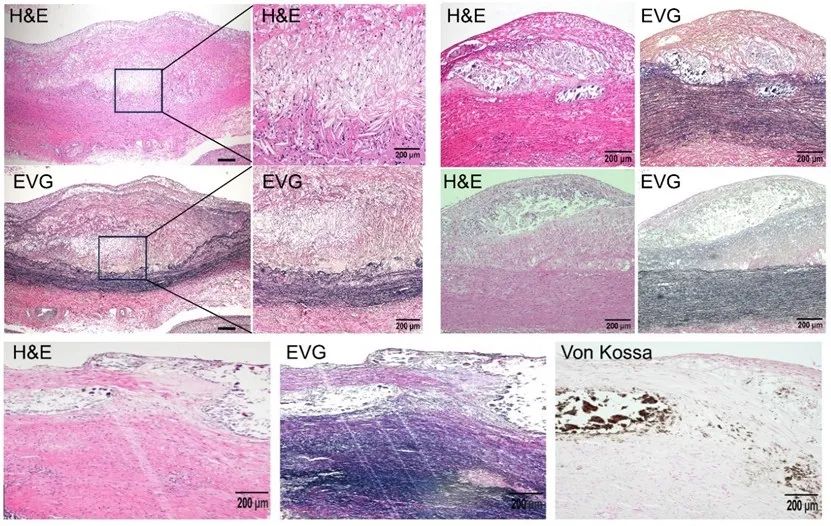
图1. 食蟹猴呈现出与人相似的AS损伤典型特征
基于食蟹猴动物模型,研究团队发现了新型三肽药物DT-109通过多靶点干预,显著改善AS病变,并抑制血管钙化(图2)。
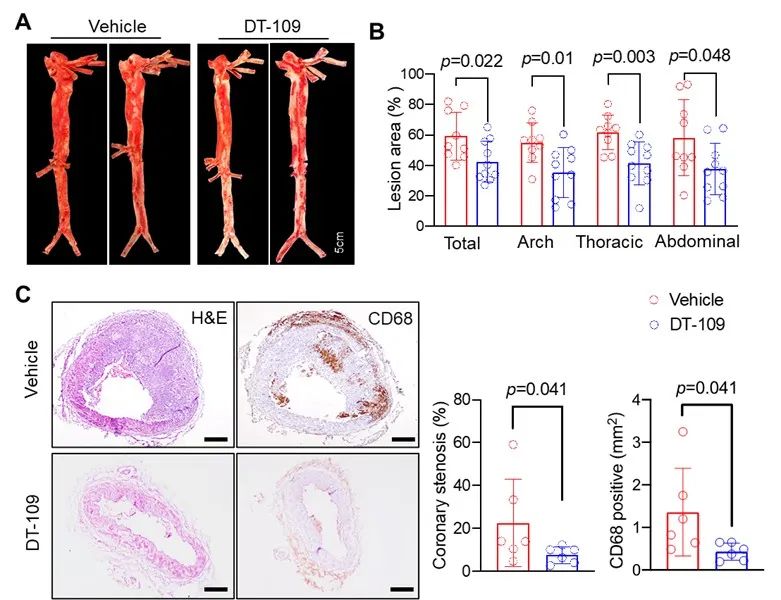
图2. DT-109显著改善食蟹猴主动脉和冠状动脉AS病理损伤
研究团队进一步发现,AS病变形成与血管钙化是长期脂质代谢紊乱、慢性炎症、氧化应激、平滑肌细胞表型转化等共同作用的结果。三肽DT-109通过多靶点干预上述病理过程,展现出显著的抗AS疗效(图3)。
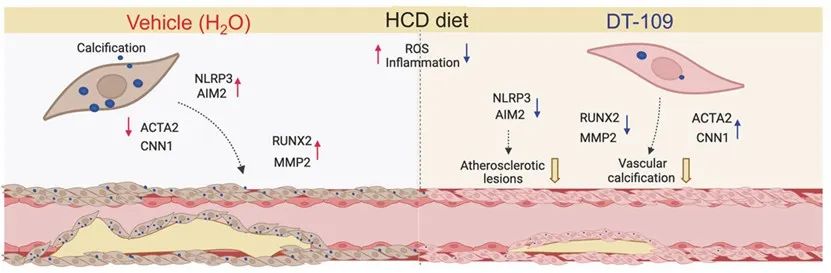
图3. DT-109抗AS作用机制图
值得一提的是,早在2023年,刘恩岐教授团队就在国际顶刊Cell Metabolism (2023;35:742-757)报道了DT-109在非人灵长类动物代谢功能障碍相关脂肪性肝炎(MASH)中的治疗潜力。此次研究进一步证实了该三肽药物对AS和MASH这两大代谢性疾病具有协同干预作用,为寻找多靶点治疗策略提供了新思路。目前,该国际研究团队继续推进DT-109抗病机制研究和临床前试验,以期为AS、MASH等疾病的精准治疗提供更多方案。
论文共同第一作者为西安交通大学实验动物中心博士生贾林莹和屈鹏祥副教授,刘恩岐教授为末位通讯作者,陈育庆教授和范江霖教授为共同通讯作者。密歇根大学张继锋教授为本研究做出了重要贡献。
文章链接:
https://www.nature.com/articles/s41392-025-02201-2

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















感谢老师分享的内容
12
#动脉粥样硬化# #DT-109#
12